T.C.
ADANA VALiLiGi
Halk Sağlığı Müdürlüğü
: LLO:$
~a~ı
1\:011 U
i :l.!
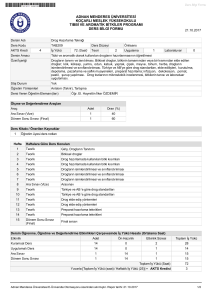
Yaklaşık Malıyet
YAKLAŞıK
MALivETE
..................................................
ADA:'-A
07
2012
ESAS FORM
MÜ ESS ES EsiN E
Mudurluğumuzunıhtıyacı
olan aşağıda cmsı, mıktarı ve ozelliklerı belırtılen (3) kalem malzemenm
[Cnıını ıçm. 4734 'ayılı Kamu Ihale Kanunun 9 maddesı gereğı yaklaşık maliyete esas olmak uzere,
Bırım liyatlarının bıldirılmesıni rica ederim.
Sıra No Bırım hyata Esas Iş Kalemınin Adı
i
Oral Rchidratas,on
2
~
Birimi
Tozu (ORS)
Mıktarı
Birim Fivatı(Tl)
Paket
20.000
Gebe Demır Preparatl
Kutu
50.000
Gebe D Vitamini
Adet
50.000
TOPLAM
EI..:
Tekııik Şartııaıne
(3 adet)
Öııeınli :'-otlar: En son yaklaşık fiyat bıldırım kabul tarıhı
!20 i 2 tarıhı mesaı saatı bıtımme kadardır
: Bırım fiyatlar uzerınden blldırdlğımz toplam bedel K D V harıç belırtilecektır
: Fıyatlar i lIrk Lırası olarak ,·erılecektır
irtibaı
\dresi:llalk
Sağlığı Mudurluğu Reşatbey Mahallesı 5 Ocak Caddesı no 53 Seyhan! ADANA
irtib:ıı Tel:~44191 i
i rtihat F:ı~:~44191
i
Toplam Fıyatl(Tl)
ADANA HALK SAGLIGI MÜDÜRLÜGÜ
GEBELERE DEMİR PREPARATI TEKNİK ŞARTNAMESİ 2012
KONU
Madde.l- Sağlık Bakanlığı tarafından yürütüle~,
"Gebelere Demir Destek Programı"
kapsamında, Adana Halk Sağlığı Müdürlüğü tarafından gebe kadınlara +2 veya +3 değerlikli
elementer demir preparatı desteğinin sağlanması amacıyla demir preparatı satın alınmasına
dair şartnamedir.
TEKNİK ÖZELLİKLER
Madde.2- Formülasyon: Preparatın i tablet/kapsül/draje'sinde 40-60mg günlük dozda demir
+2 veya demir+ 3 olacak şekilde elementer demir ihtiva edecektir. Preparatll1 formülüne giren
etken madde ve yardımcı maddeler farmokope ve diğer bilimsel standartlara uygun olacaktır.
İmalatçı bu hususlara ait bilgileri vermekle yükümlüdür. Ayrıca Kalsiyum, Magnezyum gibi
demir preparatl'arının emilimini olumsuz etkileyen madJeleri içennemekle birlikte, preparat
içerisinde elementler ve çeşitli vitaminler ihtiva edebilir.
Madde.3- Preparat hamileliğin tüm dönemlerinde ve emzinne dönemlerinde kullanıma uygun
olmalıdır. Günlük alınacak elementer demir miktarı, tek dozla karşılanabilmelidir.
MaddeA- Alınacak Preparat yürürlükteki EP, BP, USP, TF-1974 ve diğer bilimsel ulusal ve
uluslararası standartlara uygun olacaktır.
Madde.5- İhaleye girecek Firmanın, bu preparat
Kurumu'ndan ruhsatı olması gerekmektedir.
ıçın, Türkiye
İlaç ve Tıbbi Cihaz
AMBALAJ:
Madde.6- Birim Ambalajlar: Bir kutu 30 (otuz) adet tablet/kapsül/drajesinden
oluşan
blister ambalajlama ve etiketleme yönetmeliği doğrultusunda, Bakanlı~ımız Türkiye İlaç ve
Tıbbi Cihaz Kuru1l1uca onaylanmış olan birim ambalajında olacaktır.
Madde.7- İç kutular ve Dış koliler: 50 adet birim ambalaj önce mukavvadan yapılmış küçük
kutu ambalajlara (iç kutu) konacak, 10 küçük kutı' ambalaj da taşıma ve depolama için tahta
veya dayanıklı çift ondülinli, mukavvadan yapılmış büyük nakliye ambalajlarına (dış koli)
yerleştiri lecektir.
Madde.8- Her koli içinde aynı seriden ilaç bulunacaktır.
Madde.9- Ambalaj
edi Imcyecektir.
durumları
şaıtnamede
1\
\
yazılı maddelere
uymayan
preparatlar
kabul
ETİKETLEME
Madde.tOa-) İç kutu ve dış koliler üzerinde aşağıdaki bilgiler Türkçe olarak bulunacaktır:
•
•
•
•
•
•
•
•
•
Preparat adı,
Ruhsat Sahibi ve Üretici Firmanın adı ve adresi,
Ruhsat tarih ve numarası,
Üretim tarihi (ay/yıl olarak),
Son kullanma tarihi (ay/yıl olarak),
Seri numarası,
Depolama talimatı,
İçinde bulunan toplam birim ambalaj sayısı,
"ÜCRETSİzDİR SATILAMAZ" ibaresi,
b-) Birim am bala.i üzerinde aşağıdaki bilgiler Türkçe olarak yer alacaktır:
•
•
•
•
•
•
•
•
•
•
•
•
•
•
Preparat adı,
Ruhsat Sahibi ve Üretici Firmanın adı ve adresi
Ruhsat tarih ve numarası,
Üretim tarihi (ay/yıl olarak),
Son kullanma tarihi (ay/yıl olarak),
Seri numarası,
İlacın ismi,
Farmasötik şekli
Formülü,
Uyarılar/önlemler (çocuklar, gebeler, emzikliler, yaşlılar ve özel durumlar için uyarılar),
"BeklelUl1eyen bir etki görüldüğü takdirde doktorunuza başvurunuz" uyarısı,
Kullanım şekli,
Saklama koşulları.
"ÜCRETSİZDİR SATILAMAZ" ibaresi.
c-) PI'ospektüste şu bilgiler Türkçe bulunacaktır:
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
ilacın ismi,
Farmasötik şekli,
Formülü,
Farmakolojik özellikleri,
Endikasyonları,
Kontrendikasyonları,
Uyarılar/önlemler,
Gerekiyorsa çocuklar, gebeler, emzikliler, yaşlılar ve özel durumlar için uyarılar,
Yan etkiler/Advers etkiler,
"Beklemneyen bir etki görüldüğü takdirde doktoruımza başvurunuz" uyarısı,
İlaç etkileşmeleri ve diğer etkileşmeler,
Kullanım şekli,
Doz aşımı halinde alınacak tedbirler,
Saklama koşulları,
Ticari takdim şekli ve ambalaj muhtevası.
Piyasada mevcut diğer farmasötik dozaj şe illeri,
Ruhsat sahibinin isim ve adresi,
2 ,
•
•
•
•
Ruhsat tarih ve numarası,
Üretim yeri isim ve adresi,
Varsa dağıtıcı isim ve adresi,
Reçeteli/Reçetesiz satılacağına dair kayıt.
SON KULLANMA TARİHİ
Madde 11- Satın alınacak ilaçların kullanma süresi en az 24 ay olacaktır. Adana Halk Sağlığı
MüdÜrlÜğÜnce teslim alınırken; en çok 1 (bir) yıl önce üretilmiş olacak ve Firma bunu
arkasında kullanım süresinin de beliıtildiği ve TÜrkiye İlaç ve Tıbbi Cihaz KurUlmı tasdikli
Ruhsatname fotokopisi ile belgeleyecektir.
Madde 12- Son kullanma tarihinin dolmasına 3 (üç) ay kala kurumca bildirildiği takdirde 15
(onbeş) gÜn içinde firma tarafından daha uzun sÜreli ilaçlar ile değiştirilecektir.
çEşİTLİ HÜKÜMLER
Madde 13- Her türlÜ analiz harcı yÜklenici firmaya aittir.
Madde 14- Satın alınan preparatlarda belirtilen kullanma süresi içinde stabilite yönÜnden bir
bozulma olduğu TÜrkiye Halk Sağlığı Kurumu raporu ile tespit edildiğinde kullanımı uygun
olmayan ilaç firma tarafından 3 ay içinde aynı miktarda ve uygun kalitede ilaç ile
değişti rİlecektir.
Madde 15- Bu şartnamede belirtilmeyen hususlar için idari şartname hükümleri geçerlidir.
Bu şartname ....!.....!..... tarihinde 3 sayfa halinde hazırlamnış olup; 15 maddeden ibarettir.
Dr. N r
.. reme Sağlığı Birimi Tbb.
~l
Sağlık Memuru
Ali ŞAHİ
Çocuk,Ergelı,Ka~1I1 vc~me
i
3 ,
Sağlığı Birimi
Çocuk,Ergelı,Kadın
ve Ürem
KALMıŞ
i
Birimi Sorumlu Tbb.
ADANA HALK SAGLIGI MÜnÜRLÜGÜ
D VİT AMİNİ TEKNİK ŞARTNAMESİ 2012
KONU
Madde 1- Sağlık Bakanlığı tarafından yürütülen "Gebelere D Vitamini Destek Programı"
kapsamında Adana Halk Sağlığı Müdürlüğü'nce D Vitamini (damla) satın alınmasına dair
şartnamedir.
TEKNİK ÖZELLİKLER
Madde 2- Formülasyon: Preparatın 15 mL si yaklaşık 50.000 Ünite Vit.D3 ihtiva edecektir.
Ek bir etken madde içermemelidir. Preparatın formülüne giren etken madde farmakope ve
diğer bilimsel standartlara uygun olacaktır. imalatçı bu hususlara ait bilgileri vermekle
yükümlüdür.
Madde 3- Preparat, 15 mL solüsyon içeren koyu renkli, kapaklı cam şişede, nontoksik plastik
damlalıklı olacaktır.
Madde 4- Etken madde için ekses doz kullanılıyor ise, ilave doz miktarı formülde yüzde
nispeti şeklinde ayrıca bildirilecektir.
Madde 5- Alınacak Preparat yürürlükteki EP, BP, DSP, TF-1974 ve diğer bilimsel ulusal ve
uluslararası standartlara uygun olacaktır.
Madde 6- ihaleye girecek Firmanın, bu preparat
Kurumu'ndan aldığı ruhsat! olması gerekmektedir.
ıçın, Türkiye
ilaç ve Tıbbi Cihaz
AMBALAJ:
Madde 7- Birim Ambalajlar:
15 mL solüsyon içeren şişeler, ambalajlama ve etiketleme
yönetmeliği doğrultusunda, Bakanlığınuz Türkiye ilaç ve Tıbbi Cihaz Kurumu'nca
onaylanmış olan birim ambalajında olacaktır.
Madde 8- İç kutular ve Dış koliler: 20 adet birim ambalaj önce mukavvadan yapılmış
küçük kutu ambalajlaı'a (iç kutu) konacak, 10 küçük kutu ambalaj da taşıma ve depolama için
tahta veya dayanıklı, çift ondülinli, mukavvadan yapılmış büyük nakliye ambalajlarına (dış
koli) yerleştirilecektir.
Madde 9- Her koli içinde aynı seriden ilaç bulundurulacaktır.
Madde 10- Ambalaj durumları
edi lmeyecektir.
L~
şartnamede yazılı maddelere uymayan preparatlar kabul
ETİKETLEME:
Madde ll-Ca) İç kutu ve Dış koliler üzerinde
bulunacaktır:
Preparat adı,
Ruhsat Sahibi ve Üretici Firmanın adı ve adresi,
Ruhsat tarih ve numarası,
Üretim tarihi (ay/yıl olarak),
Son kullaıuna tarihi (ay/yıl olarak),
Seri numarası,
Depolama talimatı
İçinde bulunan toplam birim ambalaj sayısı
" ÜCRETSİzDİR SATILAMAZ " ibaresi,
aşağıdaki
bilgiler Türkçe
olarak
ll-Cb) Birim ambalaj ve Şişe etiketi üzerinde aşağıdaki bilgiler Türkçe olarak yer
alacaktır:
Preparat adı,
- Ruhsat Sahibi ve Üretici Firmanın adı ve adresi,
- Ruhsat tarih ve numarası,
- Üretim tarihi (ay/yıl olarak),
- Son kuııanma tarihi (ay/yıl olarak),
- Seri numarası,
- ilacınismi
- Farmasötik şekli, içerdiği çözelti miktarı
Formülü
- Uyanlar/önlemler ( çocuklar, gebeler, emzikliler, yaşlılar ve özel durumlar için uyarılar)
- "Beklenmeyen bir etki görüldüğü takdirde doktoruııııza başvurunuz"uyarısı
- Kullanım şekli
Saklama koşuııarı
"ÜCRETSİzDİR SATILAMAZ" ibaresi
ll-Cc) Prospektüste şu bilgiler Türkçe olarak bulunacaktır:
- ilacın ismi
Farmasötik şekli
Formülü
Farınakolojik özellikleri
Endikasyonları
Kontrendikasyonları
Uyarılar/önlemler
Gerekiyorsa çocuklar, gebeler, emzikliler, yaşlılar ve özel durumlar için uyarılar
Yan etkiler/Advers etkiler
"Beklenmeyen bir etki görüldüğü takdirde doktorunuza başvurunuz"uyarısı
ilaç etkileşmeleri ve diğer etkileşmeler
Kuııanım şekli
Doz aşımı halinde alınacak tedbirler
Saklama koşulları
Ticari takdim şekli ve ambalaj muhtevası
Piyasada mevcut diğer farmasötik d aj şekilleri
Ruhsat sal· inin isim ve adresi
2
.ot
\
Ruhsat tarihi ve numarası
Üretim yeri isim ve adresi
Varsa dağıtıcı isim ve adresi
Reçeteli/reçetesiz satılacağına dair kayıt
SON KULLANMA TARİHİ
Madde 12- Satın alınacak ilaçların kullamna süresi en az 36 ay olacaktır. Adana Halk Sağlığı
MÜdÜrlÜğÜnce teslim alınırken; en çok 1 (bir) yıl önce üretilmiş olacak ve Firma bunu
arkasında kullanım süresinin de belirtildiği ve Türkiye İlaç ve Tıbbi Cihaz Kurumu tasdikli
Ruhsatname fotokopisi ile belgeleyecektir.
Madde 13- Son kullanma tarihinin dolmasına 3 (üç) ay kala kurumca bildirildiği takdirde
(onbeş) gün içinde firma tarafından daha uzun süreli ilaçlar ile değiştirilecektir.
ı5
çEşİTLİ HÜKÜMLER
Madde 14- Her türlü analiz harcı yüklenici firmaya aittir.
Madde 15- Satın alınan preparatlarda belİItilen kullamna süresi içinde stabilite yönünden bir
bozulma olduğu Türkiye Halk Sağlığı Kurumu raporu ile tespit edildiğinde kullanımı uygun
olmayan ilaç firma tarafından 3 ay içinde aynı miktarda ve uygun kalitede ilaç ile
değiştirilecektir.
Madde 16- Bu şartnamede beliıtilmeyen hususlar için idari şartname hükümleri geçerlidir.
Bu şartname .. ..!. ....!. .... tarihinde 3 sayfa halinde hazırlanmış olup; 16 maddeden ibarettir.
Dr.
Çocuk,Ergen,Kadın
Ali ŞAl1'iN '.
Çocuk,Ergel1,Kadın
.
~:
i .
..
ve Ureme Sağlığı Birimi
. ,'-7.
ve Üre
u ten KALMıŞ
e
Iığı Birimi Sorumlu Tbb.
ADANA HALK SAGLIGI MÜnÜRLÜGÜ
ORS TEKNİK ŞARTNAMESİ 2012
KONU
ı.
Madde
Adana Halk Sağlığı Müdürlüğü
rchidratasyon tozu satın alınacaktır.
tarafından
aşağıda belirtilen
özelliklerde
oral
TEKNİK ÖZELLİKLER
Madde 2. FORMÜLASYON
ı litre su için kullanılacak bir poşet içeriği (*):
Sodyum klorür
2,60 gr
Trisodyum sitrat dihitrat
2,90 gr
Potasyum klorür
i,50 gr
GWkoz anlıidr
13,50 gr ihtiva etmelidir.
(*) Dünya Sağlık Örgütü'nün yenilenmiş formuW.
Madde 3. Alınacak Preparat yürürlükteki
uluslararası standartlara uygun olacaktır.
EP, BP, USP, TF-1974
ve diğer bilimsel ulusal ve
Madde 4. ihaleye girecek Firmanın, bu preparat için, Türkiye ilaç ve Tıbbi Cihaz
Kurumu'ndan aldığı ruhsatı vermek zorundadır.
AMBALAJ:
Madde 5. Preparat Türkiye ilaç ve Tıbbi Cihaz Kurumu'nca onaylamnış olan ve üzerinde
madde 9'daki bilgileri içeren birim ambalajında olacaktır. Firma ambalaj ebat
spesifikasyonlarını
Türkiye İlaç ve Tıbbi Cihaz Kurumundan almış olduğu belge ile
bel gelendiri lecektir.
Madde 6. İç kutular ve Dış koliler: 200 adet poşet önce mukavvadan yapılmış küçük kutulara
konacak, taşıma ve depolama için 2 veya 4 adet küçük ambalaj dayanıklı, büyük nakliye
am balaj ları na yerleştirilecektir.
Madde
7. Her koli içinde aynı seriden ilaç bulunacaktır.
ETİKETLEME
Madde 8. iç kutu ve Dış koliler üzerinde
aşağıdaki
bilgiler Türkçe olarak bulunacaktır:
Preparat adı,
Ruhsat Sahibi ve Üretici Firmanın adı ve adresi,
Ruhsat tarih ve numarası,
Üretim tarihi (ay/yıl olarak),
Son kullanma tarihi (ay/yıl olarak),
Seri numarası,
Depolama talimatı
içinde bulunan toplam birim ambalaj sayısı
"Ücretsizdir Satılamaz" ibaresi,
Madde 9. Birim ambalaj üzerinde Ek 1 ve 2' de verilen bilgiler bulunacaktır ve Ek 1 de yer
alan "TUZ ŞEKER KARıŞıMıNıN HAZIRLANIŞI" ifadesinin aıtında yer alan işlem
basamakları hem
21
olarak hem de fotO: ra; Y ~ekiııerıe
r
gösterilecektir.
SON KULLANMA TARİHİ
Madde 10. Preparatın kullamııa süresi en az 24 ay olacaktır. Firma tarafından süresinin de
belirtildiği Türkiye ilaç ve Tıbbi Cihaz Kurumu tasdikli ruhsatname fotokopisiyle
belgeleyecektir.
Madde lL. Son kullanma tarihinin dolmasına 3 (üç) ay kala kururnca bildirildiği takdirde IS
(onbeş) gün içinde firma tarafından daha uzun süreli ilaçlar ile değiştirilecektir.
çEşİTLİ HÜKÜMLER
Madde 12. Preparat teslim tarihinden en fazla 3 ay önce imal edilmiş olacaktır.
Madde 13. Her türlü analiz harcı mütahhit firmaya aittir.
Madde 14. Satın alınan preparatlarda belirtilen kullanma süresi içinde stabilite yönünden bir
bozulma olduğu Türkiye Halk Sağlığı KurUlllll raporu ile tespit edildiğinde kullanımı uygun
olmayan ilaç fırma tarafından 3 ay içinde aynı miktarda ve uygun kalitede ilaç ile
değiştiri lecektir.
Madde 15. Bu şaıtnamede belirtilmeyen hususlar için idari şaıtname hükümleri geçerlidir.
Şartname 15 maddeden ibarettir.
EK: 2
iSHALDE SU TUZ KAYBI iÇiN
TUZ ŞEKER KARlŞIMI
KULLANIŞI: arka yüzdeki talimata uygun olarak hazırlandıktan sonra ağızdan verilmelidir.
HER PAKETTE :
Sodyum klorür
2,60 gr/L
Trisodyum sitrat dihitrat
2,90 gr/L
Potasyum klorür
1,50 gr/L
Glükoz anhidr
13,50 gr/L
DiKKAT! Serin ve kuru yerde muhafaza kaydı ile son kuııaıuna tarihine kadar kuııanılabilir.
Delinmiş ve açılmış paketi kullaıunayınız.
PAKETİN: Seri numarası:
inıal tariılİ
Son Kuııannıa Tarihi
.,
Ruhsat Tarihi ve Numarası :
Ruhsat Sahibi ve Üretici Firmanın Adı ve Adresi:
2
.
.
.
.
EK:l
" ÜCRETSİZDİR SATILAMAZ"
TUZ -ŞEKER KARıŞıMı
KARIŞIMIN HAZIRLANIŞI
1
Kaynatılmış ve soğutulmuş 1 litre
( 5 su bardağı)
Suyu sürahi içine koyunuz
2
Paketi uygun yerinden
açarak sürahinin içine
boşaltınız.
3
Karışım eriyene kadar
iyice karıştırınız.
4
Hazırlanan bu karışımdan her
sulu kaka yapışında 2
yaşından küçüklere bir çay
bardağı 2-10 yaş arasındaki
çocuklara 2 çay bardağı,
daha büyüklere istediği kadar
ıçınnız.
ÖNEMLİ
Karışımı kesinlikle kaynatmayınız. Serin bir yerde ağzı kapalı kapta saklayınız. 24 saat
içerisinde tüketilmeyen kısmını atınız.
2
İshal süresince bebeğinizi
beslemeyi sürdürünüz.
1
İshal süresince bebeğinizi
emzirmeyi sürdürünüz.
----7
Dr. Nurte
DrAÖZ~v~
ÇOC"',E"f:;r,e,. ü"""
S'ğhg, Bi,imi Tbb.
/}
.
,i
Sağlık MenYlft1,Ali $AHİN
Çocuk,Ergeıı,')fctdııı ve. Ü/eıne Sağlığı Birimi
i
K
'I
.~-Y
Çocuk,Ergen,Kadın
ve Üreme Sa
ALMıŞ
rimi Sorumlu Tbb .