1. ÜNİTE: MODERN ATOM TEORİSİ
1.4.Elektron Dizilimi ve Periyodik Sisteme
Yerleşim
Atomun Kuantum Modeli oluşturulduktan sonra Bohr, yaptığı
çalışmalarda periyodik cetvel ile kuantum teorisi arasında bir ilişki olduğunu düşünmüştü. Bildiğiniz gibi atom numarası, bir elemente ait nötr atomların elektron sayısını gösterir. Elementlerin
elektron dizilimleri, fiziksel ve kimyasal özelliklerindeki benzerliklerin açıklanmasını sağlar.
9. sınıfta öğrendiğiniz gibi periyodik çizelgede yatay satırlara
periyot, düşey sütunlara ise grup adı verilir. Periyodik sistem,
herhangi bir grupta ve periyotta bulunan element atomunun kimyasal aktifliğini, genel özelliklerini açıklayıcı doğru tahminler yapmamıza yardımcı olur.
1
1
H
3
Li
4
2
19
20
21
37
38
39
55
56
87
Fr
Halojenler
Alkali Metaller
p Bloku Metalleri
Soy gazlar
Geçiş Metalleri
3
Ca Sc
Sr
Ba
Y
22
13
B
Ti
Aktinitler
23
5
V
24
6
25
7
26
8
9
27
Cr Mn Fe Co
28
10
Ni
29
11
30
12
Cu Zn
AI
51
52
53
54
82
83
84
85
114
115
116
117
118
48
49
72
73
74
75
76
77
78
79
80
81
104
105
106
107
108
109
110
111
112
113
Rf
W
Re Os
Ir
Db Sg Bh Hs Mt
Pt
Au Hg
Ar
50
Ga Ge
47
Ta
CI
Ne
18
36
46
Hf
S
F
17
He
10
35
45
Pd Ag Cd
P
O
16
17
9
34
44
Ru Rh
Si
N
15
16
8
33
43
Nb Mo Tc
C
14
15
7
32
42
Zr
14
6
18
31
41
89-103
Lantanitler
4
40
57-71
88
Ra
2
13
Na Mg
Cs
Toprak Alkali Metaller
Be
12
Rb
Yarı Metaller
5
11
K
Ametaller
In
TI
Ds Rg Cn Uut
Sn
Pb
As
Sb
Bi
Se
Te
Po
Br
I
At
Kr
Xe
86
Rn
FI Uup Lv Uus Uuo
57
58
59
60
61
62
63
64
65
66
67
68
69
70
71
89
90
91
92
93
94
95
96
97
98
99
100
101
102
103
La
Ac
Ce
Th
Pr
Pa
Nd Pm Sm Eu Gd Tb
U
Np Pu Am Cm Bk
Dy Ho
Cf
Er
Tm Yb
Es Fm Md No
Lu
Lr
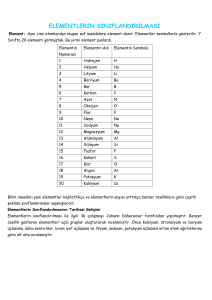
Şekil 1.27: Periyodik çizelgedeki elementlerin sınıflandırılması
Modern periyodik çizelge genellikle element sembollerini ve
atom numaralarını gösterir. Şekil 1.27’de periyodik çizelgedeki
elementlerin sembolleri, atom numaraları verilmiş ve sınıflandırmaları yapılmıştır. Modern periyodik çizelgede elementler 18
grup olarak düzenlenir. Gruplar elementlerin benzer özellikte
olanlarını bir araya getirir. Periyotlar ise enerji düzeylerini gösterir. Periyodik çizelgede ilk periyot hidrojen atomuyla başlar.
57
1. ÜNİTE: MODERN ATOM TEORİSİ
Bu periyoda sadece iki element yerleşmiştir. Hidrojenden ve hel-
Bilgi Kutusu
yumdan sonra elementler elektron dağılımlarının sonlandığı alt
kabuğun türüne göre sınıflandırılır. 1A grubundan, 7A grubuna
Atomların en dış kabuğun-
kadar olan elementler baş grup elementleri olarak isimlendiri-
daki toplam elektron sayısına
lir. Baş grup elementlerinin elektron dağılımında, en yüksek baş
değerlik elektron sayısı denir.
Bu elektronlar bir atomun diğer
atomlarla kimyasal etkileşime
girmesinde rol oynar.
kuantum sayılı s ve p alt kabukları tam dolu değildir. Soy gaz
olarak adlandırılan 8A grubu elementlerinde ise helyum hariç p
alt kabuğu tam doludur. Bu durumda helyumun elektron dağılımı
1s2, diğer soy gazların ise elektron dağılımları ns2 np6 ile sonlanır. d bloku olarak tanınan geçiş elementleri 3B’den başlayarak
1B dahil olmak üzere yerleşmiş elementlerdir. Bu elementler tam
dolu olmayan ya da iyonlarında tam dolu olmayan d alt kabuğu
ile sonlanır. Zn, Cd ve Hg elementleri 2B grubunda bulunur. Bu
elementler, baş grup elementi ya da geçiş elementi değildir. f alt
kabuğu ile sonlanan elementler f bloğu geçiş elementleri olarak
isimlendirilir. 4f alt kabuğu ile sonlananlar lantanitler, 5f alt kabuğu ile sonlananlar aktinitler olarak adlandırılır.
Tablo 1.7: 1A grubu elementlerinin
elektron dağılımları
1A Grubu
Li
Na
K
Rb
Cs
Fr
6He@ 2s
6Ne@ 3s
6Ar@ 4s
6Kr@ 5s
1
tin elektron dağılımında bir soy gaz göbeğine sahip olması da bu
1
1
2A Grubu
Mg
Ca
Sr
Ba
Ra
58
6He@ 2s
6Ne@ 3s
6Ar@ 4s
6Kr@ 5s
grubun taşıdığı benzer özelliklerdendir. 1A grubu elementleri alkali metaller olarak isimlendirilir. Bu grubun ilk üyesi olan hidrojenin elektron dağılımı 1s1 şeklinde olup hidrojen de grubun diğer
üyeleri gibi 1 değerlik elektronuna sahiptir. Ancak hidrojen ametaldir ve elektron dağılımında bir soy gaz göbeğine sahip değildir.
Tablo 1.8 incelendiğinde 2A grubu elementlerinin elektron da-
Tablo 1.8: 2A grubu elementlerinin
elektron dağılımları
Be
Tablo 1.7 incelendiğinde, 1A grubu elementlerinin elektron
dağılımlarının ns1 ile sonlandığı gözlemlenir. Grupta her elemen-
1
6Rn@ 7s
dağılımları incelendiğinde belirli bir düzen olduğu gözlemlenir.
1
1
6Xe@ 6s
Periyodik çizelgede aynı grupta bulunan elementlerin elektron
2
2
ğılımlarının ns2 ile sonlandığı gözlenir. Bu grupta da her element
elektron dağılımında bir soy gaz göbeğine sahiptir. 2A grubu elementleri toprak alkali metaller olarak isimlendirilir.
1A ve 2A grubu elementlerinin elektron dağılımları s alt kabuğu ile sonlandığı için s bloğu elementleri olarak sınıflandırılır. Atomların en dış orbitallerindeki elektronları bağ oluşumun-
2
da görev yapar. Genellikle çoğu atomda bu elektronlar değerlik
2
elektronu olarak adlandırılır. Baş grup elementlerinin değerlik
6Xe@ 6s
2
6Rn@ 7s
2
elektronları en yüksek enerjili orbitallerinde bulunur. Aynı grupta bulunan elementlerin değerlik elektron sayıları aynıdır. Aynı
gruptaki elementlerin kimyasal etkinliklerinde benzerlik olması
1. ÜNİTE: MODERN ATOM TEORİSİ
değerlik elektron sayılarının aynı olmasıyla ilişkilendirilebilir. Bu
durum 1A, 2A ve 7A grubu için söz konusudur. Ancak 3A grubundan 6A’ya kadar olan elementlerin özellikleri tam olarak değerlik
elektron sayılarının aynı olmasıyla bağlantılı değildir. Örneğin 4A
grubundaki tüm elementlerin elektron dağılımları ns2 np2 ile sonlanır. Ancak 4A grubundaki elementlerin kimyasal özellikleri arasında diğer gruplardakinin aksine farklılıklar vardır. Bu grupta yer
alan karbon atomu bir ametal, silisyum ve germanyum yarımetal,
kalay ve kurşun ise metal özellik gösterir.
Örnek
5
B, 6 C, 7 N, 8 O ve 9 F elementlerinin elektron dizilimlerini yazarak periyodik cetveldeki yerlerini
belirleyelim.
Çözüm
5
B: 1s 2 2s 2 2p 1
Bor (B) element atomunun elektron dizilimi p orbitalleri ile sonlandığı için element p bloğu elementidir. Değerlik elektronları 2s ve 2p orbitallerindedir. Değerlik elektron sayısı 3 olduğu için 3A
grubundadır. En yüksek baş kuantum sayısı 2 olduğu için 2. periyottadır.
6
C: 1s 2 2s 2 2p 2
Karbon (C) element atomunun elektron dizilimi p orbitalleri ile sonlandığı için element p bloğu
elementidir. Değerlik elektronları 2s ve 2p orbitallerindedir. Değerlik elektron sayısı 4 olduğu için 4A
grubundadır. En yüksek baş kuantum sayısı 2 olduğu için 2. periyottadır.
7
N: 1s 2s 2p
2
2
3
Azot (N) element atomunun elektron dizilimi p orbitalleri ile sonlandığı için element p bloğu elementidir. Değerlik elektronları 2s ve 2p orbitallerindedir. Değerlik elektron sayısı 5 olduğu için 5A
grubundadır. En yüksek baş kuantum sayısı 2 olduğu için 2. periyottadır.
8
O: 1s 2 2s 2 2p 4
Oksijen (O) element atomunun elektron dizilimi p orbitalleri ile sonlandığı için element p bloğu
elementidir. Değerlik elektronları 2s ve 2p orbitallerindedir. Değerlik elektron sayısı 6 olduğu için 6A
grubundadır. En yüksek baş kuantum sayısı 2 olduğu için 2. periyottadır.
9
F: 1s 2 2s 2 2p 5
Flor (F) element atomunun elektron dizilimi p orbitalleri ile sonlandığı için element p bloğu elementidir. Değerlik elektronları 2s ve 2p orbitallerindedir. Değerlik elektron sayısı 7 olduğu için 7A
grubundadır. En yüksek baş kuantum sayısı 2 olduğu için 2. periyottadır.
59
1. ÜNİTE: MODERN ATOM TEORİSİ
Soy gazlar da 8A grubu içinde benzer özelliklere sahiptir.
Kripton ve ksenon dışındaki 8A grubu elementleri kimyasal olarak tamamen inert gazlardır. Kriptonun ve ksenonun ise oluşturduğu bazı bileşikleri vardır. Soy gazların elektron dağılımlarının
tam dolu alt kabuklarla sonlanması, bu elementlerin kararlı olmalarını sağlar. 3A’dan 8A’ya kadar helyum hariç tüm elementlerin
elektron dağılımları p orbitalleri ile sonlandığından bu elementler
p bloğu elementleri olarak isimlendirilir.
Örnek
3. periyot 8A grubunda bulunan elementin elektron dizilimini yazarak atom numarasını belirleyelim.
Çözüm
Element 3. periyotta olduğuna göre, en yüksek baş kuantum sayısı 3 olmalıdır. 8A grubunda
olduğu için değerlik elektron sayıları toplamı 8 olup değerlik orbitalleri 3s ve 3p orbitalleridir. Bu durumda elementin elektron dizilimi aşağıdaki gibidir.
1s 2 2s 2 2p 6 3s 2 3p 6
Elementin nötr hâldeki elektron sayısı toplamı atom numarasına eşittir. Bu durumda atom numarası 18’dir.
Örnek
+2 yüklü iyonunun elektron dağılımı 3p63d6 orbitalleriyle sonlanan elementin atom numarasını
belirleyelim.
Çözüm
Öncelikle +2 yüklü iyonun elektron dağılımını yazalım.
1s 2 2s 2 2p 6 3s 2 3p 6 3d 6
+2 yüklü iyonunda toplam 24 elektron bulunan atomun nötr hâldeki elektron sayısı 26’dır. Bu durumda atomun atom numarası 26’dır.
Geçiş metallerinin tüm gruplarında dış orbitallerdeki elektron
dağılımları aynı değildir. B gruplarında aynı periyotta bir elementten diğer elemente geçişte elektron dağılımları düzenli bir değişim göstermez. Bunun nedeni bu gruplardaki elementlerin elektron dağılımlarında tam dolu olmayan d alt kabukları içermeleridir.
60
1. ÜNİTE: MODERN ATOM TEORİSİ
f bloğu elementleri ise periyot boyunca benzer özellik gösteren lantanit ve aktinit serisini oluşturur. Şekil 1.28’de periyodik
çizelgedeki elementlerin blokları verilmiştir.
s – bloğu
1
1s
p – bloğu
2
d – bloğu
2s
3s
13
3
4
5
6
7
8
14
15
16
18
17
1s
2p
9
10
11
3p
12
4s
3d
4p
5s
4d
5p
6s
5d
6p
7s
6d
7p
f – bloğu
4f
5f
Şekil 1.28: Periyodik çizelgede elementlerin blokları
Etkinlik: Elektron Dizilimi ve Periyodik Sisteme Yerleşim ile İlgili Öğrendiklerimizi
Kontrol Edelim
Aşağıdaki cümlelerde bırakılan boşlukları kutucuklarda verilen uygun kelime ve kavramlarla eşleştiriniz.
1.
....................... soy gazların 1s2 elektron dağılımına
sahip ilk üyesidir.
1A ve 2A grubu elementlerinin elektron dağılım-
2.
3.
ları s alt kabuğu ile sonlandığı için ....................... elementleri olarak sınıflandırılır.
f bloğu elementleri ....................... ve aktinit serisinden oluşur.
Periyodik çizelgede benzer kimyasal özellik gös-
4.
teren elementlerin yerleştiği sütunlara .......................
denir.
a.
lantanit
b.
grup
c.
helyum
ç.
periyot
d.
s bloğu
Alıştırma
1. 2. periyot 6A grubunda bulunan elementin elektron dizilimini yazarak atom numarasını belirleyiniz.
2. 34Se elementinin elektron dağılımını yazarak periyodik cetveldeki yerini belirleyiniz.
61