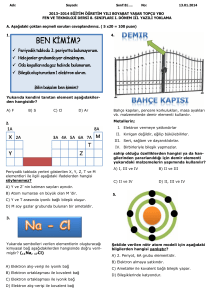
MADDE NEDİR?
Çevremize baktığımızda gördüğümüz her şey
örneğin, dağlar, denizler, ağaçlar, bitkiler,
hayvanlar ve hava birer maddedir.
Her maddenin bir kütlesi vardır ve bu
tartılarak bulunur. Ayrıca her madde uzayda belli
bir yer kaplar. Bu yüzden uzayda yer kaplayan her
şeye madde denir diye bir tanım da yapılabilir.
2
ARI MADDE
Belirli karakteristik özellikleri olan tek tür tanecik
içeren maddelere arı madde denir.
Tüm arı maddeler homojendir.
Arı maddeler;
• Elementler
• Bileşikler
Arı olmayan maddeler ise karışımlardır.
Element sembollerle, bileşikler kimyasal formüllerle
gösterilirken,
karışımlar
herhangi
bir
şeyle
gösterilmezler.
3
ELEMENTLER
Aynı cins atomlardan oluşan arı maddelere element denir.
Özellikleri;
1. Elementler en basit arı maddelerdir.
2. Fiziksel ve kimyasal yöntemlerle daha basit maddelere
ayrılamazlar.
3. Tek cins atomlardan oluşurlar.
4. Sembollerle gösterilirler.
– Farklı elementler belli oranlarda
birleşerek bileşikleri oluştururlar.
– Elementler özelliklerine göre 2’ye
ayrılırlar.
1. Metaller
2. Ametaller
4
Moleküller…
Aynı elementler ise birleşerek molekülleri oluştururlar.
O2, Fe2 gibi
Farklı türde atomlar da birleşerek molekülleri ve bileşikleri
oluşturur.
Maddelerin bir kısmı atomik yapıda bir kısmı moleküllü
yapıda bulunur.
5
Atomik ve Moleküler
yapıdakiler…
6
Bazı elementlerin
kullanım alanları
•
•
•
•
•
•
•
•
•
•
•
•
Demir, inşaat malzemelerinde
Cıva, termometrelerde
Bakır ve alüminyum mutfak eşyalarında
Kükürt bitkiler için mikrop öldürücü
Klor su dezenfektanında
Çinko ve lityum pil yapımında
Hidrojen roket yakıtında
Magnezyum uçak kanadı yapımında
Neon ve argon ampul lamba yapımında
Helyum zeplin ve uçan balonlarda
Potasyum sıvı deterjan, gübre ve barut yapımında
Fosfor suni gübre yapımında
7
Element Görevleri (Etkinlik)
A
E
D
F
C
L
G
K
8
ATOMUN YAPISI
Tüm maddeler tanecikli yapıda
olup bu taneciklere atom denir.
Atom parçalanamayan en küçük
yapıdır. Atom gözle görülemeyecek
kadar küçüktür.
Ayrıca, atomun yapısında (+)
proton, (-) elektron ve (0) nötron
bulunur.
Atom ve yapısıyla ilgili farklı
modeller
ve
görüşler
ileri
sürülmüştür.
9
10
Atom Modelleri
Atom ve Yapısındakiler
Katyon (+)
Anyon (-)
11
Atom Çeşitleri – 1 (İzotop)
İzotop atom
– Proton sayıları eşit, nötron sayıları farklı olan
atomlara denir.
• Bu tür atomların;
–Kimyasal özellikleri aynı, fiziksel özellikleri
farklıdır. Çünkü, kimyasal özellik proton ve
elektron sayısına bağlıdır.
Atom Çeşitleri – 2 (İzoton)
İzoton Atom
– Nötron sayısı aynı, proton sayısı farklı olan
atomlara denir.
• Bu tür atomlarda;
–Proton sayısı farklı olduğundan kimyasal
özellikler farklı olur.
Atom Çeşitleri – 3 (İzobar)
İzobar Atom
– Kütle numaraları aynı, proton sayıları farklı olan
atomlardır.
• Yani,?
• Örneğin,
atomu ile
atomu izobar
atomlardır.
Atom Çeşitleri – 4 (İzoelektronik)
İzoelektronik Atom
– Elektron sayısı yada elektron dağılımı aynı olan
atomlara denir.
iyonlarının elektron sayısı 18
olduğundan izoelektroniktirler.
Allotrop Madde
Allotrop Madde
– Bir elementin aynı cins atomlarının farklı
madde, kristal veya molekül şekillerinin her
birine o elementin allotropu denir.
O2 - O3 gibi
Örnek Soru – 1
Örnek Soru – 2
Örnek Soru – 3
ELEKTRON DİZİLİMİ
VE KİMYASAL ÖZELLİKLER
Elementlerin atomlarında bulunan elektronlar
yerlerinde sabit değillerdir. Hareketli olan bu
elektronların takip ettiği yola yörünge denir. Yörüngeler
aşağıdaki gibi elektron alabilirler.
20
Elektron Alışverişi
Elementler (-) elektron vererek elektron sayılarını azaltırlar ve (+)
yüklenmiş olurlar. Bunlara katyon denir.
Elementler (-) elektron alarak elektron sayılarını artırırlar ve (-)
yüklenmiş olurlar. Bunlara anyon denir.
21
Elementlerin Sınıflandırılması
ve Kararlı Olmak İstemeleri
Elementler aralarında sadece elektron (-) alışverişi
yapabilirler. Nötron ve proton (+) alışverişi kesinlikle yoktur.
Elementler elektron alışverişi kararlı hale gelmek için
yani son yörüngelerindeki elektron sayısını tamamlayıp
soygaza benzemek için yaparlar.
Ayrıca elementleri son yörüngelerindeki elektron
sayısına göre sınıflarız. Bu sınıflama, eğer son yörüngede
• 1,2 ve 3 elektron varsa (H ve He hariç(?)) metal,
• 4,5,6 ve 7 elektron varsa ametal
şeklindedir.
Soygazlar tek atomludurlar, kararlıdırlar ve hiç
kimse ile bağ yapmazlar. Bağlar …
22
KİMYASAL BAĞLAR
• Atomlar arası çekim kuvvetlerine kimyasal bağ denir.
• Kimyasal bağlar 2 çeşittir:
– İyonik bağ
– Kovalent bağ
• Atomlar elektron alarak vererek veya ortak elektron
kullanarak bağ yaparlar.
• Atomların elektron alıp ya da verip son yörüngelerindeki
elektron sayısını 8’e tamamlamalarına oktet kuralı denir.
• 2He ise son yörüngesini 2’ye tamamlar bu da dublet
kuralıdır.
23
İyonik Bağ
• Metaller ile ametaller arasında
oluşur.
• Metal
değerlik
elektronlarının
tümünü verip (+) iyon olurken,
ametal son yörüngesindeki elektron
sayısını 8’e tamamlar ve (–) iyon
haline geçer.
• Sonuçta iki elementte soygaz
kararlılığına ulaşır.
NOT : Elektron alma gücü en yüksek,
elektron verme gücü en yüksek
elementler arasında en güçlü iyonik
bağ oluşur.
24
İyonik Bağ (Animasyon)
25
Kovalent Bağ
• Ametaller arasında olan bağ kovalent
bağdır.
• Ametallerin elektron çiftlerini ortaklaşa
kullanması ile oluşur.
• Kovalent bağda ortalaşa kullanılan
elektronlar her iki atom çekirdeği
tarafından çekilir bu sayede bağ oluşmuş
olur.
• İki tip kovalent bağ vardır:
– Apolar kovalent : İki ametal de aynı
ise bu bağ oluşur. H2, N2 gibi…
– Polar kovalent : İki ametal aynı değil
farklı ise bu bağ oluşur. H2O, CH4 gibi
26
Kimyasal Bağlar (Etkinlik)
D
E
A
B
K
F
G
27
Kimyasal Bağlar (Etkinlik-2)
X
X
X
X
X
X
X
X
X
X
28
BİLEŞİKLER
İki veya daha fazla cins elementin kendi özelliklerini
kaybederek belirli oranda birleşmesi ile oluşan saf
maddelere bileşik denir. Özellikleri…
29
Bileşiklerin Özellikleri
1.Her bileşiğin kendine özgü özellikleri vardır.
2.Her bileşik formülle gösterilir.
3.Kimyasal yollarla elementlerine ayrıştırılabilir.
4.Bileşiklerde elementlerin belli bir oranı vardır.
5.Elementler bileşik oluşturdukların da kendi
özelliklerini kaybederler.
30
KARIŞIMLAR
İki veya daha fazla maddenin kendi
özelliklerini kaybetmeden bir araya gelmesiyle
karışımlar oluşur. Toprak, hava gibi… Özellikleri;
1. İç yapıları değişmez.
2. Has özellikleri yoktur.
3. Homojen yada heterojen
olurlar.
4. Fiziksel yollarla ayrılırlar.
5. Belli oranlarla oluşmazlar.
31
ÇÖZELTİLER
• Homojen tüm karışımlar
çözelti olarak adlandırılır.
• Bir madde bir çözücünün
içinde en küçük taneciklere
kadar parçalanır ve her yere
eşit dağılırsa bu olaya
çözünme denir.
• Çözeltiler 2’ye ayrılır…
32
Çözelti Çeşitleri
• Çözeltiler 2’ye ayrılır.
• Derişik çözeltiler
• Seyreltik çözeltiler
– Derişik Çözelti: Çözeltide çözünen madde çok ise
derişiktir.
– Seyreltik Çözelti: Çözeltide çözücü madde çok ise
bu çözeltide seyreltiktir.
NOT: İyonlaşan maddeler suda çözündüğünde çözelti
elektriği iletir. Bu maddelere de elektrolit denir.
33
Çözünme Hızı
Çözelti oluşturulurken aşağıdaki
çözünme olayı daha hızlı gerçekleşir.
işlemler
yapılırsa
– Sıcaklık artırılırsa,
– Çözünen madde küçük parçalara ayrılırsa,
– Çözelti kaşık vb. aletle karıştırılırsa.
Örnek olarak şunları düşünelim:
1. Çayımız soğuk olduğunda mı yoksa sıcak olduğunda mı şeker içinde
rahat eriyor?
2. Çayımıza küp şeker atınca mı yoksa toz şeker atınca mı daha rahat
çözünme oluyor?
3. Çayımızı karıştırınca mı yoksa bekleyince mı çözünme süresi kısa
oluyor?
34
Ünitenin Kavram Haritası
35