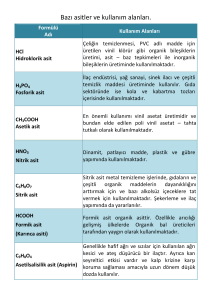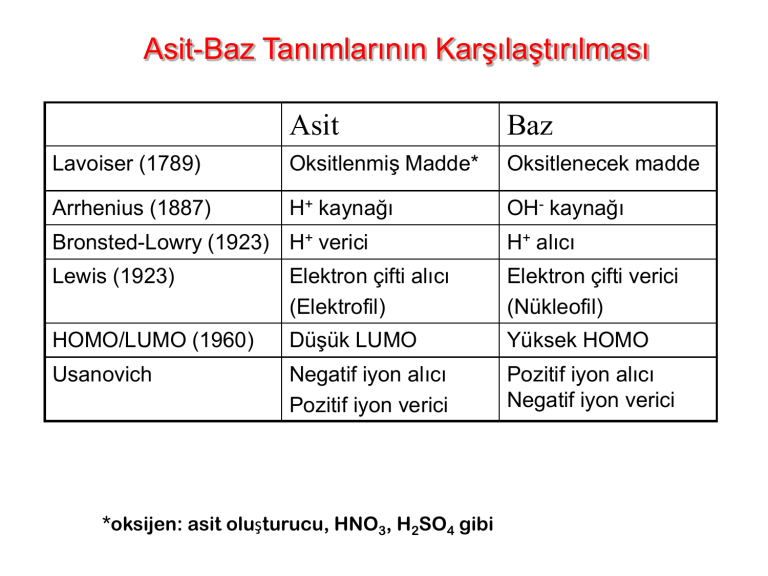
Asit-Baz Tanımlarının Karşılaştırılması
Asit
Baz
Lavoiser (1789)
Oksitlenmiş Madde*
Oksitlenecek madde
Arrhenius (1887)
H+ kaynağı
OH- kaynağı
Bronsted-Lowry (1923) H+ verici
H+ alıcı
Lewis (1923)
Elektron çifti alıcı
(Elektrofil)
Elektron çifti verici
(Nükleofil)
HOMO/LUMO (1960)
Düşük LUMO
Yüksek HOMO
Usanovich
Negatif iyon alıcı
Pozitif iyon verici
Pozitif iyon alıcı
Negatif iyon verici
*oksijen: asit oluşturucu, HNO3, H2SO4 gibi
Arrhenius Tanımı
Suya H3O+ (hidronyum) katyonu veren maddeler ASİT
Suya OH- (hidroksit) anyonu veren maddeler BAZ
HNO3 + H2O NO3– + H3O+
asit + baz = tuz + su
ASİT
HCl, HNO3
BAZ
KOH, NaOH
Bronsted-Lowry Tanımı
asit
HA
baz
+
-H+
B-
eşlenik
baz
A-
eşlenik
asit
+ BH
Proton veren maddeler ASİT
Proton alan maddeler BAZ
+H+
Eşlenik Asit = Baz + Proton
Eşlenik Baz = Asit - Proton
ACID
CONJ. BASE
stronger
HClO4
_
ClO 4
O
O
CH3 C
CH3 C
OH
ACID
STRENGTH
weaker
pKa
10
10
-10
10
O
OH
Ka
C H 3C H 2 O
-
10
_
CH3 CH3
weaker
5
BASE
STRENGTH
O
10
C H 3 C H 2 O-H
-5
CH3 CH2
stronger
Kuvvetli asitlerin eşlenik bazları zayıftır.
Zayıf asitlerin eşlenik bazları kuvvetlidir.
Ka > 1 (negatif pKa), kuvvetli asit
Ka < 1 (pozitif pKa), zayıf asit
-10
-16
-50
10
10
16
50
Asit Baz Tepkime Öngörüsü
CH3CO2H
Gof (kJ/ mol)*
CH3CO2
HO
Asit
Baz
-389.9
-419.2
G
n p G of (p )
product
pKa
+
4.76
Kuvvetli Asit
Aktif
Yüksek E
+
OH2
Eşlenik
Eşlenik
Baz
-607.2
Asit
-237.1
n r G of (r ) 35.2 kJ / mol
reac tan t
15.74
Zayıf Asit
Kararlı
Düşük E
Tepkimeler daha zayıf asit-baz çifti verecek şekilde ilerler.
Çözücü Sistemi Tanımı
Aprotik çözücülerde ve susuz ortamlarda çok kullanılan tanımdır.
Öziyonlaşma gösteren bütün çözücülere uygulanabilir.
Çözücünün katyon derişimini arttıranlar ASİT
Çözücünün anyon derişimini arttıranlar BAZ
Çözücü su ise : 2 H2O
H3O+ + OH- (öziyonlaşma)
ASİT HCl + H2O
H3O+ + ClBAZ NH3 + H2O
NH4+ + OHÇözücü BrF3 ise : 2 BrF3
BrF2+ + BrF4- (öziyonlaşma)
ASİT SbF5 + BrF3
BrF2+ + SbF6BAZ F- + BrF3
BrF4asit + baz = çözücü (iyonlaşmanın tersi)
2 Cl3PO Cl2PO+ + Cl4PO2 SO2 SO+ + SO32-
pKiyon = -log[asit][baz]
– pKW = -log[H3O+][OH-] = -log[10-7][10-7] = 14
– pKH2SO4 = -log[H3SO4+][HSO4-] = 3.4
– Sayı küçüldükçe, ayrışma artar
Düzeyleme Etkisi ( Leveling Effect )
Bir çözücüdeki en kuvvetli asit çözücünün katyonu,
“
“
“
baz
“ anyonudur.
HNO3, H2SO4, HClO4, HCl sulu ortamda asitlikleri aynıdır (H3O+)
Düzeyleme
etkisi
H2SO4 + H2O H3O+ + HSO4- (100% ayrışır) KA
HNO3 + H2O H3O+ + NO3HOAc + H2O
H 3 O+ +
OAC-
(100% ayrışır) KA
(Ka = 1.8x10-5) ZA
Kuvvetli asitleri farklandırmak için daha asidik çözücü (HOAc) kullanılır.
HClO4 > HCl > H2SO4 > HNO3 (HOAc içinde)
H2SO4 + HOAc H2OAc+ + HSO4HNO3 + HOAc H2
OAc+
+ NO3
-
Ka
K’a
2H2SO4 + HNO3 NO2+ + H3O+ + 2HSO4-
Ka > K’a
Farklandırma
etkisi
Çözücü Düzeylemesi
(Solvent Leveling)
pKDMSO =37
geniş bir skalada asitleri farklandırabilir.
H2SO4 den PH3’e kadar
Öziyonlaşması büyük çözücüler, geniş bir aralıkta asit ve bazları farklandırabilir.
NH3 + HOAc NH4+ + OAc- (%100 iyonlaşır)
H2O + HOAc H3O+ + OAc- Ka = 1.8x10-5
HOAc suda zayıf, amonyak çözeltisinde kuvvetli asittir.
Lewis Tanımı
ASİT
electron-çifti alıcı (acceptor)
nükleofil
BAZ
elektron-çifti verici (donor)
elektrofil
F
F
H
B + N
F
ASİT
H
H
BAZ
F
F
H
B
N
F
H
H
Katılma Bileşiği (adduct)
ASİT : Düşük enerjili LUMO
BAZ : Yüksek enerjili HOMO
Lewis Asitleri
Bütün katyonlar
[Fe(CN)6]3-
-
3+
Fe + 6 CN
Oktet boştuğu olan bileşikler
Al
3+
[AlF 6]
+ 6F
Hipervalent oluşturabilen bileşikler
SnCl 4 + 2Cl
3-
-
-
[SnCl6]2-
Çokkatlı bağlara sahip bileşikler
-
CO2 + OH
HCO3
Lewis Bazları
Bütün anyonlar
OH-, F-, S-2….
H+ + OH-
H2O
Yalın çifte sahip bütün nötral bileşiker
Cu2+ + 4H2O
Çokkatlı bağlara sahip bileşikler:
Ag+ + C2H4
H2O, ROH, ROR …
[Cu(H2O)4]2+
benzen, asetilen, etilen ….
[Ag(C2H4)]+
Lewis Asit- Baz Tepkimesi
AlCl3 , BeCl2 hem Lewis asidi hem de Lewis bazı olarak davranabilir.
Cl
Cl
Cl
Cl
Cl
Al
Al
Cl
Cl
Al
-
Cl
+
Cl
Cl
Be
Cl
Be
Be
Cl
Al
+
-
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
+
-
Be
+
2-
Be
Cl
+
-
Be
Cl
+
Cl
Lux-Flood Asit Baz Tanımı
Oksit anyonu alan bileşikler ASİT
Oksit anyonu veren bileşikler BAZ
CaO + SiO2 CaSiO3
PbO + SO3 PbSO4
TiO2 + Na2S2O7 Na2SO4 + TiOSO4
Usanowich Asit-Baz Tanımı
Katyon veren bileşikler ASİT
Anyon alan bileşikler BAZ
Büyün kimyasal tepkimeler asit-baz tepkimesi olarak kabul edilir.
ÖRNEK: Aşağıdaki tepkimelerde asit ve bazları belirleyiniz.
A
A
A
A-B
B
B
A-B
A-B
B
A-B
A
B
ÖRNEK: Aşağıdaki tepkime mümkün mü?
H
H
C
O
C
O
H
+
H
C
O
H
H
pKa
H
H
O
H
C
C
O
+
H
H
C
O
H
H
H
4.76
15.54
ÖRNEK: Aşağıdaki tepkimeler için hangi asit-baz tanımı kullanılır?
+
H
+
+
H
+
+
Ag
+
.. :.OH
.
:NH3
:NH3
A, BL, L
BL, L
L