GLİKOLİZ VE HESOZLARIN
YIKIMI
YRD. DOÇ. DR. HAYRULLAH YAZAR
SAKARYA ÜNIVERSITESI TıP FAKÜLTESI
TıBBI BIYOKIMYA ANABILIM DALı
SAKARYA, 2015
1
Glukoz, enerji gereksinimi aniden artığı zaman,
çabucak hücre içi depo polimerlerinden açığa
çıkar, ya aerobik yada anaerobik olarak ATP
üretiminde kullanılır.
Escherichia coli gibi bir bakteri glukozdan her
amino asidin, nükleotidin, koenzimin, yağ
asidinin, gelişimi için gerekli diğer metabolik
arabileşiklerin karbon iskeletlerini sağlayabilir.
2
Glukozun metabolik yazgısı ile ilgili kapsamlı
bir çalışma yüzlerce veya binlerce dönüşümü
içerebilir. Yüksek bitki, hayvan ve insanlarda
glukoz üç temel sona sahiptir: depo edilebilir
(polisakkarit veya sukroz olarak), glikoliz
yoluyla üç karbonlu bileşiklere oksitlenebilir
(pirüvat), veya pentoz fosfat (fosfoglukonat)
yoluyla pentozlara oksitlenebilir (Şekil 15-1).
3
Şekil 15.1. Yüksek bitki, insan ve hayvan
hücrelerinde glukoz kullanımının temel yolları.
Glukoz için tek olası son olmamasına karşın, bu üç
yol pek çok hücrede akan glukozun miktarı
bakımından en önemlileridir.
4
Glikoliz
Glikoliz (Yunanca bir kelime olan glykys,
«tatlı» anlamında ve lysis “parçalanma”
anlamındadır)’de bir molekül glukoz enzimlerle
katalizlenen bir seri tepkimeyle iki molekül üçkarbonlu bir bileşik olan pirüvata yıkılır.
Glikolizin birbirini izleyen tepkimeleri sırasında,
glukozdan açığa çıkan serbest enerjinin bir
kısmı ATP ve NADH şeklinde saklanır. Glikoliz
aydınlatılan ilk metabolik yoldur ve belki de en
iyi anlaşılan yoldur.
5
Bir başka anlatımla glikoliz, glukozun EmbdenMeyerhoff yolu ile piruvat ve laktata
oksidasyonudur. Glikoliz ile ATP üretilir.
Aerobik organizmalarda glikoliz, sitrik asit
siklusu ile elektron transport zincirinin (ETZ)
öncül reaksiyonları dizisidir. Glukozdaki
enerjinin çoğunluğunu sitrik asit döngüsü ile
ETZ ortaya çıkarır. Aerobik koşullarda piruvat
mitokondriye geçerek tam olarak CO2 ve
H2O’ya okside olur.
Embdn Meyerhoff; Alman Biyokimyacı, 1919’da glikolizi tanımlamış
6
Aktif olarak kasılan kaslarda olduğu gibi O2
kaynağı yeterli değilse piruvat, laktada dönüşür.
Bazı anaerobik organizmalarda (Maya gibi)
piruvat, etanola çevrilir.
Glukozdan laktat ve etanol oluşumu
fermentasyon örnekleridir.
Fermentasyon; ATP olarak saklanan enerjiyi elde etmek üzere glukozun veya diğer organik besinlerin
anaerobik yıkımı için kullanılan genel bir terimdir.
7
Fermentasyon ve solunum:
Heterotrop canlılar enerjilerinin çoğunluğunu,
elektronları indirgeyici ajandan, bir e akseptörü
veya yükseltgeyici ajana transfer edildiği
oksidasyonredüksiyon reaksiyonlarından elde
ederler.
8
Tabii ki O2 olduğu zaman, aerobik organizmalar
enerjilerinin çoğunu, moleküler O2 ile organik
yakıtların oksidasyonu olarak tanımlanan
solunum ile elde etmektedirler. Solunumda, O2
son e akseptörü (alıcısı) olarak davranır.
9
Anaerobik yaşayabilen organizmalar iki
sınıfa ayrılırlar.
1. Zorunlu anaerob
2. Fakültatif anaerob
1. Zorunlu anaeroblar O2 kullanamazlar.
Bunlar deniz çamurunda yaşayan bakterilerdir.
Topraktaki, nitratı nitrojene indirgemekten
sorumlu bakteriler de anaerob’tur. Bunların
bazıları insanlar için patojeniktir. Clostridium
Perfiringes, gazlı gangrene neden olan bu
bakterilerden biridir. Clostridium botilinum da
öldürücü bir besin zehirlenmesine yol açabilen
diğer bir bakteridir.
10
2. Fakültatif (mecburi olmayan) anaeroblar
O2’in varlığında da yokluğunda da yaşayabilirler.
Anaerobik yaşadıkları sırada, sıcaklıkla enerji
kaynaklarını anaerobik yollarla temin ederler ve
sonra oluşan ürünleri moleküler O2 harcayarak
okside ederler.
Glukoz fermentasyononun iki önemli tipi
vardır:
1. Hemolaktik fermentasyon: 6 karbonlu glukoz
molekülü, 2 adet 3 karbonlu laktik aside yıkılır.
Laktik asit burada son üründür. Glukozun bu
şekilde yıkılımı bir çok mikroorganizma ile daha
yüksek bir çok hayvan, insan ve bitki hücrelerinde
de gerçekleşir.
11
İnsanda laktik fermentasyon özellikle iskelet
kasında oluşur.
Hemolaktik fermentasyon
Glukoz + 2ADP + 2Pi
2 Laktik asit + 2ATP +
2H2O
12
2. Alkolik fermentasyon: Bir çok mayanın
karakteristik özelliğidir. Glukoz molekülü, 2 adet
karbonlu etanol ve 2 molekül CO2’e yıkılır.
13
Piruvat, alkolik
fermentasyondan önce
piruvat dekarboksilaz
ile asetaldehide
dönüşür. 2. Basamakta
asetaldehid alkol
dehidrogenaz ile
etanola çevrilir.
14
Bir başka yol daha vardır: Bu yolda piruvat,
mitokondriye girerek TCA döngüsüne katılır ve
CO2 + H2O oluşur. Bu yol, ortamda O2 mevcut
ise gerçekleşir ve hücresel solunum adını alır.
Respirasyon oksidatif bir yıkılım ve besinsel
moleküllerden O2 ile reaksiyon sonucu enerji
elde edilmesidir. Piruvat, mitokondride lokalize
piruvat dehidrojenaz enzim kompleksi ile
asetil CoA’ya okside olur ve böylece sitrik asit
döngüsüne (TCA) girer.
15
Bütün dokularda meydana gelen glikoliz
metabolik yolunda hem TCA döngüsü için
asetil-CoA üretilir, hem de galaktoz ve fruktoz
gibi diğer heksozlar metabolize edilip ATP
üretilir.
Eritrositler enerjilerinin % 90’ını glikolizle
sağlarlar. Bunun yanında iskelet kası, beyin,
GİS hücreleri, renal medulla, retina ve deri
enerjilerinin çoğunu glikoliz yoluyla elde ederek
laktat üretirler.
Bu yol ve ilgili tüm enzimler sitozol’dedir.
16
Glikoliz enzimlerinin eksikliği durumunda ATP
üretimi düşer, eritrosit membranındaki
Na+/K+ ATPaz pompası yavaşlar ve hemolitik
anemi görülür (%95’i pirüvat kinaz, %4’ü
glukoz 6-fosfat izomeraz eksikliğidir): Kanser
dokusunda, hücrelerde glikoliz artmış
olduğundan piruvat, buna bağlı olarak laktat
artacağından, tümör dokusu civarı asidik hal
alır.
17
Glikolizde 6 karbonlu glukozdan, hazırlık
safhasında 2 ATP harcanarak 2 molekül piruvat
elde edilirken 4 ATP sentezlenmiş olur.
Anaerobik şartlarda piruvat, asetil-CoA yoluna
gidemez, laktata kayar. Böylece NAD+ rejenere
edilerek glikolizin devamı sağlanır. Aerobik
şartlarda ise oluşan piruvat asetil-CoA halinde
TCA döngüsüne hazır hale getirilirken
piruvattan önce oluşan NADH+H+ hidrojenleri
malat-aspartat mekiği ile mitokondriye
gönderilir, buradan 2,5 ATP elde edilir.
18
Glikoliz Aşamaları:
Hücrenin sitozolünde gerçekleşen enzimatik
reaksiyonlar, 2 ayrı aşamada incelenir:
1. Glukozun, 2 mol D-gliseraldehit 3-P
oluşturduğu, 5 basamaklı reaksiyonlar dizisi ile,
2 mol ATP harcanır.
2. Glukozdan türemiş olan 3 C’lu birimler, yine
5 basamaklı reaksiyonlar dizisi ile, piruvata
çevrilir. Bu arada da, 4 mol ATP üretilir.
19
Yani, 1 mol glukozun aerobik glikoliz’de 2 mol
piruvata çevrilmesi ile; net 2 mol ATP kazanılır.
Ayrıca, oluşan NADH solunum zincirine girerse,
ondan da ATP kazanılır. Ancak, mitokondriye
taşınma biçimine göre, kazanılan ATP sayısı
değişir.
20
Glikoliz Reaksiyonları:
1. Glukozun, glukoz 6-fosfata dönüşümü:
İlk basamakta ATP’den bir fosforil grubu,
glukoza aktarılır ve glukoz-6-P oluşur. Yani 1
ATP harcanmış olur. Oluşan bağ bir ester
bağıdır. Glukozun fosforilasyonu ile oluşan
bileşik, hücre dışına çıkamaz, çünkü hücre
membranını geçmesi için spesifik taşıyıcısı
yoktur.
21
Bu da glukozun hücre içinde metabolize
olmasını sağlar. Bu basamak irrevesibl bir
reaksiyondur Ayrıca, fosfatlanmış glukoza
enzimlerin etki etmesi kolaylaşır.
Fosforilasyon 2 farklı enzimle gerçekleşir:
Heksokinaz, yaygın bir dağılıma sahiptir ve
çoğu hücrede bu fonksiyonu gören enzimdir.
Sadece glukozun değil aynı zamanda, fruktoz,
mannoz hatta glukozaminin de
fosforilasyonunu katalizleyen, bu şekilde
bunların da glikoliz yolunda kullanılmasını
sağlayan bir enzimdir.
22
Glukokinaz (karaciğer ve pankreasın β
hücrelerinde bulunur) tarafından katalizlenir.
Heksokinaz ve glukokinaz’ın özelliklerinin
karşılaştırılması Tablo 1’de gösterilmiştir.
23
Tablo 1. Heksokinaz ve glukokinaz’ın özelliklerinin
karşılaştırılması
Heksokinaz
Glukokinaz
Pekçok dokuda vardır.
Karaciğer ve pankreas βhücrelerinde bulunur.
Km’i düşüktür, ilgisi
yüksektir.
Km’i yüksektir, ilgisi düşüktür.
Vmax’ı düşüktür.
Vmax’ı yüksektir.
Glukoz-6-P ile inhibe olur Glukoz-6-P ile inhibe olmaz
İnsulinden etkilenmez
İnsulin ile aktivitesi arttırılır
Başka şekerlere de
etkilidir.
Başka şekerlere etkili değildir.
24
Heksokinaz, ortamda çok düşük
konsantrasyonda glukoz varsa bile onu
fosfatlıyor (2 mg/dL düzeylerde)
Glukokinaz ise, 200 mg/dL düzeylerinde etkili,
yani ilgisi çok düşük. İnsülin ile
indüklenebilmesiyle, toklukta kan şekeri artışını
kısa sürede geri çekebiliyor.
25
Hayvan dokularındaki hekzokinaz regülatör bir
enzimdir. Hekzokinaz, ürünü olan glukoz-6fosfat ile inhibe edilir. Bu tür inhibisyona feedbach inhibisyonu denir. Fakat glukokinaz, son
ürünle inhibe edilemez. Glukokinaz sadece
glukozu fosforiller ve diğer heksozlar üzerine
etki etmez. Glukokinaz, hekzokinazdan daha
yüksek bir KM’e değerine sahiptir. Glukokinazın
KM değeri 10 mM iken hekzokinazın ki 0,1
mM’dır (Şekil 1).
26
Embden-Meyerhoff
Şekil 1. Hekzokinaz ve
glukokinaz ile katalize
edilen fosforilasyon
hızına glukoz
konsantrasyonunun
etkisi.
27
Heksokinaz eksikliği: Kalıtsal eritrosit
defektidir. Glukoz-6P yeterince oluşturulamaz
ve buna bağlı olarak, diğer glikolitik ara
ürünlerin konsantrasyonu da düşer. Bu ara
ürünlerden birisi de 1,3Bifosfogliserat’tır.
1,3Bifosfogliserat, Hemoglobinin oksijene
ilgisini azaltan 2,3Bifosfogliseratın öncüsüdür.
Heksokinaz eksikliği ile, hemoglobin’in oksijene
ilgisi artar ve dokulara oksijen bırakımı bozulur.
28
Glukokinazın rolü glikojen veya yağ asitleri
şeklinde enerji depolamak için subsrat
oluşturmaktır. Her iki enzimde etki göstermek
için 2 değerlikli katyona, Mg+2 veya Mn+2’a
ihtiyaç gösterir. Glukoz-6-fosfat, sadece
glikolitik yolun ara kademesi olmayıp, bir çok
anabolik ve katabolik yolda prekürsör rolü
görür.
29
2. Glukoz-6-fosfatın, fruktoz-6-fosfata
dönüşümü: Glukoz-6-fosfatın, fruktoz-6fosfata izomerizasyonudur. Aldehid grubu keto
grubuna değişir, aldoz şeker ketoz şekere
dönüşür. Bunu sağlayan enzim (Glukoz 6fosfat izomeraz= fosfoheksoz izomeraz’dır.
Reversibl bir reaksiyondur.
30
3. Fruktoz-6-fosfatın, fruktoz-1,6-bifosfata
dönüşümü: Bu basamakta 2. ATP harcanan
basamaktır. İrreversibl bir reaksiyondur ve
kataliz eden enzim Fosfofruktokinaz-1 (PFK1)’dir. Bu fosforilasyon reaksiyonunda froktoz6-fosfat 1 ATP ile fosforillenerek fruktoz 1,6bifosfat’a dönüşür.
31
Fosfofruktokinaz 1 (PFK 1) tarafından
katalizlenen bu reaksiyon glikoliz için Hız
kısıtlayıcı basamak’tır. Fosfofruktokinaz-1
hücrenin enerji durumuna akut olarak cevap
veren, allosterik bir enzimdir.
Allosterik enzimler feed-bach inhibisyon
gösterirler. Bu, son ürünün reaksiyon dizisi
başlangıcındaki enzim üzerinde inhibitör bir etki
gösterdiği anlamına gelir.
32
Fruktoz-6-fosfat’ın fosforilasyonu, glikolizdeki
en önemli kontrol basamağıdır.
Fosfofruktokinaz-1; yüksek konsantrasyondaki
ATP, sitrat, uzun zincirli yağ asitleri ile inhibe
edilir. ADP, AMP ve Fruktoz-2,6-bifosfat ise
fosfofruktokinaz-1’i aktive ederler.
Bu nedenle ATP/ADP oranı önem taşımaktadır.
ATP/ADP oranı düştüğünde enzimin
aktivitesinin önemi artmaktadır (Şekil 2).
33
Ya da bu oran yükseldiği zaman, ATP düzeyi
yüksek ise enzim aktivitesi düşer,
Fosfofruktokinaz-1 reaksiyonu irrevesibl’dir ve
glikolizdeki 2. en önemli hız kısıtlayıcı
basamaktır. PFK-1 in ATP tarafından
inhibisyonu lojistik değer taşır. Yüksek hücresel
ATP değerleri enerji depolarının doygunluğunu
gösterir. Glikolizin yavaşlamasına neden olur.
PFK-1’in hız kısıtlayıcı özelliği böylece
sağlanmış olur. Fosfofruktokinaz-2 (PFK-2),
PFK-1’in aktivatörü olan Fruktoz 2,6-bifosfatı
sentezleyen regülatör bir enzimdir.
34
Bu enzim (PFK-2), cAMP’a bağımlı (cAMPbağımlı) protein kinaz tarafından fosforlanarak’
ta inhibe edilir.
Fruktoz 2,6-bifosfataz (F-2,6-BPaz), PFK-1’in
ürünü olan Fruktoz-1,6-bifosfat ile aktive olur
(Şekil 3).
35
Şekil 2. PFK-1 ve PFK-2 reaksiyonları
36
4. Fruktoz 1,6-bifosfatın, dihidroksi aseton
fosfat ve gliseraldehid 3-fosfata dönüşümü:
Glikolizin ilk bölümü (heksozun trioz fosfata
dönüşümü) tamamlanır. Bu reversibil basamağı
aldolaz katalizler. Aldolazlar, liyazlar (C-C, C-O
ve C-N arasındaki bağları hidrolizden ve
oksidasyondan farklı bir yolla kırarlar veya bu
atomlar arasına bir çift bağ ilave ederler.
37
Olayın kimyasal mahiyeti bir aldol
kondansasyonu olarak tarif edilmektedir. Eğer
ortama bazik bir çözelti ilave edilecek olursa,
bu kondansasyon nonenzimatîk olarak da
oluşacaktır. Enzimin yaptığı iş, aslında
kendiliğinden oluşacak bu reaksiyonu
çabuklaştırmaktan ibarettir. Aldolaz Zn+
gerektiren bir enzimdir.
38
İzole edilmiş iki tip aldolaz bulunur. Aldolaz A
ve Aldolaz B’dir Aldolaz A iskelet kasında izole
edilmiş, 160.000 Dalton molekül ağırlığında ve
4 sübiniteden oluşmuştur. Aynı zamanda belirli
sayıda -SH grubu taşımaktadır. Bunların bir
kısmı enzimin katalitik aktivitesi için gereklidir.
Aldolaz B, bakteri, maya ve mantarlarında ve
fruktoz metabolizmasında bulunmuştur.
Karakteristikleri bakımından Aldolaz A’dan
farklılıklar taşır.
39
40
5. Dihidroksi aseton fosfatın, Gliseraldehid
3-fosfata dönüşümü: Gliseraldehid 3- fosfat
glikoliz yolu üzerindedir ama DHAP değildir.
DHAP reversibl bir reaksiyonla GAL 3-P’a
çevrilir. DHAP ile GAL 3-P birbirinin izomeridir.
Bu izomerlerin birbirine dönüşümünü
katalizleyen enzim ise Trioz fosfat
izomeraz’dır.
41
Bu reaksiyon glikolitik yoldaki beşinci
reaksiyondur. Enerji gerektiğinde kullanılan çok
kolay ve reversibl bir tepkimedir. Çok hızlı bir
reaksiyondur ve denge durumunda trioz
fosfatın % 96’sı DHAP şeklindedir. Görüleceği
gibi 1 mol Fruktoz 1,6- bifosfattan aldolaz ve
trioz fosfat izomeraz etkisi sonucunda iki mol
GAL-3P elde edilmektedir.
Buraya dek 2 mol ATP harcanmış ve henüz
enerji ortaya çıkarılmış değildir.
42
6. Gliseraldehid 3-fosfatın 1,3
bifosfogliserat’a dönüşümü: Bu reaksiyon
gliseraldehid 3-fosfat dehidrojenaz tarafından
katalizlenmektedir. Altıncı reaksiyonda çok
önemli ve ilk yüksek enerjili bir bileşiğin
üretildiği bir reaksiyondur.
43
Normalde ekzergoniktir, standart koşullar
altında endergonik özellik gösterir. Öte yandan
subsrat konsantrasyonunun tepkime yönünü
etkilediği düşünülürse bu reaksiyonun da
ekzergonik olduğu anlaşılabilir.
Bu tepkimede NAD+ indirgenirken, GAL-3P’ın
aldehid grubu karboksilik aside
oksitlenmektedir. NAD+ nin indirgenmesiyle
birlikte karboksilik asit fosforik asit karışık
anhidridi olan yüksek enerjili bir fosfat bileşiği
(1,3-bifosfogliserat) elde edilmektedir (Şekil 5).
44
Şekil 5. Gliseraldehid-3-fosfat dehidrojenaz’ın etki
mekanizması.
H
H+ + 2e
45
Dehidrojenaz tepkimesinde, aldehid grubunda
hidrojen alıcısı olan koenzim NAD+ yapısındaki
nikotinamid halkasına bir hidrit iyonunun (:H)
enzimatik olarak taşınması gerçekleşmektedir.
Subsratın diğer hidrojen atomu çözeltide H+
olarak kalmaktadır. Gliseraldehid-3- fosfatın
oksidasyonu subsratın enzime kovalent olarak
bağlandığı bir ara bileşiğin oluşumunu
içermektedir. Gliseraldehidin aldehid grubu,
enzimin aktif merkezindeki sistein kalıntısının
SH grubuna bağlanarak tiyohemiasetal
oluşturmaktadır.
46
Enzim yüzeyindeki internal yükseltgenmeindirgenme tepkimesi ile NAD+ indirgenmekte
ve tiyohemiasetal bileşiği yüksek enerjili
tiyoester oluşturmak üzere oksitlenmektedir.
NAD+, NADH ile yer değiştirmekte, tiyoester Pi
ile tepkimeye girerek karışık anhidrid
oluşturmakta ve serbest
SH grubu
yenilenmektedir.
47
7. 1,3 Difosfogliserat’ın 3- Fosfogliserata
dönüşümü: Fosfogliserat kinaz enzimi 1,3bifosfogliseratın karboksil grubundan yüksek
enerjili fosfat grubunu ADP yapısına aktararak
ATP ve 3-fosfogliserat oluşumunu katalize
etmektedir.
Subsrattan fosfat grubu transferi ile ATP
oluşumu, subsrat düzeyinde fosforilasyon
olarak adlandırılmaktadır.
48
8. 3-Fosfogliseratın 2-fosfogliserata
dönüşümü: Bifosfogliserat mutaz enzimi
gliseratın 2 ve 3 nolu karbon atomları arasında
fosfat grubunun değiştirilmesini katalize
etmektedir. Bu reaksiyon kofaktör olarak
eşdeğer miktarda 2,3 bifosfogliserata (2,3BFG) ihtiyaç duyar.
49
Çoğu hücrede 2,3-BPG düşük konsantrasyonda bulunur. Buna karşın, kırmızı kan
hücrelerinde 4 mM (hemoglobin molaritesine
eşit)dir. 2,3- BPG oksijen taşınmasında
deoksijene olmuş sabitleyerek kontrol görevi
yapar.
50
51
Eritrositlerde glikoliz ve O2 taşınması 2,3-BPG
ile bağlantılıdır. Bu yüzden glikolizis yolunda bir
arıza örneğin piruvat kinaz aktivitesindeki
yetersizlik 2,3-BPG’ın konsantrasyonunun iki
katına çıkmasına sebep olur. Bu da düşük O2
affinitesine (ilgisine) sebep olur. 2,3 BPG
deoksihemoglobine bağlanıp oksihemoglobine
bağlanmayarak oksijene ilgisini azaltır.
HbO2 + 2,3-BPG
Hb -2,3-BPG + O2
52
Alyuvarlarda görüldüğü gibi 2,3-BPG’nin varlığı
hemoglobinin oksijene ilgisini anlamlı olarak
azaltarak oksijen-dissosiasyon eğrisinin sağa
kaymasına neden olur (Şekil 6). Bu azalan ilgi
dokulardaki parsiyel basınçlardaki
hemoglobinin oksijenini etkili olarak
serbestleştirilmesini sağlar.
53
54
55
9. 2-Fosfogliseratın fosfoenol piruvata
dehidrasyonu: Yüksek enerjili fosfat grubu
transfer potansiyeline sahip olan bir bileşiğin
üretildiği ikinci glikolitik reaksiyondur. Enolaz
tarafından katalize edilen reversibl reaksiyon 2fosfogliserattan bir molekül suyun çıkarılması
ile fosfoenolpiruvat oluşturulmaktadır.
56
Bu reaksiyonda standart serbest enerji değişimi
küçük olduğu halde oluşan ürünün hidrolizi ile
yüksek serbest enerji açığa çıkmaktadır.
Fosfoenol bağı yüksek enerjili fosfat bağıdır.
57
10. Fosfoenolpiruvattan fosfat grubunun
ADP yapısına taşınması: Glikolizisin bu son
tepkimesini piruvat kinaz katalizlemektedir. Bu
tepkimede subsrat düzeyinde fosforilasyon ile
ATP sentezlenmektedir. Piruvat kinaz
allosterik bir enzimdir. ATP, alanin, yağ asidleri
ve asetil-CoA ile inhibe olur. Karaciğerdeki
izoenzimi Fruktoz 1,6-bifosfat ile aktive olur.
58
Karaciğer enzimi ayrıca kovalent modifikasyon
ile regüle olur. cAMP’ye bağımlı protein kinaz
ile fosforile olurken (inaktif formu), fosfataz ile
defosforile olur (aktif formu). Karaciğer
izoenzimi, yüksek karbonhidrat ve insülin
seviyeleri ile indüklenir.
59
Piruvat kinaz eksikliği: Genetik bir defekttir.
Eritrosit piruvat kinaz eksikliği ile, hemolitik
anemiler oluşur. Anemi, glikoliz hızının
düşüklüğü ve ATP sentezinin hücrenin enerji
gereksinimini ve eritrosit membranının yapısal
bütünlüğünü korumak için yetersiz kalması
sonucu oluşur. Çünkü olgun eritrositlerde
mitokondri yoktur ve ATP üretiminin tek yolu
glikolizdir. Eritrosit membran değişiklikleri ile
hücrenin şekli değişip, RES’de makrofajlarca
fagosite edilir. Eritrositlerin parçalanması ve
erken ölümü hemolitik anemi olarak sonuçlanır.
60
Eritrositlerde, 2.3 BPG birikir. Hb’in oksijen
bağlamasını inhibe ettiği için, akciğerlerden
oksijen alımı bozulur. Bu, heksokinaz
eksikliğinde oluşan durumun tersidir.
Tablo 7.2. Glikoliz reaksiyonları
61
62
63
Piruvatın Akıbeti;
1. Aerobik şartlarda; Asetil CoA üzerinden
SAS-TCA’a girer.
2. Anaerobik şartlarda ise; insan ve
hayvanlarda laktat’a, maya hücrelerinde
etanole çevrilir.
Anaerobik glikolizin gereği piruvatın laktata
İndirgenmesi: Laktat dehidrogenaz (LDH)
katalizi ile oluşur.
Piruvat’tan laktat oluşturan dokular.
• Eritrositler, Lökositler, Gözde lens ve kornea,
Böbrek medullası, Testisler.
64
Kasta laktat oluşumu: Egzersiz halindeki
iskelet kasında, NADH üretimi (glikoliz ve SAS
ile) solunum zincirinin oksidatif kapasitesini
aşar. NAD+ kazanılması için, piruvatın laktata
dönüşümü kullanılır. Bu nedenle yoğun
egzersiz sonrası, laktat kas içinde birikerek
intraselüler pH’ın düşmesine ve kramplara
neden olur. Biriken laktat zamanla kan
dolaşımına difüze olur. Kas dokusunda oluşan
laktat Cori siklüsü aracılığı ile karaciğere
taşınır ve böylece glikoneogenez yolu ile
glukoz sentezlenir.
65
LDH reaksiyonunun yönü piruvat ve laktatın
oranlarına ve hücre içi NADH / NAD+ oranına
bağlıdır. Örneğin; karaciğer ve kalpte NADH /
NAD+ oranı, egzersiz halindeki kastan daha
düşüktür (NADH glikoneogenezde kullanılır
veya mekik sistemine girer).
Bu dokular kanla getirilen laktatı piruvata
çevirirler. Karaciğer’de pirüvat ya
glukoneojenez ile glukoza dönüştürülür veya
SAS’de yıkılır. Kalp kası laktatı, piruvat
üzerinden SAS ile tamamen CO2, ve H2O’ya
66
Laktik asidoz: Myokart infarktüsü, pulmoner
emboli ve kontrol edilemeyen kanama gibi
durumlarda oluşan dolaşım sistemi kollapsında
görülür. Dokulara yeterli oksijen taşınmasındaki
eksiklik, oksidatif fosforilasyonun bozulmasına
ve ATP sentezinin düşmesine neden olur.
Hücreler yaşamak için, ATP üretmek amacı ile
anaerobik glikolizi kullanırlar. Böylece laktat
birikir ve plazmaya çıkarak laktik asidoz
oluşturur.
67
Glikolizin Enerji Bilançosu
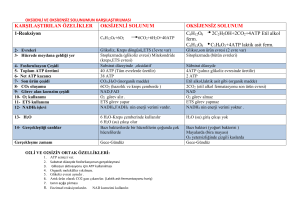
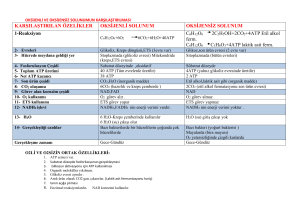
A. Aerobik glikolizde bilanço:
Glukoz + 2Pi + 2 ADP + 2 NAD+
2 Piruvat +2 ATP +2 NADH +2 H+ + 2 H2O
Aerobik glikolizin sürmesi için, bu NADH’ların
elektron transport zinciri üzerinden okside
olması gerekir. Bu yolla her NADH başına
Malat-Aspartat mekiği ile 2,5 ATP, Gliserol 3-P
mekiği ile 1,5 ATP elde edilir. 2 NADH oluştuğu
için kazanç 5 veya 3 ATP’dir. Piruvat da
SAS’ne girerek enerji üretir.
68
B. Anaerobik glikolizde bilanço
Glukoz + 2Pi + 2 ADP
2 Laktat + 2 ATP + 2 H2O
Net NADH Üretimi veya tüketimi yoktur.
Gliseraldehit 3P dehidrogenaz ile oluşturulan
NADH, laktat dehidrogenaz ile harcanır.
Glikolizde ATP’nin üretim ve tüketim yolları
(Tablo 3).
69
Glikolizin Düzenlenmesi:
Glikoliz, 3 irrseversibl kinaz basamağı içerir
ve düzenlenme de bu basamaklar aracılığı ile
olur. Glikolizin kinaz reaksiyonlarından
fosfogliserat kinaz reaksiyonu, reversibildir ve
düzenlenmede katkısı yoktur.
Heksokinaz: Glukoz-6 fosfat ile inhibe olur.
Glukokinaz: İnsulin ile etkinliği artırılır.
Fosfofruktokinaz 1: Pi eklenince inaktif olur.
Hız kısıtlayıcı basamak enzimidir.
70
PFK-1, düzenlenmede eşik enzim görevi yapar.
Bunun için, substratı ile aktiflenmez ve
ürünüyle de inhibisyona uğratılmaz. Hatta
ürünü olan Fruktoz 1,6 bifosfat ile aktiflendiği
kabul edilir.
Aktivatörleri
İnhibitörleri
Fruktoz 2,6 bifosfat
ATP
AMP
ADP
Sitrat
Yağ asitleri ve bazı
amino asitleri
71
En güçlü aktivatör; Fruktoz 2,6 bifosfat’tır.
Fruktoz 6P’dan PFK-2 katalizi ile oluşur,
yıkılımını ise Fruktoz 2,6 bifosfataz sağlar.
PFK-2 ve Fru 2,6 bifosfatazın aynı enzim olup,
değişik şartlarda değişik fonksiyonları yaptığı
ve bu yüzden de çift-işlevli enzim olduğu
şeklinde iddialar da vardır. Fruktoz 2,6
bifosfataz, aynı zamanda glikoneojenetik yol
enzimlerinden birisi olan Fruktoz 1,6 bifosfataz’ı
inhibe ederek bu iki yolun (giikoliz ve
glikoneojenez) aynı anda aktive olmalarını
engeller. Yani, Fruktoz 2,6 bifosfat glikolizi
hızlandırırken, glikoneojenezi baskılar.
72
Glukozun kandaki miktarı arttığı zaman,
Fruktoz 2,6 bifosfat da artar. TCA-SAS’de
yüksek enerjiye yanıt olarak akış durur.
Dolayısıyla, sitrat birikir. Sitrat artışı, enerjinin
yeterli olduğu sinyalini vererek glikolizi
yavaşlatır. Glikolizin düzenlenmesi (Şekil 8).
3.Piruvat kinaz: Fosfat (P) eklenince inaktif olur.
Aktivatörleri
İnhibitörleri
Fruktoz 1,6 Bifosfat
ATP
Karbonhidratlar (Özellikle fruktoz) Asetil CoA
Uzun zincirli yağ asitleri
Alanin
73
Şekil 8.
Glikolizin
düzenlenmesi
74
Glikolizin, allosterik düzenlenmesi veya hız
kısıtlayıcı enzimlerin
fosforilasyon/defosforilasyonu ile düzenlenmesi
kısa sürelidir. Yani bunlar, glukoz tüketimini
dakika veya saatler boyunca etkilerler.
Oysa hormonlar, enzim sentezini etkileyerek,
miktarlarını 10-20 kat artırarak, saatler ve
günler boyunca yıkımı düzenlerler-uzun süreli.
Karbonhidrattan zengin yemek yenilmesi ile,
karaciğerde glikoliz enzimlerinin sentezi artar.
Böylece toklukta, glukozun piruvata dönüşümü
artar. Açlıkta ise tam tersi olur.
75
Kan glukoz düzeyi düştüğünde, açlık ve
diabette yükselen glukagon hücre içi cAMP
seviyesini yükselterek, piruvat kinazı fosforiller
ve onu inaktive eder. Böylece, PEP glikolitik
yola devam edemez bunun yerine
glukoneojeneze saparak, kan glukoz
seviyesinin artırılmasını sağlar.
Büyüme hormonu-GH- ise;
1. Dokulara glukoz girişini azaltarak,
2. Lipolizi artırıp, serbest yağ asitlerini açığa
çıkararak, PFK-1 ve piruvat kinaz inhibisyonu
ile glikolizi baskılayarak kan şekerini yükseltir.
76
Glikolitik yola Diğer Şekerlerin
katılması
Şu ana kadar glikolizis yolunda karbon kaynağı
olarak glukozdan bahsedildi.
Enerji kaynağı olarak birçok karbonhidrat
vardır. Bunlar sindirim yolu ile ya da endojen
metabolitlerin kullanımıyla elde edilir.
77
Glikolitik yola Diğer Şekerlerin
katılması
Glikoliz, disakkaritlerden türeyen
monosakkaritler için ortak yıkım yoludur. Bu
kaynaklardan monosakkaritler, disakkaritler ve
gliserol anlatılacaktır.
78
Kaynaklar:
1.
2.
3.
Richard A. Harvey, Pamela C. Champe: Lippincott’s
Illustrated Reviews Serisinden Biyokimya 3. baskı Çeviri
editörü: Doç. Dr. Engin Ulukaya. Nobel Tıp Kitabevi. 2007
David L. Nelson, Michael M. Cox. Lehninger Biyokimyanın
ilkeleri Çeviri editörü: Prof. Dr. Nedret Kılınç. Palme
Yayıncılık. Ankara 2005.
Taner Onat, Kaya Emerk, Eser Y. Sözmen. İnsan
biyokimyası Palme yayıncılık, Ankara, 2002.
4.
Rex Montgomery, Thomas W. Conway, Arthur A. Spector
Biyokimya olgu sunumlu yaklaşım. Çeviri editörü: Nilgün
Altan Palme Yayıncılık. Ankara, 2000.
5.
Robert K. Murray, Daryl K. Granner, Peter A. Mayes, Victor
V. Rodwell Harper biyokimya, Çeviri editörü: Nurten
Dikmen, Tuncay Özgünen. Nobel Tıp Kitabevi Ankara,
2004