2. iyonik bileşikler - Soruhane.com
advertisement

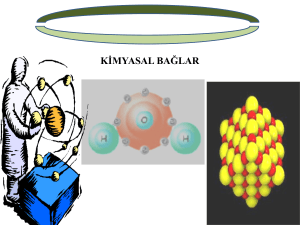
3. KOVALENT BİLEŞİKLER 1 KOVALENT BİLEŞİKLER: Kovalent bileşikler, elektron çiftinin atomlar arasında ortaklaşa kullanılmasıyla oluşur. Burada ortaklaşa kullanılan elektronlarla, pozitif atom çekirdekleri arasındaki çekme kuvveti etkisiyle kimyasal bağ oluşur. 2 APOLAR KOVALENT BİLEŞİKLER Aynı cins ametal atomları arasında olan kovalent bağlı bileşiklerdir. Örnek olarak iki hidrojen atomu arasında oluşan hidrojen molekülünü inceleyelim: Her bir hidrojen atomu 1 elektrona sahiptir. Bu birer elektronun ortaklaşa kullanılmasıyla hidrojen atomları arasında bir bağ meydana gelir. Oluşan molekül H2 molekülüdür. 3 Hidrojen molekülü; H..H veya H–H şeklinde gösterilir. Birincisi elektron nokta yapısı (Lewis yapısı), ikincisi ise açık formüldür. O2, F2, Cl2, Br2, I2 ve N2 moleküllerinde de apolar kovalent bağ vardır. 4 POLAR KOVALENT BİLEŞİKLER Örnek olarak HF molekülünün oluşumunu inceleyelim: Florun son enerji düzeyinde 7 elektronu, hidrojenin ise 1 elektronu vardır. Hidrojen ve flor arasında bir kovalent bağ oluşur. Florun elektron severliği hidrojenden fazla olduğundan ortaklaşa kullanılan elektronları kendisine daha fazla çekeceğinden kısmi negatif yükle, hidrojen de kısmi pozitif yükle yüklenir. 5 Bağda kutuplanma meydana gelir. Oluşan HF bileşiğidir. H..F elektron nokta yapısıdır. Açık formül H–F şeklinde gösterilir. Molekül doğrusaldır. Farklı cinste ametal atomları arasında oluşan kovalent bağlı bileşiklerdir. HF, HCI, CO, NO molekülleri polar kovalent bileşiklerdir. 6 HÂL DEĞİŞTİRME ANINDA KIRILAN KİMYASAL BAĞIN CİNSİ; İYONİK BİLEŞİKLERDE KOVALENT BİLEŞİKLER ARASINDA FARKLILIK GÖSTERİR Hâl değişikliğinde tanecikler arası mesafenin değişmesi kovalent bileşikler için geçerlidir. 7 Kovalent bileşiklerin hâl değiştirmesinde kırılan kimyasal bağ, tanecikler arası bağdır. Kovalent bileşiklerin hâl değiştirmesinde tanecik içi kimyasal bağ aynen kalır. İyon yapılı bileşikler hâl değiştirirken ise tanecik içi kimyasal bağ olan iyonik bağ kırılır. 8 KSENONUN OKSİJENLE YAPTIĞI BİLEŞİKLER XeO3 XeO4 Na4XeO6 x nH2O 2Ba2XeO6 x 3H2O 9 KSENONUN OKSİJENLE VE FLORLA YAPTIĞI BİLEŞİKLER XeO2F2 XeOF2 XeOF4 KXeO3F (NO)2XeF8 10 KSENONUN FLORLA YAPTIĞI BİLEŞİKLER XeF2 XeF4 XeF6 XeF6 x SbF5 XeF6 x AsF5 11 XeF2 x 2SbF5 XeF2 x 2TaF5 XeF6 x BF3 RbXeF7 NaXeF8 K2XeF8 Cs2XeF8 Rb2XeF8 12 KRİPTON VE RADONUN FLORLA YAPTIĞI BİLEŞİKLER KrF2 KrF2 x SbF5 KrF4 RnFn 13 SOY GAZLAR YAPAY BİLEŞİK OLUŞTURUR Soy gazlardan He (helyum), Ne (neon), Ar (argon) elementlerinin hiçbir bileşiği yoktur. Kr (kripton), Xe (ksenon) ve Rn (radon) elementleri ise özel şartlarda O2 (oksijen) gazı ve F2 (flor) gazıyla bileşik oluştururlar. Neden soy gazlardan ilk üçü bileşik yapmıyor da son üçü bileşik yapıyor? Neden yalnız O2 ve F2 elementleriyle bileşik oluşturuyorlar? 14 Elektronegatiflik; bağ elektronlarını çekme kabiliyetidir. Elektronegatiflik, periyodik tabloda soldan sağa doğru artar. Soy gazların elektronegatifliği diğer gruplara göre yüksektir. Bununla beraber O ve F elementlerinin elektronegatifliği; Kr, Xe ve Rn’dan daha fazladır. He, Ne ve Ar elementleri için elektronegatiflik söz konusu değildir. Oksijenin elektronegatifliği 3,5, florun 4, kriptonun 3, ksenonun 2,6, radonun ise 2,4’tür. 15 Oksijen ve florun elektronegatifliği ile son üç soy gazın elektronegatiflikleri arasında fark azdır. Bu nedenle oluşan bileşik, kovalent özelliktedir. Elektronegatifliği az olan Kr, Xe ve Rn kısmi pozitif konumunda; elektronegatifliği fazla olan O ve F ise kısmi negatif konumundadır. Soy gaz bileşikleri, yapaydır. Araştırma amaçlı üretilmiştir. Kullanım yerleri yoktur. 16 Oluşturulma reaksiyonları, endotermik olduğundan masraflıdır. Tabloda görüldüğü gibi çok farklı bileşik oluştururlar. İki element arasında çok sayıda bileşiğin meydana gelmesi; kararsızlığın ve zorla oluşturulmanın göstergesidir. Kararsız bileşik, hemen bozunan bileşik anlamına gelir. 17 Soy gaz bileşikleri, ametal– ametal bileşikleri gibi adlandırılır. Soy gazlar, havada bulunan elementlerdir. Soy gaz bileşikleri, 1964 yılında üretilmiştir. 18 ELEMENTEL HÂLDE OLAN SOY GAZLARIN HAVADA HACİMCE BULUNMA YÜZDELERİ Helyum HACİMCE YÜZDESİ 0,0005 Neon 0,0012 Argon 0,94 Kripton 0,0001 Ksenon 0,000009 GAZIN ADI 19 METALLERİN SERBEST YA DA BİLEŞİK OLARAK DOĞADA BULUNMASIDAKİ KURAL İndirgenme yarı pil gerilimi listesinde; indirgenme potansiyeli hidrojenden yüksek olan elementler, soy (altın, platin, gümüş) metaller ve yarı soy (bakır, cıva) metallerdir. Soy metaller doğada yalnız elementel hâlde bulunur, bileşikleri hâlinde bulunmaz. 20 Yarı soy metaller ise hem elementel hâlde hem de bileşiği hâlinde bulunur. Amalgam diş dolgular; cıva ve gümüş içerir. Altın diş dolgusu da vardır. Platin metali ise, protezlerde kullanılır. Bütün bu kullanımlarda altın, platin, gümüş ve cıva; aynen doğadaki gibi metalik hâldedir. Sıfır değerliklidir. Bu nedenle de sağlığa zararları yoktur. Bakır ve cıva da soy metaller gibi genelde doğada serbest hâlde bulunur. 21 Bakır ve cıva metallerine, yarı soy metal denmesinin sebebi; doğada doğal bileşiklerinin de olmasıdır. Bu 5 element dışındaki bütün metaller, yaklaşık 70 metal doğada yalnız bileşikleri hâlinde bulunur, hiçbiri serbest hâlde bulunmaz. Örneğin doğada Na, Ca, Al yoktur. NaCl (yemek tuzu), CaCO3 (mermer), Al2O3 (alüminyum metalinin elektroliz yöntemiyle elde edildiği boksit cevheri) vardır. 22 Tabiatta bulunan ve suda çözünmeyen doğal inorganik metal bileşiklerine cevher (filiz) denir. Formülü basit olan cevherler olduğu gibi, kompleks olanları da vardır. Genellikle kaya tuzu gibi suda çözünenler yerin derinliklerinde, suda çözünmeyenler ise yerin üstündedir. Demir ve nikelin indirgenme potansiyeli hidrojenden az olmasına rağmen, yerkürenin merkezinde erimiş elementel hâlde de bulunurlar. 23 AMETALLERİN SERBEST YA DA BİLEŞİK OLARAK DOĞADA BULUNMASIDAKİ KURAL F2 gazı ve Cl2 gazı, tabiatta bulunmaz. Doğada florür bileşikleri ve klorür bileşikleri vardır. Bu ikisinden başka bütün ametaller, hem elementel hâlde hem de bileşiği hâlinde bulunur. Tabloda bunlar örneklerle gösterilmiştir: 24 AMETALİN DOĞAL SEMBOLÜ ELEMENTEL AMETALİN FORMÜLÜ AMETAL İÇEREN DOĞAL BİLEŞİĞİNİN FORMÜLÜ CO2 H2O C H C (KÖMÜR) H2 (HİDROJEN) O N S O2 (OKSİJEN) CaCO3 (ALÇI) N2 (AZOT) PROTEİN S (KÜKÜRT TOZU) CaSO4 (MERMER) Si (AKİK TAŞI) SiO2 (KUM) Si 25 BİLEŞİKLER KONUSUYLA İLGİLİ SOSYAL ALANDA KULLANILAN KİMYA KELİME VE DEYİMLERİ Aile, toplumun molekülüdür. 26