DNA HEDEFLø øLACIN
ELEKTROKøMYASAL SENSÖRLE
TAYøNø
Ecem KILINÇ
Ezgi KARAGÖZ
Özel Ege Lisesi
2009
øÇøNDEKøLER
Projenin Amacı…………………………………………………………………………………..
2
Giriú………………………………………………………………………………………………..
2
Biyosensör……………………………………………………………………………………..
3
ølaç-DNA etkileúmesinin DNA biyosensörleri ile algılanması…………………………….
4
Yöntem…………………………………………………………………………………………….
5
Elektrotların hazırlanıúı……………………………………………………………………….
5
Çözeltilerin hazırlanıúı…………………………………………………………………………
6
Çalıúma basamakları………………………………………………………………………….
7
Sonuçlar ve tartıúma……………………………………………………………………………
8
Kaynaklar………………………………………………………………………………………….
11
1
PROJENøN AMACI
Tek kullanımlık elektrokimyasal sensör teknolojisini kullanarak, antikanser ilaç
sisplatin’in DNA ile etkileúimini tayin etmek ve ilaç-DNA etkileúim mekanizmaları açıklayan
mevcut yöntemlere kıyasla daha kolay, daha hızlı, daha seçimli ve güvenli bir úekilde ilaçDNA etkileúmesinin tanımlanmasına yönelik alternatif bir yöntem tasarlamaktır.
GøRøù
Elektrokimyasal sensörler (elektrokimyasal algılayıcı sistemler) Analitik Kimya’da
oldukça yaygın kullanımı olan cihazlardır. Bu cihazlara IUPAC tarafından getirilen tanım úu
úekildedir:
“Kimyasal bileúiklere ya da iyonlara seçici ve tersinir bir úekilde cevap veren ve
konsantrasyona ba÷ımlı elektriksel sinyaller oluúturan küçültülmüú cihazlara elektrokimyasal
sensörler “denir (1). Bu sensörler, yapılarına enzim, hücre, doku, antikor, DNA, vb. biyolojik
maddelerin eklenmesiyle BøYOSENSÖR adını almıúlardır.
Nitel ve nicel analiz yapabilen biyosensörler, “biyo” (biyolojik kökenli) ve “sensör”
(algılayıcı) kelimelerinden oluúmaktadır. Di÷er bir tanım ise; “Biri biyokimyasal, di÷eri ise
elektrokimyasal özellikte, birbiri içine geçmiú iki çeviriciden oluúan algılayıcı cihaz” olabilir.
Biyokimyasal çevirici analizlenecek madde ile etkileúerek onu tanır. Bu etkileúme sonucunda
oluúan madde, elektrokimyasal çevirici tarafından okunabilir bir sayısal de÷ere çevrilir.
Nükleik asitlerden oluúan tanıma yüzeyleri, her geçen gün daha ilgi çekici konular halini
almaktadır. Bu tür tanıma yüzeyleri, bilinen elektrokimyasal biyosensörlere yeni ve ender
boyutlarda özellikler eklemektedir. Bu geliúme ile elektrokimyasal DNA biyosensörlerinin
gelecekte hasta baúında yapılacak doktor gözetimindeki analizlerde önemli bir rol
oynayaca÷ı kesindir. Elektrokimyasal yöntemlerle birlikte DNA’nın nitel ve nicel analizini
yapma amacına yönelik tasarlanan biyosensörlerde tanıma yüzey katmanı olarak DNA
kullanılmasına ilgi de giderek artmaktadır (2-4).
Nükleik asit (DNA) tanıma yüzeyi içeren biyosensörler, bu yüzey ile etkileúime giren
analizlenecek maddenin (karsinojen maddeler, ilaçlar vb.) etkileúim mekanizmasının
aydınlatılması veya miktarının tayininde veya DNA’daki baz dizisi belli bölgelerdeki
hibridizasyon olaylarının izlenmesi gibi amaçlarla kullanılabilir (5-8).
Analizlenecek
maddenin, DNA ile etkileúmesi sonucunda, incelenen maddenin veya DNA’daki bir bazın
sinyalinde meydana gelecek de÷iúiklikler sayesinde tayini yapılabilmektedir.
Bazı ilaç molekülleriyle DNA' nın etkileúmesi (özellikle de antikanser özellik taúıyan ilaç
molekülleri ile etkileúim) ve bu etkileúmenin geliútirilen yeni yöntemlerle tayin edilmesi; yeni
ilaç tasarımları için çok önemlidir. Yine bazı maddelerin (çevresel kirlilik ajanları, toksik
molekül, vb.)
çift sarmal DNA ile interkalasyon (düzlemsel yapıdaki maddenin DNA çift
2
sarmalı arasına girerek yerleúmesi), baza seçimli ba÷lanma vb. yollarla etkileúimi sonucu bir
ürünün oluúması, bu ürüne duyarlı elektrokimyasal DNA biyosensör tasarımını getirmiútir. Bir
kimyasal maddenin veya metabolitin DNA ile etkileúimi sonrasında DNA’da oluúabilecek yan
ürünlerin (=adduct) kısa zamanda tespiti kanser araútırmaları için çok önemlidir (9).
Madde-DNA etkileúiminin sonucunda, çalıúmanın türüne göre elde edilen madde
sinyali ya da DNA’daki bir bazın sinyalindeki artma veya azalmaya ba÷lı olarak
elektrokimyasal tayin gerçekleútirilmektedir. Bu amaçla kullanılan DNA modifiye edilmiú
camsı karbon elektrotlar (GCE), karbon pastası elektrotlar (CPE), perde baskılı karbon
(SCPE) ve altın perde baskılı elektrotlar (Au-SCPE), Altın elektrotlar (AuE) ve asılı civa
damla
elektrodu
(HMDE)
incelenen
maddelerin
mikromolar
ve
hatta
nanomolar
konsantrasyonlarının dahi, kısa bir biriktirme aúaması sonrası güvenli ölçümlerini mümkün
kılmaktadır (10-14).
Çalıúmamızın amacı, tek kullanımlık elektrokimyasal sensör teknolojisini kullanarak,
antikanser ilaç sisplatin’in DNA ile etkileúimini tayin etmek ve ilaç-DNA etkileúim
mekanizmaları açıklayan mevcut yöntemlere kıyasla daha kolay, daha hızlı, daha seçimli ve
güvenli bir úekilde ilaç-DNA etkileúmesinin tanımlanmasına yönelik alternatif bir yöntem
tasarlamaktır.
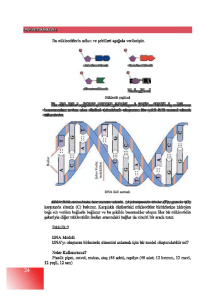
BøYOSENSÖR: Biyosensörler biyolojik tepkimelerde hedef analizlenecek maddeleri
tayin etmek için kullanılan küçük algılayıcı cihazlardır. Birbiri içine geçmiú biri biyokimyasal,
di÷eri elektrokimyasal özellikteki iki çeviriciden oluúmaktadır. Biyokimyasal kısmın görevi
analizlenecek maddeyle etkileúerek onu tanımaktır. Bu tanıma olayının sonucunda bir
biyokimyasal ürün de oluúabilmektedir. Biyosensörün ikinci kısmı olan elektrokimyasal kısım
ise, bu tanıma olayını okunabilir (ölçülebilir) bir sayısal de÷ere çevirmekle görevlidir (15).
( ùekil 1)
ùekil 1: Biyosensörün yapısı
Tanıma yüzeyi olarak DNA’nın kullanıldı÷ı biyosensörlere DNA biyosensörleri adı
verilir. DNA tanıma yüzeyleri, dizisi belli hibridizasyon olaylarının izlenmesinde
veya bu
yüzey ile etkileúime giren analizlenecek maddelerin (karsinojen madeler, ilaçlar, vb.)
tayininde kullanılabilir.
3
ødeal bir biyosensörün sahip olması gereken özellikler:
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
Seçicilik
Kullanım Ömrü
Kalibrasyon Gereksinmesi
Tekrarlanabilirlik
Stabilite
Yüksek Duyarlılık
Yeterli Düzeyde Tayin Sınırı
Geniú Ölçüm Aralı÷ı
Hızlı Cevap Zamanı
Hızlı Geriye Dönme Zamanı
Basitlik ve Ucuzluk
Küçültülebilirlik ve Sterilize edilebilirlik
øLAÇ-DNA ETKøLEùMESøNøN ELEKTROKøMYASAL DNA BøYOSENSORLERø øLE
ALGILANMASI: DNA hedefli ilaç tasarımında, ilaç-DNA etkileúmesinin önemli bir yeri vardır.
Yeni sentezlenen küçük moleküllerin DNA’ya ba÷lanması ve onunla etkileúmesi, yeni
ilaçların tasarımında oldu÷u kadar, DNA’yı algılama yöntemlerinin geliútirilmesinde ve
çevreye zararlı maddelerin algılanmasında da önemlidir (16-23). DNA ve ilaç arasındaki
moleküler etkileúim, bu bileúiklerin hızlı görüntülenmesi ve aygıtların geliútirilmesi için
önemlidir. ølaçların DNA’ya ba÷lanması ile ilgili çeúitli etkileúim türleri vardır. Bu etkileúim
çeúitleri, elektrostatik ba÷lanma, çapraz ba÷lanma ve interkalasyonla etkileúmedir. ølaç-DNA
etkileúimini elektrokimyasal biyosensörle tayin ederken izlenen yol; Etkileúim öncesi ve
sonrası mevcut ilaç sinyalindeki ve/veya DNA’daki elektroaktif bazlar, guanin ve adenin
sinyalindeki de÷iúim ölçülür ve bu de÷iúime göre etkileúim hakkında yorum yapılır(24).
(úema)
ùema: ølaç – DNA etkileúmesinin elektrokimyasal DNA biyosensörlerle algılanması
4
YÖNTEM
KULLANILAN CøHAZLAR VE KøMYASAL MADDELER
Ölçümler ve deneyler esnasında kullanılan tüm cihaz, donanım ve yazılımlar;
Terazi (Mettler Toledo AB204-S )
Ses titreúimli temizleyici (Bandelin Sonorex)
pH-metre (Orion 420A)
Manyetik karıútırıcı (Biosan MS 3000)
Vorteks (Biosan V1)
Potansiyostat (AUTOLAB 302, GPES 4,9 yazılımlı; Eco Chemie,Hollanda)
Ag/AgCl referans elektrot (BAS)
Platin tel (Yardımcı elektrot olarak kullanıldı)
Çalıúma elektrodu (kalem grafit elektrot-PGE)
Asetik Asit (%99-100) (Merck)
Hidroklorik asit (%37) (Merck)
Sodyum Hidroksit (Merck)
Sisplatin (Sigma)
Tris (hidroksimetil)aminometan hidroklorür (Sigma)
Sodyum klorür (Sigma)
Tüm çalıúmalarda sterilize edilmiú deiyonize su kullanıldı. Deneysel çalıúmalar oda
sıcaklı÷ında (25.0 r 0.5) q C’ de gerçekleútirildi.
ùekil 2. Bilgisayara ba÷lı elektrokimyasal ölçüm cihazı
ùekil 3.Üçlü elektrot sistemi
Elektrotların Hazırlanıúı
Kalem Ucu Grafit Elektrot (PGE) hazırlanıúı:
Grafit uç içeren kalem elektrodun tekrarlanabilirli÷inin daha iyi olması, daha düúük tayin
sınırı, ucuz ve tek kullanımlık olması sebebiyle bu elektrodun kullanılmasına artan bir ilgi
bulunmaktadır (16,22).
5
Çalıúmada kullanılan kalem ucu elektrot; Tombo HB kalem uçlarının 3 cm boyutunda
kesilmesiyle hazırlandı. (ùekil 4)
ùekil 4: Kalem ucu elektrot.
0,02 M Tris HCl tampon çözeltisinin hazırlanıúı (pH 7,0):
Kullanılan 0,02 M Tris HCl tampon çözeltisi litresinde 3,152 g Trizma HCl içermektedir.
Çözeltinin pH'sının 4,8 de÷erine ulaúması için gerekli kontrol, 0,1 N NaOH ve / veya 0,1 N
HCl ilavesiyle pH-metre ile gerçekleútirilir.
Asetat tampon çözeltisinin hazırlanıúı:
Kullanılan 0,5 M asetat tampon çözeltisi litresinde 2,722 g. CH3COONa.3H2O ve 1,154
mL CH3COOH (%99, 1.05 g/mL) içermektedir. NaCl deriúimi 20 mM olacak úekilde 1,17 g
NaCl ilave edilmiútir. Hazırlanan asetat tamponunun pH de÷eri 4,8 ‘ dir.
Sisplatin (cis-DDP) Hakkında Genel Bilgi:
Açık yapı formülü:
Kapalı kimyasal formül: Pt(NH3)2CI2
Kimyasal adlandırma: cis-diamminedichloroplatinum(II)
Kimyasal Özellikleri: Molekül a÷ırlı÷ı, 330.06 g/mol’ dür.
Farmakolojik özellikleri:
Sisplatin (cis-DDP), klinikte prostat, meme, pankreas, baú ve
boyun, akci÷er, uterus, yemek borusu, kolorektum, penis ve pediatrik tümörlerde tek baúına
veya di÷er antineoplastik ajanlarla kombine halde kullanılmaktadır. cis-DDP hücre
bölünmesini engelleyen ajanlara benzer biyokimyasal özelliklere sahiptir. Non-spesifik olarak
hücre siklusunu etkiler, böylece DNA'da çapraz ba÷lar oluúturarak DNA sentezine karıúmıú
olur. DNA-RNA sentezini inhibe ederek sitotoksik etki gösterir (25,27).
6
cis-DDP çözeltisinin hazırlanıúı:
1000 Pg/mL’lik ana stok çözeltisi, dimetilsülfoksit (DMSO) ile hazırlandı.15 Pg/mL’lik
seyreltik çözeltileri, 0,5 M Asetat tamponu (pH 4,8) içerisinde hazırlandı.
DNA çözeltilerinin hazırlanıúı :
Buza÷ı timus bezinden elde edilen DNA (=Calf Thymus DNA); çift sarmal DNA
(dsDNA) stok çözeltileri, 1000 Pg/mL konsantrasyonunda TE çözeltisi (10 mM Tris-HCl, 1
mM EDTA,
pH 8,0) ile hazırlandı ve sıfır derecenin altında saklandı. dsDNA’nın seyreltik
çözeltisi, deneyden kısa bir süre önce 0,5 M Asetat tamponu (pH 4,8) ile hazırlandı.
øzlenen çalıúma basamakları :
Kalem grafit elektrodun (PGE) hazırlanması :
Çalıúmada kullanılan kalem grafit elektrot, Tombo kalem uçlarının 3.0 cm boyutunda
kesilmesiyle hazırlandı (16,26). Elektrokimyasal hücre içerisinde 1.0 cm kalacak úekilde
kalem içerisine yerleútirildi.
Kalem grafit elektrodun (PGE) aktivasyonu:
PGE, 0,05 M ABS içersinde +1,4 V uygulanarak 30 saniye süre ile karıútırılmayan
ortamda aktive edildi.
PGE yüzeyine dsDNA immobilizasyonu:
Yüzeyi aktive edilmiú PGE, asetat tamponu (pH 4,8) içinde hazırlanmıú olan 16 μg/mL
konsantrasyonda dsDNA çözeltisine daldırıldı. 7.5 dakika pasif adsorpsiyon yöntemiyle
elektrot yüzeyine DNA immobilizasyonu (yüzeye tutturulması) gerçekleútirildi.
cis-DDP ile dsDNA ile etkileúimi:
1- Elektrot Yüzeyinde ilaç-DNA etkileúimi:
dsDNA immobilize edilmiú PGE, 15 μg/mL sisplatin çözeltisi içerisinde 15 dakika
süreyle pasif adsorbsiyon yöntemiyle DNA, cis-DDP ile etkileútirildi. Daha sonra, 5 sn süreyle
elektrodun yıkama iúlemi asetat tamponu (pH 4,8) kullanılarak gerçekleútirildi. Voltametrik
ölçüm, üçlü elektrot kullanılarak aúa÷ıda belirtildi÷i úekilde yapıldı.
2- Çözelti fazında ilaç-DNA etkileúimi:
Yüzeyi aktive edilmiú PGE, içinde 16 ppm dsDNA ve 15 ppm cis-DDP (1:1) olacak
úekilde vial içinde karıútırılıp pasif adsorpsiyon yöntemine göre 15 dakika etkileútirildi.
Yıkama iúlemi
asetat tamponu (pH 4,8) ile yapıldı. Voltametrik ölçüm, üçlü elektrot
kullanılarak aúa÷ıda belirtildi÷i úekilde yapıldı.
Ölçüm: +0,2 V ile +1,4 V arasında, 30mV/s tarama hızı ve 50 mV’luk puls genli÷inde
tarama yapılarak asetat tamponu (pH 4,8) içersinde ölçüm gerçekleútirildi. +1,00 V civarında
gözlenen guanin yükseltgenme sinyali, DPV tekni÷i ile ölçülerek, ilaç-DNA etkileúmesi
elektrokimyasal olarak tayin edildi.
7
SONUÇLAR ve TARTIùMA
Elektrot yüzeyine tutturulmuú dsDNA, 15 μg/mL cis-DDP ile 15,30 ve 60 dakika gibi
farklı etkileúim sürelerince elektrot yüzeyinde etkileúimi sonrasında, guanin yükseltgenme
sinyalindeki de÷iúim incelendi. Yapılan bu çalıúmada etkileúim süresi arttıkça, etkileúim
sonrası guanin sinyalindeki azalmanın arttı÷ı
gözlendi. Guanin sinyalinde 15 dakika için
% 17,6; 30 dakika için %13,7 ve 60 dakika için % 36 ‘lık bir azalmanın oldu÷u tespit edildi. En
belirgin azalmanın 60 dakikada oldu÷u saptandı (ùekil 5A-5B).
ùekil 5A. 15, 30 ve 60 dakika gibi farklı sürelerde 15 μg/mL cis-DDP ile dsDNA’nın
elektrot yüzeyindeki etkileúimi sonucu ölçülen guanin sinyallerindeki de÷iúimi gösteren
voltamogramlar: (a) etkileúim öncesi guanin yükseltgenme sinyali, (b) 15 dak, (c) 30 dak, (d)
60 dakika süresince cis-DDP ile etkileúen dsDNA’daki guanin yükseltgenme sinyali.
ùekil 5B. 15, 30 ve 60 dakika gibi farklı sürelerde 15 μg/mL cis-DDP ile dsDNA
etkileúimi sonucu ölçülen guanin sinyallerindeki de÷iúimi gösteren histogram. (a) etkileúim
öncesi guanin yükseltgenme sinyali, (b) 15 dak, (c) 30 dak, (d) 60 dakika süresince cis-DDP
ile etkileúen dsDNA’daki guanin yükseltgenme sinyali.
8
Çözelti fazında yapılan çalıúmada, dsDNA, 15 μg/mL cis-DDP çözeltisi ile 1:1 oranında
karıútırıldı ve 15,30 ve 60 dakika gibi farklı sürelerde etkileútirildi. Etkileúim sonucunda
guanin yükseltgenme sinyalindeki de÷iúim incelendi. Etkileúim sonrası guanin yükseltgenme
sinyalinde belirgin bir artıúın oldu÷u ve etkileúim süresi arttıkça guanin sinyalindeki artıúın
giderek arttı÷ı gözlendi. En belirgin artıúın 60 dakikada oldu÷u saptandı (ùekil 6A ve 6B).
cis-DDP’nin dsDNA ile çözelti bazında etkileúimi sonrasında sinyalde gözlenen artıúın,
DNA’nın çift sarmal yapısının bozulup tek sarmal yapısına dönüúmesi sonucunda elde
edilebilece÷i úeklinde yorumlanabilir.
ùekil 6A. 15, 30 ve 60 dakika, sürelerde 15 μg/mL cis-DDP ile dsDNA’nın çözelti
bazında etkileúimine ait voltamogramlar. (a) etkileúim öncesi guanin yükseltgenme sinyali,
(b) 15 dak, (c) 30 dak, (d) 60 dakikadaki etkileúim sonrası guanin yükseltgenme sinyali.
ùekil 6B. 15, 30 ve 60 dakika gibi farklı sürelerde 15 μg/mL cis-DDP ile dsDNA’nın
etkileúimi sonucu ölçülen guanin sinyallerindeki de÷iúimi gösteren histogram: (a) etkileúim
öncesi guanin yükseltgenme sinyali, (b) 15 dak, (c) 30 dak, (d) 60 dakika süresince cis-DDP
ile etkileúen dsDNA’daki guanin yükseltgenme sinyali.
9
Cis-DDP’nin dsDNA ile etkileúmesi sonucunda, guanin yükseltgenme
sinyalindeki
de÷iúim, DPV tekni÷i kullanılarak tek kullanımlık grafit sensör teknolojisi ile elektrokimyasal
olarak tayin edildi.
Pasif adsorpsiyon yöntemi kullanılarak hazırlanan tek kullanımlık DNA sensörü ile
elektrot yüzeyindeki cis-DDP–DNA etkileúim sonrası guanin yükseltgenme sinyalinde azalma
gözlendi ve önceki çalıúmalarımızda elde etti÷imiz sonuçlara benzerlik gösterdi÷i saptandı
(27). Sinyaldeki azalmanın, cis-DDP’nin guanin bazlarına spesifik ba÷lanması sonucunda
elde edilebilece÷i úeklinde yorumlanabilir.
Çözelti fazındaki etkileúim sonrası gözlenen guanin sinyalindeki artıúın ise, cis-DDP ile
dsDNA’nın etkileúimi sonucunda DNA’nın çift sarmal yapısının bozulup tek sarmal yapısına
dönüúmesi sonucunda elde edilebilece÷i úeklinde yorumlanabilir.
ølaç-DNA
etkileúimlerinin
hızlı
ve
seçimli
bir
úekilde
gerçekleútirilebilecek
elektrokimyasal tayini, gelecekte tasarımlanacak yeni bir ilacın, DNA ile etkileúme türünün
saptanmasında önemli rol oynamaktadır.
ølaç-DNA kompleksinin fonksiyonlarının incelenip ve bu fonksiyonel özelliklerin
belirlenmesi, ilaç moleküllerinde hedeflerine göre yapmamız gereken tasarımlar için
önemlidir. Gerçekleútirilen bu çalıúmanın amacı; DNA’ya hedefli yeni bileúiklerin DNA ile
etkileúim türlerinin, elektrokimyasal olarak belirlenmesini sa÷lamak böylece, ilaç-DNA
etkileúim mekanizmalarının kolay, hızlı, daha seçimli ve güvenli bir úekilde tanımlanmasını
sa÷layabilmektir. Ayrıca, tek kullanımlık grafit sensör teknolojisinin kullanımı, antikanser ilaç
olan maddenin az miktarlarında çalıúmayı mümkün kılabilecek, pahalı ajanlar gerektiren ve
zaman alıcı yöntemlere alternatif bir yöntem olmasını sa÷layacaktır.
Sonuç olarak, çalıúmamızda geliútirilen tek kullanımlık grafit sensör teknolojisi ile hem
DNA, hem de çeúitli antikanser ilaçların DNA ile etkileúim ürünlerinin elektrokimyasal tayini,
daha kolay, daha hızlı ve daha güvenilir bir úekilde yapılabilecektir.
TEùEKKÜR
Çalıúmalarımız sırasında bize danıúmanlık yapan Doç. Dr. Kadriye Arzum Erdem
Gürsan’a,
gereksinim duydu÷umuz cihaz ve malzemelerinin kullanımına izin veren Ege
Üniversitesi, Eczacılık Fakültesi’ ne teúekkür ederiz.
10
KAYNAKÇA
1. Wang, J.; Rivas, G.; Cai, X.; Palecek, E.; Nielsen, P.; Shiraishi, H.; Dontha, N.; Luo, D.;
Parrado, C.; Chicharro, M.; Farias, P. A. M.; Valera, F. S.; Grant, D. H.; Ozsoz, M.; Flair, M.
N. Anal. Chim. Acta, 1997, 347, 1.
2. Wang, J.; Cai, X.; Rivas, G.; Shiraishi, H.; Farias, P. A. M.; Dontha, N. Anal. Chem., 1996,
15, 2629.
3. Wang, J.; Rivas, G.; Cai, X.; Dontha, N.; Shiraishi, H.; Luo, Valera, F. S. Anal. Chim. Acta,
1997, 337, 41.
4. Wilson, E. K. Chem. & Engin. News, 1998, 76, 21.
5. Wang, J. Biosensors & Bioelectronics, 1998, 13, 757.
6. Wang, J.; Rivas, G.; Cai, X.; Chicharro, M.; Parrado, C.; Dontha, N.; Begleiter, A.; Mowat,
M.; Palecek, E.; Nielsen, P. E. Anal. Chim Acta, 1997, 344, 111.
7. Karadeniz, H.; Erdem, A.; Caliskan A.; Pereira C. M.; Pereira E. M.; Ribeiro J. A.;
Electrochemistry Communications, 2007, 9, 2167.
8. Wang, J.; Rivas, G.; Fernandes, J. R.; Paz, J. L. L.; Jiang, M.; Waymire, R. Anal. Chim.
Acta, 1998, 375, 197.
9. Mikkelsen, S. R. Electroanalysis, 1996, 1, 8.
10. Millan, K. M.; Saraullo, A.; Mikkelsen, S. R. Anal. Chem., 1994, 66, 2943.
11. Erdem, A.; Kerman, K.; Meric, B; Akarca, U. S.; Ozsoz, M. Electroanalysis, 1999, 11,
586.
12. Erdem, A.; Meric, B.; Kerman, K.; Dalbasti, T.; Ozsoz, M. Electroanalysis, 2001, 13, 219.
13. Erdem, A.; Kerman, K.; Meric, B; Akarca, U. S.; Ozsoz, M., Anal. Chim. Acta, 2000, 422,
139.
14. Karadeniz, H.; Alparslan, L.; Erdem, A.; Karasulu, E. Journal of Pharmaceutical and
Biomedical Analysis, 2007, 45, 322.
15. Coulet, P. R. (1991). What is a Biosensor?, Chapter 1; Biosensor principles and
applications, Editörler; L.J.Blum, P.R. Coulet, Marcel Dekker Inc., New York, 1-6
16. Wang, J.; Kawde, A.-N.; Erdem, A.; Salazar M. A.; Analyst, 2001, 126, 2020.
17. Wang, J. Nucl. Acids Res., 2000, 28, 3011.
18. Palecek, E.; Fojta, M. Anal. Chem., 2001, 73, 75A.
19. Erdem, A.; Ozsoz, M. Anal. Chim. Acta, 2001, 437, 107.
20. Erdem, A.; Ozsoz, M. Turkish Journal of Chemistry, 2001, 25, 469.
21. Jelen, F.; Erdem, A.; Palecek, E. Bioelectrochemistry, 2002, 55, 165.
11
22. Karadeniz, H.; Gulmez, B.; Sahinci, F.; Erdem, A.; Kaya, I.G.; Unver, N.; Kivcak, B.;
Ozsoz, M. Journal of Pharmaceutical and Biomedical Analysis, 2003, 33, 295.
23. Querioz, M.R.P.; Castanheira, E.M.S.; Carvalho, M.S.D.; Abreu, A.S.; Ferreira, P.M.T.;
Karadeniz, H.; Erdem, A. Tetrahedron, 2008, 2, 382.
24. Erdem, A.; Ozsoz, M. Electroanalysis, 2002, 14, 965.
25. Wong, E.; Giandomenico, C.M. Chem. Rev., 1999, 99, 2451.
26. Ozsoz M., Erdem A., Kara P., Kerman K., Ozkan D. (2002). Electroanalysis, 15: 613-619.
27. Erdem, A.; Kosmider, B.; Osiecka, R.; Zyner, E.; Ochocki, J.; Ozsoz, M. Journal of
Pharmaceutical and Biomedical Analysis, 2005, 38 (4), 645.
12