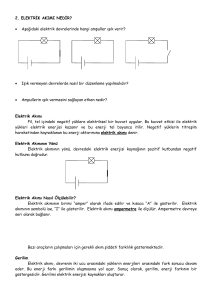
Ch 20 ELEKTROKİMYA:
Elektrik ve kimyasal reaksiyonlar arasındaki
bağlantı araştırması
Elektrokimyasal reaksiyonlarda elektronlar
bir türden diğerine aktarılırlar.
Öğrenme amaçları ve temel beceriler:
oksidasyon,indirgeme , kimyasal dengede yükseltgen ve indirgenbelirleme
Yarım reaksiyon metodunu kullanarak redoks eşitliğini tamamlama ve dengeleme.
Bir elektrik hücresi taslağı oluşturmak ve bu hücrenin katotu ve
anotunuelectronların ve iyonların yönlerini belirlemek.
Standart indirgeme potansiyelinden Eo standart
emfs (hücre potansiyeli) hesaplamak.
cell
Redoks reaksiyonun kendiliğinden oluşup oluşmadığını tahmin etmek için indirgeme potansiyelini kullanmak.
o
ve denge sabiti ile ilişkilendirmek
Eo denGcell
Standart olmayan şartlar altında emf hesaplamak.
Elektrolitik hücrelerdeki reaksiyonları tanımlamak.
Ürünlerin miktarı ve redoks reaksiyonlarıdaki elektrik şarjına elektrik tepkimesi ile ilişkilendirmek
Redoks Reaksiyonlarını Değerlendirme:
Oksidasyon numaralarına değer verme
Hangi türlerin
elektronları
kaybettiği ve
hangilerinin
oluşturduğunu
takip etmek için
oksidasyon
numaralarına
değer veririz.
1
Oksidasyon Numaralarına
Değer Verme
Oksidasyon numaraları nasıl belirlenir?
1. saf durumdaki her atom ox. # = 0.
Zn
O2
O3
I2
S8
P4
2. Basit iyonlar da ox. # = iyonlardaki yük
-1for Cl+2 forMg2+
3.F’nin ox. # her zaman -1 diğer element
lerle birlikte
FeF3
PF5
SF6
OF2
Oksidasyon Numaralarına
Değer Verme
4. ox. # of O normalde -2 (oksidasyon
numarası -1 olan perokside iyonların dışında
ve ox. # of H is +1 (metallerin dışında).
O is -2inNO
H is +1 inCH4
O is -1in Na2O2
H is -1 inCaH2
5. Oksidasyon numaralarının cebirsel toplamı
Bir bileşen için = 0
= Bir iyon için toplam
2
ÖRNEKLER
Her bir element için oksidasyon numarasına
değer verme: SiBr4
K3PO4
Cu(NO3)3
Redoks Reaksiyonları
ELEKTRON AKTARIMI : Elektron veren ve alan
elektronlar arasında elektron aktarımı olur.
Aktarım sonucunda:
1. Oksidasyon numarası artarsa =OKSİDASYON
2. Oksidasyon numarası azalırsa= YÜKSELTGEN
madde ya da oksidant: oksidasyona sebep olur.
3. İndirgeyici madde ya da indirgeyici hücre:
indirgemeye sebep olur.
3
Örnekler
Oksidasyona ve indirgemeye maruz kalan
türleri işaretleyin.Ayrıca yükseltgen madde ve
indirgeyici maddeyi belirleyin.
Cu
(s)
+ 2 AgNO3 (aq) → Cu(NO3)2 (aq) + 2 Ag(s)
Örnekler
Oksidasyona ve indirgemeye maruz kalan
türleri işaretleyin. Ayrıca yükseltgen madde ve
indirgeyici maddeyi belirleyin.
Reduction
Oxidation
Cu
(s)
0
+ 2 AgNO3 (aq) → Cu(NO3)2 (aq) + 2 Ag(s)
+1+5-2
+2+5-2
0
(Yükseltgen madde) Oxidizingagent: Agin AgNO3;
(indirgeyici madde) Reducingagent: Cu
4
Elektron aktarım
reaksiyonları
Temel nitelikler:
• Oksidasyona uğramış bir reaktant(tepkimeye giren madde)
• İndirgenmiş bir reaktant
• indirgenmiş yükseltgen madde
• oksidize edilmiş indirgen madde
• Bir elementin ox # değeri artarsa o
element oksitlenir ;ox # değeri azalırsa
indirgenir.
• Oksidasyon ve indrigeme eşit olmalıdır.
Tüm redoks reaksiyonları kütle ve yükleri
dengeli eşit olmalıdır.
Yarı reaksiyon metodu ile denkleştirme
adımları
1. Oksidasyon haline değer verme.
2. Denklemi iki yarım reaksiyona bölme.
3. Her bir yarım reaksiyonu aşağıdaki gibi eşitleme:
a. O ve H dışındaki elementleri eşitleme
b. H2O’ya O ekleyerek eşitleme
c. H’ye H+ekleyerek eşitleme
d. Yüke e- ekleyerek eşitleme
Daha pozitif taraf için
4. e- indirgenmiş = e-yükseltilmiş gibi faktörlerle artırma
5. Ekleme ve erteleme (kütle kontrol & yük kontrol).
6. Eğer bazik çözelti ise nötrleştirmek için OH ekleme.
5
Yarı reaksiyonları kullanarak redoks
eşitleme:
Cu
(s)
+ AgNO3 (aq) → Cu(NO3)2 (aq) + Ag(s)
Eşitlenmemiş reaksiyon üzerinde, izleyici iyon(NO3-)
tam eşitlik için önemli değildir. Bu yüzden net
eşitliği şu şekilde yazabiliriz.
Cu
(s)
+ Ag+ (aq) → Cu2+ (aq) + Ag(s)
Yarı reaksiyonları kullanarak redoks
eşitleme:
Cu
(s)
+ Ag+ (aq) → Cu2+ (aq) + Ag(s)
Reaksiyonlar iki’ye ayrılır: Oksidasyonlu taraf ve
indirgenmiş taraf.
Cu
(s)
→ Cu2+ (aq) + 2 e-
Ag+ (aq) + e- → Ag(s)
6
Redoks reaksiyonları eşitleme:
Yarı reaksiyonları kullanma
Tam redoks reaksiyonu yapmak için kütle ve yük
eşitleme
Cu (s) → Cu2+ (aq) + 2 e2 Ag+ (aq) + 2 e- → 2 Ag(s)
Cu
(s)
+ 2 Ag+ (aq) → Cu2+ (aq) + 2 Ag(s)
Bazen H2O ve H+ ya da OH- eklemek gerekebilir.
Yarı Reaksiyon Yöntemi
Örnekleri
MnO4− and C2O42− arasındaki reaksiyonu düşünmek:
MnO4− (aq) + C2O42− (aq) Mn2+ (aq) + CO2 (g)
İlk olarak oksidasyon numaralarına değer veriyoruz.
+7
+3
+2
+4
MnO4− + C2O42- Mn2+ +CO2
Manganez +7 den +2’ye düştüğü için
indirgenmiştir.Karbon +3’den +4’e yükseldiği için
oksitlenmiştir.
7
Yarı Reaksiyon Oksitlenmesi
C2O42− CO2
Karbonu eşitlemek için 2 katsayısını ekliyoruz:
C2O42− 2 CO2
Oksijen de şimdi eşitlenir. Yükü eşitlemek için
sağ tarafa 2 eklemeliyiz.
C2O42− 2 CO2 + 2 e−
Yarı Reaksiyon İndirgemesi
MnO4− Mn2+
Manganez eşitlenmiştir. Oksijeni dengelemek için sağ
tarafa 4 su eklemeliyiz.
MnO4− Mn2+ + 4 H2O
Hidrojeni eşitlemek için sol tarafa 8 H+ eklemeliyiz.
8 H+ + MnO4− Mn2+ + 4H2O
Yükü eşitlemek için sol tarafa 5 e− eklemeliyiz.
5 e− + 8 H+ + MnO4− Mn2+ + 4 H2O
8
Yarı Reaksiyon Birleştirme
Şimdi iki yarı reaksiyonun birlikte sayısal değerini
bulalım.
C2O42− 2 CO2 + 2 e−
5 e− + 8 H+ + MnO4− Mn2+ + 4H2O
Her bir tarafta aynı numaralı elektronlar elde etmek
için ilk reaksiyonu 5 ile ikinci reaksiyonu 2 ile
artıralım.
5 C2O42− 10 CO2 + 10e−
10 e− + 16 H+ + 2 MnO4− 2 Mn2+ + 8 H2O
Eklediğimizde:
10 e− + 16 H+ + 2 MnO4− + 5 C2O42−
2 Mn2+ + 8 H2O + 10 CO2 +10e−
16 H+ + 2 MnO4− + 5 C2O42−
2 Mn2+ + 8 H2O + 10 CO2
ÖRNEK
İyodür,iyodin ve manganez (IV)oksitine
dönüşebilmek için permanganat iyonlarıyla
birlikte hareket eder.Eğer reaksiyon asidik
çözeltide meydana gelirse, eşitlenmiş net
iyonik eşitliği yazın.
6 I- (aq) + 2 MnO4- (aq) + 8 H+ (aq)
3 I2 (aq) + 2 MnO2 (aq) + 4 H2O
(l)
9
ÖRNEK
Bir önceki örneği bazik çözeltide yapın.
İyodid, iyodin ve manganez (IV)oksitine
dönüşebilmek için permanganat iyonlarıyla
birlikte tepkimeye girecektir.
Eğer reaksiyon bazik çözeltide ise asitin
içinde olmuş gibi eşitlenebilir.
Eşitleme dengelendiğinde H+ nötrleştirmek için
her bir tarafa OH− eklenir ve su oluşturulur.
Eğer her iki tarafta da su oluşursa, suyu her iki
taraftan da çıkartmak gerekebilir.
2 Elektrik Hücre Çeşidi
Volta/ Galvanik Pil
Kendiliğinden oluşan kimyasal
reaksiyon elektrik enerjisi üretir.
Elektrolitik Pil
Elektrik enerjisi kendinden
oluşmayan kimyasal bir reak siyon
için kullanılır.
10
Volta Pili
•Kendiliğinden
gelişen redoks
reaksiyonlarda
elektronlar aktarılır
ve enerji serbest
kalır.
•Eğer elektronları
bir dış aygıta doğru
aktarabilirsek, bu
enerjiyi
kullanabiliriz.
Volta Pilleri
Yükseltgenme anotta meydana gelir.
İndirgenme katotta meydana gelir.
11
Volta Pillerinin Tanımı
Elektronlar anottan
katota doğru
hareket
ettiklerinde, deney
kaplarındaki yükler
eşitlenmez ve
elektronların
aktarımı durur.
Volta Pilleri
Bu yüzden yükleri
dengede tutmak
için genellikle U
şeklideki tüpte tuz
çözeltisi içeren bir
tuz köprüsü
kullanırız.
Katyonlar katota
doğru hareket
ederler.
Anyonlar anota
doğru hareket
ederler.
12
Volta Pilleri
•Hücrede elektronlar
anottan ayrılır ve telden
katota doğru hareket
eder.
•Elektronlar anottan
ayrıldıkları için anot
bölümündeki katyonlar
çözeltide dağılırlar.
•Elektronlar katota
ulaştıklarında katottaki
katyonlar negatif katota
çekilirler.
•Elektronlar katyonlar
tarafından tutulur ve nötr
metal katota uzatılır.
anode
(oxidation)
cathode
(reduction)
Zn(s) |Zn2+(aq)
||
Cu2+ (aq) | Cu(s)
Elektromotor Kuvveti (emf)
Şelalede su
kendiliğinden tek
bir yoldan akar.
Bunun gibielektronlar
kendiliğinden
sadece redoks
reaksiyonlarda—
yüksekten düşüğe
doğru olan potansiyel
enerjilerde tek
yoldan hareket
eder.
13
Elektromotor Kuvveti (emf)
Bir hücredeki anot ve katot arasındaki
potansiyel farka elektromotor kuvveti
(emf)denir.
Ayrıcapil potansiyeli(Ecell) olarak da
adlandırılır.Pil potansiyeli voltla (V)
ölçülür ve genellikle pil voltajı denir.
1V=1
J
C
Standart Pil Potansiyeli
Standart koşullardaki pil potansiyeli şu
eşitlemeyle bulunabilir:
Ecell=Ered
(cathode)−Ered(anode)
Pil
potansiyeli
her
bir
yükün
potansiyel enerjisine dayandığından,
yoğun bir güce sahip olur.
14
Standart Hidrojen Elektrotu
2 H+ (aq, 1M) + 2 e− H2 (g, 1
atm)
Tanımlamalarda hidrojen için redoks potansiyeli 0 V:
SHE KULLANIMI
15
Pil Potansiyeli
Bu pildeki yükseltgen için,
Ered = −0.76V
İndirgen için,
Ered=+0.34V
(cathode)− E
(anode)
Ecell =Ered
red
= +0.34 V − (−0.76 V) = +1.10 V
Standart İndirgenme Potansiyeli
-0.73
Cr3+(aq) + 3e- Cr(s)
16
Standart İndirgenme Potansiyeli
Yükseltgen ve İndirgen Maddeler
İkisi arasındaki fark ne
kadar güçlü olursa
pilin voltajı da o kadar
güçlü olur.
E°cell> 0
üretim olur
E°cell< 0
tepkime olur
17
Standart İndirgenme Potansiyeli
1. Tüm potansiyeller indirgenme içindir.
2. E°ne kadar pozitif olursa, oksitlenme kapasitesi de o kadar iyi olur.
3. E°ne kadar negatif olursa, yükseltgen reaksiyonu
da o kadar tersine döner.
4. Reaksiyon tersine dönerse, göstergeler değişir.
5. NW-SE Kuralı: Sol taraf yüksek sağ taraf düşük
reaksiyon üretime sebep olur.
6.Yarı reaksiyon potansiyeli SHE (H2 (g, 1 bar)/H+ (aq, 1M)
standartpil)’in referansındadır.
7. Potansiyeller tepken ve üretimlerin doğasına bağlıdır,
miktarlarına değil.
ÖRNEK
Voltaik pil çizin, voltaik pili tanımlamak için pil
işaretini kullanın ve kadmiyum ve gümüş elektrotu
içeren pil için standart EMF hesaplayın.
Ag+ (aq) + e- → Ag(s)
E° = +0.799V
Cd2+ (aq) + 2 e- →Cd(s)
E° = -0.40V
18
Serbest Enerji
Redoks reaksiyon için:G
G = −nFE
Normal şartlar altında,
G= −nFE
n olduğu yere elektronların molekül
numaraları aktarılır ve F Faraday’ın
sabitidir.
1 F = 96,485 C/mol = 96,485 J/V-mol
ÖRNEK
G° için hesaplayın
2 Cr(s) + 3 Pb2+(aq) 2 Cr3+(aq) + 3Pb(s)
Appendix E’den ve ek kaynak
Cr3+ (aq) + 3 e- →Cr(s)
Pb2+ (aq) + 2 e- →Pb(s)
E° = -0.73V
E° = -0.126V
19
Nernst Denklemi
G = G+ RT lnQ
Bu şu anlama gelir
−nFE= −nFE+ RT lnQ
Her iki tarafı da –nF’ a bölerek
Nernst denklemi kurarız:
E = E−
RT
nF
lnQ
Nernst Denklemi:
Standart olmayan koşullarda pil potansiyeli
E = E−
E = E−
RT
lnQ
nF
2.303 RT logQ
nF
at 25 °C
E = E−
0.0592
n
logQ
20
Örnek
25 °C’de sonraki pil için emf hesaplayın.
Cr(s) | Cr3+ (aq,1.00M)
||
Pb2+ (aq, 0.010 M) | Pb(s)
ÖRNEK
25 C’de oluşan reaksiyon için emf hesaplayın.
4 Fe2+(aq) + O2(g) + 4H+(aq) → 4 Fe3+(aq) + 2H2O(l)
a)
Standart koşullar altında
b)[Fe2+]=1.3M,[Fe3+]=0.010M,PO2=0.50atm
olduğunda ve katot yarı göze Ph 3.50’dir.
21
Konsantrasyon Pilleri
Her iki elektrotta aynı madde ile bir pil
oluşturulabilir.
• E°cell 0 olabilir, but Q olmaz.
• Konsantrasyon farklı olduğu sürece E 0
olmayacaktır.
Uygulamalar
22
Hidrojen Yakıt Pilleri
Hidrojen Yakıt Pili
H2 metaliemer ya da metal alaşım yapar.
23
ÖRNEK
Suyu hidrojen ve oksijen gazına ayırmak için gerekli
olan voltajın miktarını belirlemek.
2 H2O
(g)
(l)
+ 2 e- H2 (g) + 2OH-(aq)
+ 2 H2O
(l)
+ 4 e- 4OH-(aq)
E°red=-0.8277VO2
E°red= +0.40V
Aşınma
24
Aşınmayı Önleme
Aşınmayı Önleme
25
Elektrolitik Piller
inertelectrode
inertelectrode
Elektroliz Stokiyometrisi
(Tam Oranlı Ölçümü)
2 mol e-: 1 mol Cu
1 A = 1 C/s
Current(C/s) ×
time(s) =
charge(C)
96,485 C
F
mole e-
26
voltaik/galvanikpil:
(kendiliğinden)
+
katot
anot
Elektrolitikpil:
(kendiliğinden
Olmayan)
+
anot
katot
27