Madde, atom adı verilen taneciklerden oluşur.Atom
maddenin yapı taşıdır.
Atomun yapısında proton, nötron ve elektron bulunur.
Proton ve nötron atomun çekirdeğinde yer alır. Elektron
ise çekirdek etrafında dolanır.
Atomu oluşturan tanecikler belli başlı özellikleri vardır.
Proton: Atomun çekirdeğinde bulunur. (+) yüklü bir
parçacıktır. Kütlesi 1 akb’dir.
Nötron: Atomun çekirdeğinde bulunur. Kütlesi hemen
hemen protona eşittir. Elektrik yükü taşımaz.Yani
yüksüz bir parçacıktır.
Elektron: Atomun çevresinde çok büyük hızla dönen
hareketli bir parçacıktır. Elektronlar çekirdek etrafında
farklı enerji seviyelerinde dolanır.
Atom çekirdeğinin çapı, atom çapının 100 binde biri
kadardır. Atom çekirdeğinde yüklü olarak sadece
protonlar bulunduğu için, atomun çekirdek yükü daima
(+) artıdır.
1 Karbon atomunun kütlesinin 1/12’sine, 1 atomik kütle
birimi adı verilmiştir. Atomik kütle birimi akb ile
gösterilir.
1 Karbon atomu = 12 akb’dir.
Kimyasal hesaplamalarda atomların kütleleri gram
cinsinden değil, akb cinsinden alınır.
Atom numarası: Bir element atomunun çekirdeğinde
bulunan proton sayılarının toplamına, atom numarası
adı verilir. Atom numarası Z ile gösterilir.Z =
Kütlenumarası: Bir atomun çekirdeğindeki proton ve
nötron sayılarının toplamı, o atomun kütle numarasını
verir. Kütle numarası A ile gösterilir.
Kütle numarası = Proton sayısı + Nötron sayısı
A=p+n
Nötr ve Yüklü Atom: Bir atomdaki proton ve elektron
sayıları birbirine eşitse
bu atoma nötr atom denir. Nötr atomda (+) ve (–)
yükler birbirine eşittir.
Örneğin nötr karbon atomunda 6 proton 6 elektron
vardır. Nötr atomda,
p = e’dir.
Atomlar elektron alıp verebilirler. Ancak çekirdekte
bulunan proton ve nötronu alıp veremezler.
ÖRNEK: Nötr bir magnezyum atomunda proton sayısı
12, nötron sayısı 13’tür.
Bu atomun;
a. Elektron sayısı nedir?
b. Kütle numarası nedir?
Çözüm
a. Nötr atomda elektron ve proton sayısı birbirine
eşittir. O hâlde, p = e = 12 dir.
b. Kütle no = A = p + n
p = 12, n = 13 olduğuna göre, A = 12 + 13 = 25
(–) yüklü atomEğer bir atom dışarıdan elektron alırsa
(–) yük sayısı (+) yük sayısından
fazla olur. Bu durumda atom (–) yüklü olur.
Örneğin nötr flüor atomunun 9 elektronu, 9 protonu
vardır.
Flüor atomu 1e– alınca 10 elektronlu ve (–) yüklü olur.
(+) yüklü atom
Eğer bir atom bir elektronunu kaybederse, (+)
yük sayısı (–) yük sayısından fazla olur. Bu durumda
atom (+) yüklü olur.
Örneğin nötr lityum atomunun 3 protonu 3 elektronu
vardır. Lityum 1e– verirse 2 elektronlu ve (+)
yüklü olur.
Elementlerin Sembollerle Gösterilmesi
Kimyasal hesaplamalarda maddelerin Lâtince isimleriyle
işlem yapmak zordur. Bunun yerine elementlerin
Lâtince isimlerinin kısaltmalarından oluşan semboller
kullanılır.
Element sembollerinde ilk harf her zaman büyük, varsa
diğerleri daima küçük yazılır.
Örneğin;
Hidrojen H, Helyum He, Karbon C
Kalsiyum Ca, Bor B, Berilyum Be
Element sembolünün sol üst köşesine atomun kütle
numarası, sol alt köşesine ise atom numarası yazılır.
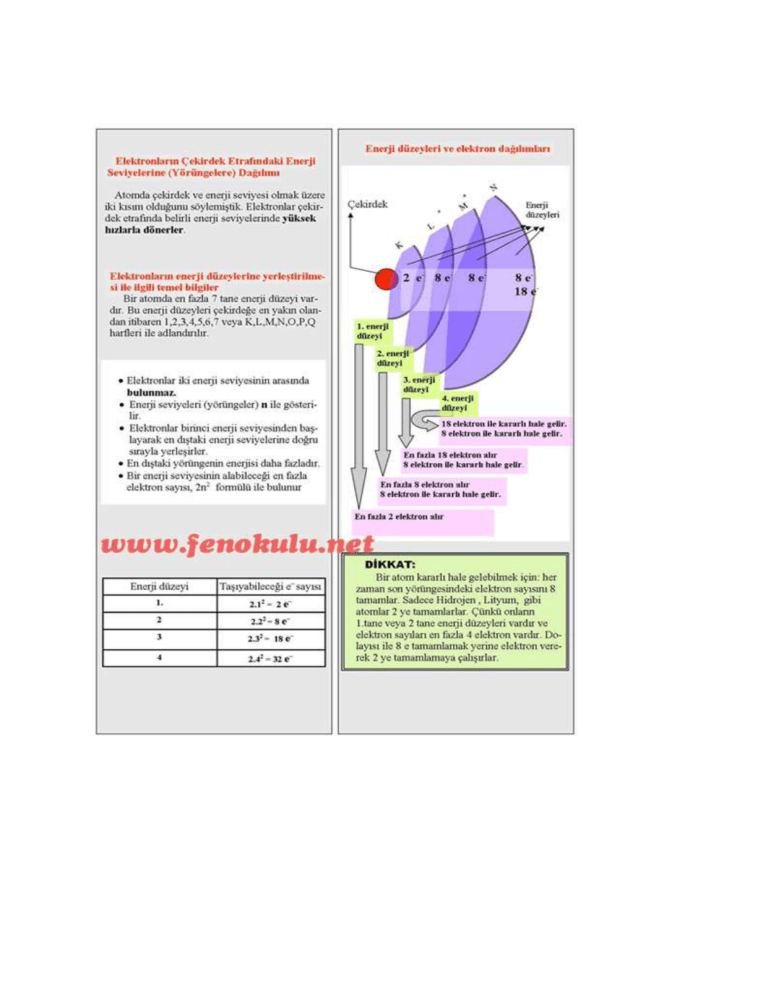
Elektron Dağılımı
Elektronlar çekirdek çevresinde belli enerji seviyelerinde
ve belli sayılarda dolanır. Enerji seviyeleri çekirdekte
dışa doğru, 1. seviye, 2. seviye, 3. seviye şeklinde
sıralanır. Bazen enerji seviyeleri, K, L,M, N... harfleriyle
de gösterilir.
1. seviyede en fazla 2 elektron bulunur.
2. seviyede en fazla 8 elektron bulunur.
Bir enerji seviyesinde bulunabilecek en fazla elektron
sayısı, 2 n2 bağıntısı ile hesaplanır. (n, enerji seviyesini
gösterir.)
Atomun en dış enerji seviyesinde en fazla 8 elektron
bulunabilir. En dış enerji seviyesinde 8 elektron
bulunduran elementlere soy gazlar ya da asal gazlar adı
verilir. Bunun tek istisnası helyumdur. Helyum elementi
soy gaz olduğu hâlde 2 elektronu vardır.
Örnek:
İlk iki enerji seviyesi dolu olan bir atomun toplam
elektron sayısı nedir?
Örnek:
Atom numarası 13 olan nötr bir atomun elektron
dağılımı nasıl olur?
Örnek:
18X atomunun elektron dağılımı nasıldır?
Örnek: Üçüncü enerji seviyesinde 2 elektron bulunan
bir atomun atom numarası kaçtır?
A)6 B)10 C) 12 D) 26












