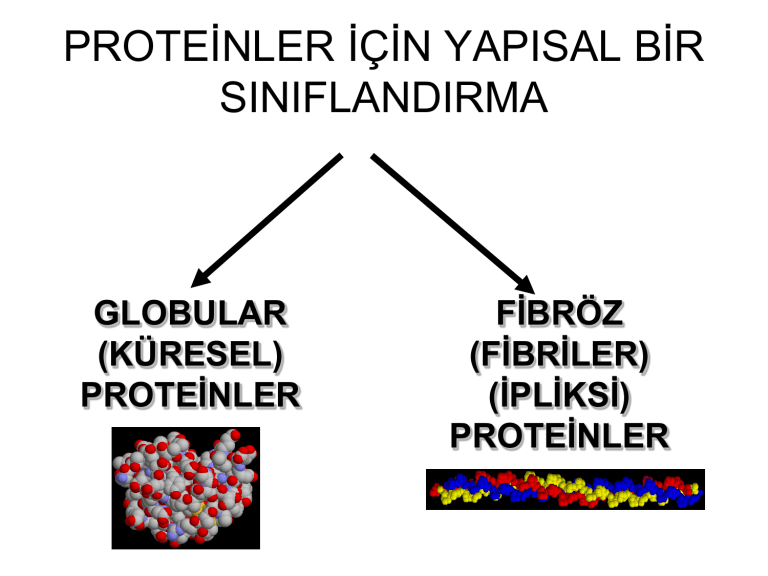
PROTEĠNLER ĠÇĠN YAPISAL BĠR
SINIFLANDIRMA
GLOBULAR
(KÜRESEL)
PROTEĠNLER
FĠBRÖZ
(FĠBRĠLER)
(ĠPLĠKSĠ)
PROTEĠNLER
ĠPLĠKSĠ (FĠBRÖZ)
PROTEĠNLER
• Lifli ve uzunlamasına yapılar oluĢtururlar.
• Çoğu hayvansal hücrelerde YAPISAL
ROLLER üstlenir.
• Deri, bağ doku, saç, kıl, boynuz ve ipek gibi lifli
yapıların ana bileĢenidirler.
BAZI ĠPLĠKSĠ PROTEĠNLERĠN AMĠNO ASĠT BĠLEġĠMĠ
Sağlamlık kazandırır.
Polisakkaritler için tutunma yeri
KERATĠNLER
• Amino asit dizileri ve biyolojik iĢlevleri
birbirine benzeyen iki önemli protein
grubu:
-keratinler
Saç, tırnak ve derinin ana bileĢeni
Ara filament proteinler denilen geniĢ bir
ailenin üyesidirler.
-keratinler
Daha çok -tabaka içerirler. KuĢ
ve sürüngenlerin tüy ve kabuklarında bulunurlar.
Saçtaki -keratinin
yapısı
Proposed structure for keratin-type intermediate filaments.
Her bir zincir -sarmal
yapısındadır ve 300’ün
üzerinde amino asit
içerir.
Bir monomer çifti (a)
paralel konumda
birbirlerine dolanarak 50
nm uzunluğunda dimerik
bir yapı olan sarımlı
sarmalı (b) oluĢtururlar.
Çok sayıda dimer
birbirleriyle etkileĢerek
protofilamenti (c) ve
sonra da protofibrili (d)
ortaya koyarlar.
Bu tip sağlam bir yapı bazı dokularda
disülfit çapraz bağlarıyla daha da
dayanıklı hale gelir.
Tırnaktaki -keratin saçtaki -keratine göre
çok daha fazla sayıda bu tip çapraz bağ
içerir.
Perma:
Bu iĢlem keratindeki
disülfit bağlarının
indirgenmesi,
yeniden
Ģekillendirme ve
yeni Ģeklin
sabitlenmesi
iĢlemlerini
kapsar.
ĠPEK PROTEĠNĠ FĠBRONĠNĠN YAPISI
FĠBROĠN
ĠPEKBÖCEĞĠ KOZASINDA ve
ÖRÜMCEKLERĠN AĞINDA
BULUNAN PROTEĠN
Çok sayıda antiparalel -tabaka içerir.
Üç boyutlu yapı
kesidi. Bu bölgede
sadece alanin ve
glisin kalıntıları
görülmekte.
Alanin veya serin yan zincirleri ile
glisin yan zincirlerinin etkileĢimi
(üstten görünüĢ)
FĠBROĠNĠN TAMAMI -TABAKA
YAPISINDA DEĞĠLDĠR.
• Ġpliksi proteinlerin amino asit bileĢimini
gösteren tabloda gördüğümüz gibi, fibroin
valin ve tirozin gibi -tabakaya uymayacak
amino asitler de içerir. Bu amino asitler
nedeniyle de -tabakaları arasında yer yer
tıkız bir Ģekilde katlanmıĢ bölgeler yer alır.
Böyle bir yapı fibroine oldukça esnek bir
yapı kazandırır.
KOLLAJEN
Ġnsan da dahil omurgalıların
büyük bir kısmında en bol
bulunan proteindir. Bazı
hayvanlarda total protein
kitlesinin ~1/3’ini oluĢturur.
•Kemiklerde minerallerin
üzerinde çöktüğü matriks
materyalini oluĢturur.
•Tendonların ana bileĢenidir.
•Derinin önemli bir elemanıdır.
Kısacası, pek çok hayvanın
bütünlüğünden bu molekül
sorumludur, diyebiliriz.
YAPISAL BĠRĠM: TROPOKOLLAJEN
Kollajenin Yapısı
• Temel yapısal birim, her biri ~ 1000 amino
asit kalıntısı uzunluğundaki üç polipeptit
zincirininin birbirine sarılmasıyla oluĢan
üçlü sarmal yapıdaki TROPOKOLLAJEN
molekülüdür.
• Tropokollajendeki her bir zincir sola
dönümlü olup, her bir dönümde yaklaĢık
3.3 amino asit yer alır.
Yapının böyle olmasının en önemli
iki nedeni:
• Böyle bir yapıda her 3 kalıntıda bir GLĠSĠN
amino asidi bulunur. Çünkü sadece bu
amino asidin yan zinciri bu yapı içerisinde
yer alacak kadar küçüktür.
• Üçlü sarmal kıvrıma uygun, bu oluĢumu
kolaylaĢtıran bir baĢka özellik de her bir
zincirde yer alan PROLĠN ve
HĠDROKSĠPROLĠN kalıntılarıdır.
Zincirlerde belli dizilerin sık sık
tekrarlandığı görülür:
Gly-X-Y
X= genelde PROLĠN
Y= PROLĠN veya HĠDROKSĠPROLĠN
(X ve Y’de yer yer baĢka amino asitler de
bulunabilir. Ancak yukarıdaki yapılanma
özgün yapının oluĢumundan sorumludur.
Prolin kalıntılarının sıradıĢı bir
Ģekilde hidroksile olmasının
avantajı:
• Üçlü sarmalı oluĢturan ana bağ tipi
omurgadaki amit protonları ile karbonil
oksijenleri arasındaki H bağlarıdır. Ancak
hidroksiprolindeki OH grupları ek bağların
kurulmasına katkıda bulunarak bu yapıyı
daha da sağlamlaĢtırır.
Kollajendeki lizin kalıntılarının da
bir kısmı hidroksile durumdadır.
Bu modifikasyonun rolü:
• Lizindeki OH grupları polisakkaritlerin
tutunma noktalarını oluĢturur.
Prolin Hidroksiprolin
dönüĢümü ENZĠMATĠK bir olaydır
ve C vitamini (askorbik asit)
gerektirir.
C vitamininin eksikliği ĠSKORBÜT
denilen bir hastalığa yol açar.
Deride ve diĢetlerinde yaralar
oluĢur, damarlar incelir. DıĢarıdan
vitamin takviyesiyle bu
rahatsızlıklar ortadan kalkar.
Tropokollajen molekülleri
kollajen liflerini oluĢturmak
üzere özgül bir biçimde birlikte
paketlenir:
Kollajenin dayanıklığının bir nedeni de tropokollajen
moleküllerinin, lizin yan zincirlerinin yer aldığı özel bir
reaksiyon aracılığıyla çapraz bağlanmasıdır. Zincir içi ve
zincirler arası gerçekleĢen bu olay enzimatiktir. Bazı lizin
kalıntıları lizil oksidaz enzimi tarafından oksitlenerek aldehit
türevine dönüĢür, bu da baĢka bir lizinle veya diğer bir
molekülle kondensasyon reaksiyonuna girerek çapraz bağlar
oluĢturur.
Bu reaksiyon yaĢam
boyunca sürer. Çapraz
bağlar, kollajen
molekülünün elastikiyetini
kaybetmesine ve daha
kırılgan hale gelmesine yol
açar.
YaĢlanma ile ilgili görsel
belirtilerin büyük bir
kısmı bu çapraz
bağlardan
kaynaklanmaktadır.
Kollajen Sentezi
Tropokollajeni oluĢturan zincirlerin
ribozomda sentezlenen ilk halleri çok
farklıdır.
•1.adım ribozomlarda translasyondur.
•2.adımda polipeptit hidroksillenir.
•3.adımda Ģekerler bağlanır.
•4.adımda prokollajen oluĢturulur.
Prokollajen 1500 kalıntıdan ibarettir. Üç
prokollajen molekülü orta kısımlarından
üçlü sarmal oluĢtururken N- ve C-uçları
kıvrılıp katlanarak küresel yapı kazanır.
•5.adımda prokollajen üçlüleri hücredıĢı
alana salınır.
•6.adımda N- ve C-uçlar spesifik
proteazlar tarafından kesilip atılır.
•7.adımda lizin kalıntıları arasında
çapraz bağlantılar kurularak molekülün
yapısı tamamlanmıĢ olur.
ELASTĠN
Bağ doku ve atardamarlarda daha
elastik bir yapı olması gerekir. ĠĢte
elastin bu yapıları oluĢturan ipliksi
proteindir.
Polipeptit zinciri glisin, alanin, ve valin
bakımından zengindir. Oldukça
elastik bir yapıya sahiptir, çünkü
çapraz bağlı lizin kalıntıları da içerir.
Dört lizin kalıntısı DESMOZĠN
oluĢturmak üzere birleĢir:
KÜRESEL (GLOBULAR)
PROTEĠNLER
Oksijenin taĢınmasında
ve depolanmasında
globinlerin rolü
Hemoglobin ve Miyoglobin
hayvanlarda sırasıyla, oksijen taĢınması ve
depolanmasında görev alan proteinlerdir.
Hayvanlar yaĢamak için hücrelerine oksijen
pompalamak ve metabolizma sonucu oluĢan
artık ürünleri de (ör. CO2) dıĢarı atmak
zorundadırlar. Dokular arasında difüzyon ile
taĢınma hızı yeterince yüksek değildir. Böcekler
hariç tüm hayvanlar kan (atardamarlar) yoluyla
dokulara oksijen taĢır ve CO2’yi yine aynı yolla
(toplardamarlarla) dıĢarı atar. Kanda oksijen
taĢıma görevi, değiĢik canlılarda farklı tipleri
bulunan oksijen taĢıyıcı proteinler tarafından
sağlanır. Bu proteinler ya bazı omurgasızlarda
olduğu gibi kanda çözünmüĢ olarak bulunur, ya
da insan eritrositlerinde olduğu gibi belli
hücrelerde yoğunlaĢır.
Tüm omurgalılarda oksijen taĢıyıcı protein
HEMOGLOBĠN,
oksijen depolayıcı protein MĠYOGLOBĠN’dir. Her
ikisi de küresel proteindir.Ortak yapısal motife
sahiptirler.
Miyoglobin monomerik, hemoglobin oligomerik (tetramerik) proteindir.
MĠYOGLOBĠN
HEMOGLOBĠN
myo- Yunanca’da “kas”
hemo- ise “kan” anlamına gelir.
• Her ikisi de hem grubu içerir, yani bileĢik
proteindir. Oksijeni bağlayan bu grup, protein
kısmına (globin) kovalent olmayan etkileĢimlerle
bağlı durumdadır.
Hem
(Demir protoporfirin)
KIRMIZI RENKTEN DE SORUMLU GRUP!
MĠYOGLOBĠN
• Kas dokusunda bulunur. Oksijen bağlayarak
depo eder. Yoğun kas aktivitesi sırasında
gerekli olan oksijeni mitokondrilere aktarır.
En çok iskelet
bulunur.
ve kalp kasında
•Suda çok derinlere dalan fok ve
balinaların total kas proteininin %8’i
miyoglobindir.
-Sarmal
bölgelerince zengin
tek zincirli bir
polipeptittir.
%80’i 8 adet
-sarmalından
(A-H) oluĢur:
Hem grubu molekülün apolar
özellikteki iç kısmına (F ve E
sarmalları arasındaki cebe)
yerleĢmiĢtir. Bu cep apolar amino
asitlerle çevrilidir. Bunlardan 2 tane
histidin kalıntısının çok özel
fonksiyonları vardır:
PROKSĠMAL HĠSTĠDĠN : Doğrudan
HEM’in demirine bağlıdır.
DĠSTAL HĠSTĠDĠN : HEM ile
doğrudan etkileĢmez. Oksijenin +2
değerlikli demire bağlanmasını
stabilize eder. Böylece Fe+2 çok az
okside olarak oksijenin geri
dönüĢümlü bağlanması sağlanır.
Hemoglobin
kırmızı kan hücrelerinde (eritrositler) yer alan
oksijen taĢıyıcı proteindir. Omurgalıların hemoglobini her biri bir
molekül oksijen bağlayan birer hem grubu içeren ikiĢer alt
birimden (toplam 4 altbirimden) oluĢur. EriĢkin insanlardaki
hemoglobinin büyük bir kısmı
2 2 altbirimi içeren
Hemoglobin A (HbA)’dır. Ayrıca %2 oranında Hemoglobin A2
(HbA2) (2+2delta zinciri içerir) bulunur.
Hamileliğin baĢlangıcında
fetusta ilk olarak ve
zincirlerine benzeyen (zeta)
ve (epsilon) zincirleri
sentezlenir.
GeliĢim süreci içinde
• ’ların yerini
• ’lar yerini
’lar
(gamma)’lar alır.
Böylece Fetal Hemoglobin (HbF) oluĢur. HbF fetal
yaĢamın 2/3’sinde baskındır. Hemoglobinin anne karnından oksijen
alabilecek özellikte olmasını sağlar.
Fetal geliĢim sırasında yavaĢ yavaĢ artan zincirlerinin senteziyle
doğumdan sonraki 6. ayda
• zincirlerinin yerini
’lar alır.
Doğumdan kısa bir süre önce baĢlayan
zincirlerinin senteziyle yetiĢkinlerde %2 oranında
HbA2 oluĢur.
Hemoglobinin altbirimi ile miyoglobin
arasında büyük benzerlik vardır. Amino asit
dizileri farklı olmakla beraber yapılarındaki
bu benzerlik 24 amino asidin ortak
olmasından kaynaklanır. (Buradan farklı
amino asit dizilerinin benzer 3 boyutlu
yapılar ortaya koyduğunu ve benzer iĢlevler
yürüttüğünü görüyoruz.) Bu ortak 24 amino
asit, 3 boyutlu yapının ortaya konulmasında
ve fonksiyonda doğrudan iĢ görmektedir.
Hemoglobindeki alt birimler kendi aralarında
moleküler etkileĢimler kurarlar. Ayrıca bazı
spesifik ve küçük moleküller fonksiyonda
etkili olur. Yapıya bağlanarak aktivasyona
veya inhibisyona yol açarlar. Bu tür iliĢkiler
hemoglobine oksijenin yanısıra CO, CO2 ve
protonları da bağlayarak taĢıma özelliği
kazandırır.
Hemoglobindeki alt birimler
kooperatif etkiyle oksijen
bağlanmasını sağlarlar. Bir
oksijenin bağlanması, ikinci
oksijenin bağlanmasını
kolaylaĢtırır. Bu
kolaylaĢtırıcılık, oksijenin çok
bol bulunduğu akciğerlerde
oksijenin hemoglobine
bağlanmasını ve oksijen
düzeyinin düĢük olduğu
dokularda da oksijenin serbest
kalmasını sağlar. Hemoglobin
dokulardaki karbondioksiti de
akciğerlere taĢıyarak dıĢarı
atılmasını sağlar.
Hemoglobine CO2 bağlanması
Metabolizma sırasında oluĢan CO2’nin çoğu
suyla birleĢerek bikarbonat iyonu oluĢturur.
Ancak bir kısmı hemoglobinin yüksüz amino gruplarına bağlanarak taĢınır:
Hb-NH2 + CO2
HbNHCOO- + H+
3 aylık evli çift şofben kurbanı
Nazif ve Asiye Yarar çifti 3 aylık evliydi. Asiye'nin hamile olduğu haberi genç çifti sevince boğmuştu. Ancak
şofbenden sızan gaz mutluluklarının sonu oldu. 02.12.2002
Şofben değil baca öldürüyor
Üç aylık evli Yarar çiftinin ölümü de "şofbenden ölüm" diye geçti kayıtlara. Oysa
uzmanlar uyarıyor: Şofben değil tıkalı baca öldürür 03.12.2002
Liseli kızlar şofben kurbanı
Balıkesir ve Karabükte biri 14, diğeri 17 yaşındaki iki lise
öğrencisi genç kız şofbenden zehirlenerek can verdi
01.03.2005
Sobalar ocakları yaktı
Önceki gece etkili olan şiddetli lodos yüzünden 149 kişi soba ve şofbenlerden sızan karbonmonoksit gazından
zehirlendi. Bunlardan 5'i tüm müdahalelere rağmen kurtarılamadı.
07.03.2005
Şofben canavarı beni alamadı
09.01.2003
AB standartlarından bahsedilirken "Yıllık şofbenden ölenlerin sayısı" da kıstas olarak alınacak duruma
geldi. Son günlerde sıkça rastlanan şofben faciaları gencecik insanları hayatının baharında sevdiklerinden
çekip almaya devam ediyor. Şofben denen yarı teknolojik canavar beni de almak istedi ama başaramadı.
Bugün sizlere şofbenle nasıl mücadele ettiğimi, nasıl hayatta kaldığımı bir şofben maduru olarak
anlatacağım. Belki birkaç hayat kurtarabilirim. Sene 1976 Fakülte son sınıf öğrencisiyim. Eyüp' te 4 katlı
bir binanın teras katında kalıyorum...
Hemoglobine CO bağlanması
Hemoglobindeki Fe atomuna karbon monoksit (CO)
bağlanırsa:
Karbonmonooksihemoglobin (HbCO) oluĢur.
Dokulara O2 taĢıma yeteneği azalır.
(CO zehirlenmesinin temeli !)
Hemoglobinin CO’ne olan ilgisi O2’ne olan ilgisinden
220 kat fazla! Onun için ortamdaki çok küçük
miktardaki CO bile kanda toksik konsantrasyonda
HbCO oluĢmasına neden olur.
%60’ın üzerinde HbCO ÖLDÜRÜCÜDÜR !!!
CO zehirlenmelerinde O2 tedavisi uygulanır.
AMĠNO ASĠT DĠZĠSĠNDE
MUTASYONEL
DEĞĠġĠMLER
Ele alınan bir (tür) organizmanın içerdiği bir proteinin amino asit dizisi o türün
tüm bireylerinde aynıdır.
Örneğin, Hemoglobin tüm sağlıklı insanlarda aynı amino asit dizisine ve
konformasyona sahiptir.
ANCAK:
Bazen gen düzeyinde oluĢan bir mutasyonla 1 veya 2 amino asitin yerine farklı
amino asitler geçebilir.
NORMAL bireydeki hemoglobin ile ORAK HÜCRELĠ ANEMĠ HASTASI bir
bireydeki hemoglobin arasında sadece tek bir amino asit bakımından farklılık
vardır:
zincirinin 6. amino asidi
Normal bireylerde Glutamik asit
Hasta bireylerde Valin’dir.
Hemoglobin ve miyoglobinin yapısında
gördüğümüz gibi küresel proteinler protein
olmayan bir kısım içerebilirler.
•Alternatif Sınıflandırma
•Basit proteinler
Sadece amino asitlerden oluĢurlar.
•BileĢik proteinler
Protein zincirine ek olarak protein olmayan
organik veya inorganik bir grup (PROSTETĠK
GRUP) içerirler.
–Apoprotein = proteinin prostetik grupsuz Ģekli
–Holoprotein = proteinin prostetik gruplu Ģekli
Prostetik gruba en iyi örneklerden biri miyoglobin ve
hemoglobine yer alan oksijen bağlayan hem (Fe-protoporfirin
IX) grubu verilebilir.
Hem
grubu
Hemoprotein
Binding and release of ligands induces a conformational (structural) change in
hemoglobin. Here, the binding and release of oxygen illustrates the structural
differences between oxy- and deoxyhemoglobin, respectively.
Nükleoprotein kompleksleri
Structure of the Oxytricha nova telomere end binding protein complexed with
single strand DNA. The a subunit is shown in purple and green and the b
subunit is shown in blue. (A) The single strand DNA, shown with black bases,
orange phosphorous atoms, and red phosphate oxygens, binds to a deep cleft
between the N-terminal domain of a and the 28 kDa core domain of b. The 12ntd 5'-GGGGTTTTGGGG-3' DNA also forms a G-quartet linked DNA dimer,
shown with orange bases, which is the focus of another poster (see poster Gquartets in a telomere protein-DNA complex). (B) Detailed view of one proteinDNA contact. The base of nucleotide G10 is stacked between the guanidinium
group of arginine 140 from theb subunit and the phenol group of tyrosine 239
from the a subunit. Additional hydrogen bonds, shown in green, are likely
important for sequence specific recognition of this base.
Glikoprotein
Hücre zarındaki glikoproteinler
Lipoprotein
TG: Trigliserit
CE: Kolesterol esterleri
Metalloprotein
One-third of all proteins are
"metalloproteins", chemical
combinations of protein atoms
(carbon, nitrogen, oxygen, hydrogen,
sulfur) with ions of metals such as
iron, calcium, copper, and zinc.
The rusticyanin copper
binding site shows the copper,
the liganding residues and the
supporting secondary
structural elements. The Type
II b-turn and the 310 helix
may represent a region of
structural rigidity that helps
define and support the
distorted coordination
geometry.
SOD
CuZn bovine
superoxide
dismutase. (a)
Ribbon diagram of
native dimer showing
positions of Cu (blue)
and Zn (orange)
atoms and their
ligands and (b) a
close up of the metal
sites and the bridging
His61.