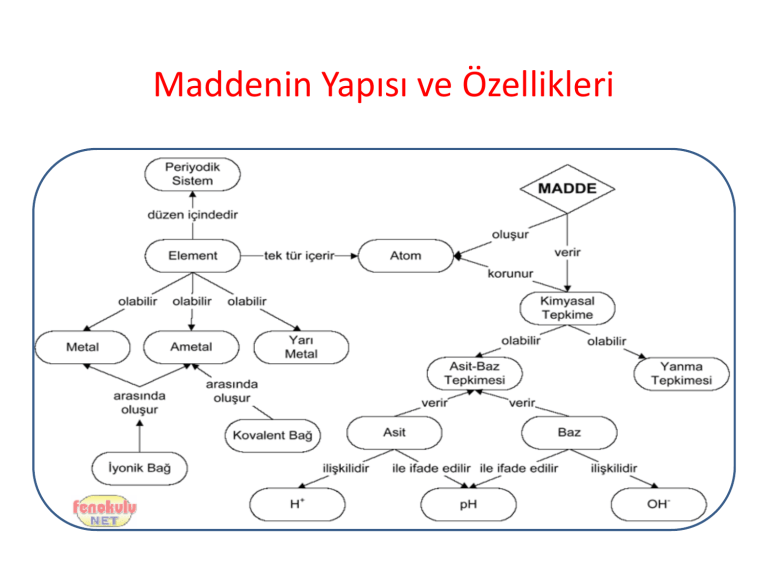
Maddenin Yapısı ve Özellikleri
Madde ve Özellikleri
•
•
•
•
Kütlesi hacmi ve eylemsizliği olan her şeye madde denir.
Maddenin şekil almış haline cisim denir.
Cam bir madde iken cam bardak bir cisimdir.
Maddeler doğada katı sıvı gaz halinde bulunabilir.
Madde ve Özellikleri
Maddenin Ölçülebilir Özellikleri
– Hacim,
– Kütle,
– Ağırlıktır.
Madde ve Özellikleri
Maddenin Görülebilir Özellikleri
–
–
–
–
–
–
Yumuşaklık
Sertlik
Parlaklık
Matlık
Saydamlık
Opaklık
•Düzgünlük
•Pürüzlülük
•Renk
•Koku
•Tat
Madde ve Özellikleri
Maddenin Halleri
– Katı maddeler:taş, demir,bakır,altın vb.
– Sıvı maddeler:su, petrol,mazot, gaz yağı vb.
– Gaz maddeler: su buharı, oksijen, vb.
Madde ve Özellikleri
Maddenin Hal Değiştirmesi
– Erime
– Donma
– Buharlaşma
– Kaynama
– Yoğunlaşma
Madde ve Özellikleri
Maddenin Ortak Özellikleri
– Kütle
– Hacim
– Eylemsizlik
– Elektrikli yapı
Bu Özellikler Madde
Miktarına Göre Değişirler
Madde ve Özellikleri
• Maddenin Ayırt Edici Özellikleri
Maddenin Sınıflandırılması
MADDE
SAF MADDELER
Elementler
Metaller
SAF OLMAYAN MADDELER
Bileşikler
Homojen
Karışımlar
Heterojen
Karışımlar
Süspansiyon
Ametaller
Çözeltiler
Emülsiyon
Soy gazlar
Aerosol
Elementler ve Özellikleri
• ...Aynı.......... cins atomlardan oluşan ve herhangi bir yöntemle
başka maddelere ayrıştırılamayan maddelere element denir.
– Saf maddelerdir.
– .Semboller....... ile gösterilir.
– En küçük yapı taşı, ...atomdur............... .
– Erime ve kaynama noktaları ....sabittir...............
– Fiziksel yada kimyasal yöntemlerle daha basit maddelere
ayrıştırılamazlar.
Elementler ve Özellikleri
•
Metallerin özellikleri:
1. Isı ve elektrik akımını iletirler.
2. Oda sıcaklığında katıdır.(Hg hariç).
3. Yüzeyleri parlaktır.
4. Tel ve levha haline getirilebilirler.
Elementler ve Özellikleri
• Ametallerin Özellikleri
– Elektrik akımını iletmez.
– Oda sıcaklığında üç halde de bulunur.
– Yüzeyleri mattır.
– Kırılgandır. Tel ve levha haline getirilemez.
Elementler ve Özellikleri
• Soygazların Özellikleri
– Kimyasal reaksiyona girme istekleri yok gibidir.
– Hepsi gaz halindedir.
– Tabiatta tek atomlu olarak bulunurlar.
Gruplarda Yukarıdan
Aşağıya Doğru
İnildikçe
Periyotlarda Soldan
Sağa Doğru Gidildikçe
Atom Numarası
Artar
Artar
Atom Hacmi
Artar
Azalır
İyonlaşma Enerjisi
Azalır
Artar
Metalik Özellik
Artar
Azalır
Ametalik Özellik
Azalır
Artar
Atom Nedir?
• Elementlerin tüm özelliğini gösteren en küçük
parçasına atom denir.
• Atom kelimesi Yunanca bölünemez anlamına gelen atomos
kelimesinden gelir.
• Atomlar küre şeklindedir.
Atomun Tarihçesi
• DEMOCRİTUS : Maddenin küçük ve bölünemez parçacıklardan
oluştuğu fikrini ortaya atan ilk kişi, Yunanlı filozof
“Democritus”dur. Democritus’a göre bütün maddeler aynı tür
(özdeş) atomlardan oluşuyordu. Maddelerin farklı
görünmesinin sebebi, atomların farklı şekilde dizilmesiydi.
Atomun Tarihçesi
• JOHN DALTON : İngiliz bilim adamı Dalton’a göre; maddenin
en küçük yapı taşı atomdur. Atomlar bölünemez. Bir maddenin
bütün atomları aynıdır. Farklı maddelerin atomları da farklıdır.
• J.J.THOMSON : Atomun yapısında atomdan daha da küçük
parçacıkların olduğunu keşfetti. Yaptığı çalışmalar sonucunda
atomu, içinde erik parçacıkları bulunan bir pudinge benzetti.
Atomun Tarihçesi
• ERNEST RUTHERFORD : Thomson’un bulduğu küçük
parçacıkların atomun içinde değil atom merkezinin (çekirdek)
etrafında dolaştığını ileri sürdü. Rutherford atom için
geliştirdiği modeli, Güneş’in etrafında dönen gezegenlere
benzetti.
• NİELS BOHR : Danimarkalı bilim adamı Bohr, elektronların
atomun çevresinde belirli yörüngeler izlediğini belirtti.
Atomun Tarihçesi
Modern Atom Modeli:
– Atomda belirli bir enerji düzeyi vardır. Elektron ancak bu
düzeyden birinde bulunabilir .
– Elektron bir enerji düzeyindeki hareketi sırasında çevreye
ışık yaymazlar.
Atomun Tarihçesi
– Atoma iki düzey arasındaki fark kadar enerji verilirse
elektron daha yüksek enerji düzeyine geçer.
– Atoma verilen enerji kesilirse elektron enerjili düzeyinde
kalamaz daha düşük enerji düzeyinden birine geçer. Bu
sırada iki düzey arasındaki fark kadar enerjiyi ışık şekline
çevreye verir.
Atomun Yapısı
• Atomu oluşturan parçacıklar farklı yüklere sahiptir. Atomda
bulunan yükler; negatif yükler ve pozitif yüklerdir.
• Atomu oluşturan parçacıklar:
– Cisimden cisme elektrik yüklerini taşıyan negatif
yüklü elektron,
– Elektronların yükünü dengeleyen aynı sayıda ama pozitif
yüklü olan proton,
– Elektrik yükü taşımayan nötr parçacık nötron.
Atomun Yapısı
Atom iki kısımdan oluşur :
1. Çekirdek (merkez)
2. Katmanlar (yörünge; enerji düzeyi)
– Çekirdek, hacim olarak küçük olmasına karşın, atomun
tüm kütlesini oluşturur. Çekirdekte proton ve nötronlar
bulunur. Elektronlar ise çekirdek çevresindeki katmanlarda
bulunur.
– Elementlerin Çekirdekte bulunan protonlar, atomun ( o
elementin) tüm kimyasal ve fiziksel özelliklerini belirler.
– Proton sayısı atomlar (elementler) için ayırt edici özelliktir.
Atomun Yapısı
• Nötr bir atom için;
– elektron sayısı= proton sayısı
– (Z) Atom numarası= proton sayısı
– Çekirdek yükü= proton sayısı
– İyon yükü= proton sayısı – elektron sayısı
– (A) Kütle numarası= proton + nötron sayısı (Nükleon
sayısı)(atom ağırlığı)
Elektronların Dizilimi
• Elektronlar çekirdek çevresindeki yörüngelerde dönerek
hareket ederler. Çekirdeğe en yakın yörünge 1 olmak üzere
dışa doğru 2, 3,4... olarak yörüngeler numaralandırılır.
Elektronların Dizilimi
• Her katmanda bulunabilecek elektron sayısı bellidir.
1. Yörüngede en çok 2 elektron
2. Yörüngede en çok 8 elektron
3. Yörüngede en çok 18 elektron
4. Yörüngede en çok 32 elektron
5. Yörüngede en çok 32 elektron
6. Yörüngede en çok 18 elektron
7. Yörüngede en çok 8 elektron bulunur.
Kimyasal Bağlar
Atomları birbirine bağlayan ve bir arada kalmalarını sağlayan
kuvvetlere, kimyasal bağlar denir. Kimyasal bağlar, aslında
atomları birbirine çeken elektriksel çekim kuvvetleridir.
Başlıca iki türlüdür:
1. İyonik Bağ
2. Kovelent Bağ
Kimyasal Bağlar
1. İyonik Bağ:
(+)Yüklü iyon (katyon) ve (-) yüklü iyon (anyon)
arasında elektron alışverişi şeklinde gerçekleşen
bağdır.
Örneğin Klor (17) atomunun kararlı hale geçmesi
için1elektron alması gerekir. Sodyum (11)atomunun
kararlı hale geçmesi içinse 1 elektron vermesi gerekir.
Kimyasal Bağlar
2.
Kovalent Bağ:
Atomlar arasında, son katmanlarda yer alan
elektronlardan bazılarının ortaklaşa
kullanılmasıyla oluşan bağa denir.
• Kovalent bağ aynı cins atomlar arasında
oluyorsa apolar kovalent bağ adını alır. Örneğin:
oksijen(8) atomları arasındaki bağ.
• Kovalent bağ farklı cins atomlar arasında oluyorsa polar
kovalent bağ adını alır. Örneğin: Hidrojen (1) ve oksijen (8)
atomları arasındaki bağ.
Bileşikler ve Özellikleri
• ....Farklı......... cins atomlardan oluşan kimyasal yöntemlerle
kendini oluşturan maddelere ayrıştırılabilen maddelere bileşik
denir.
• Saf maddelerdir.
• ..Formüller................ ile gösterilir.
• En küçük yapı taşı, ...moleküller..................
Bileşikler ve Özellikleri
– Erime ve kaynama noktaları ...sabittir................ .
– Kimyasal yöntemlerle daha basit maddelere
ayrıştırılabilirler.
– Bileşiği oluşturan maddeler, .belli.......... oranlarda
birleşirler.
– Bileşenlerinin özelliğini .....taşımazlar...................... .
Bileşikler ve Özellikleri
• Bileşikler içerdikleri elementlere göre adlandırılır.
• Bileşikleri göstermek için element sembollerini kullanırız.
• Bir bileşik formülünde, o bileşiği oluşturan elementlerin
sembolleri ve o elementin atomlarından kaç tane olduğu
yazılır.
Bileşikler ve Özellikleri
Örneğin:
– CO de 1 karbon atomu, 2 oksijen atomu,
– HCI’de 1 hidrojen atomu, 1 klor atomu,
– C H O ‘da 6 karbon, 12 hidrojen, 6 oksijen atomu vardır.
Karışımlar ve Özellikleri
• Birden fazla maddenin özelliklerini kaybetmeden
oluşturdukları saf olmayan maddelere karışım denir.
– Saf olmayan maddelerdir.
– ..Sembol.......... veya .......formüller............. ile
gösterilmezler.
– .Homojen............. veya ....heterojen............ olabilirler.
– Tanecikleri; farklı cins .....atom........... veya
...moleküllerdir....
Karışımlar ve Özellikleri
– ...Fiziksel........... yöntemlerle, kendilerini oluşturan
maddelere ayrılabilirler.
– Karışımı oluşturan maddeler, ...her...... oranda karışabilir.
– Karışımı oluşturan maddeler; özelliklerini
...kaybetmezler.....................
– Erime ve kaynama noktaları …sabit……… değildir.
Karışımlar ve Özellikleri
1. Heterojen karışım
• Her tarafında farklı özellik gösteren tek bir madde gibi
gözükmeyen karışımlardır.
• Yer altından çıkarılan maden filizleri, kaya parçaları,
odun parçaları, bir bitki yaprağı, sis, ayran, petrol su
karışımı , beton parçası, toprak heterojen karışımlara
örnek verilebilir.
Karışımlar ve Özellikleri
–
Heterojen karışım emülsiyon ve süspansiyon olmak üzere
üçe ayrılır.
1. Emülsiyon:
– Bir sıvıda çözünmeyen başka bir sıvının heterojen
olarak bulanık bir şekilde dağılmış hâlidir.
– Su–zeytinyağı karışımı, su–benzin karışımı, gibi.
1. Süspansiyon:
– Bir sıvıda çözünmeyen katının heterojen olarak
dağılmış şeklidir.
– Su–kum karışımı, su–tebeşir tozu karışımı gibi.
2. Aeresoller:
– Sıvı-gaz heterojen karışımlara denir.
– Deodorant gibi.







