MADDENİN YAPISI VE ÖZELLİKLERİ
KONULAR
1. Atomun Yapısı
2.Element ve Sembolleri
3. Elektronların Dizilimi ve Kimyasal Özellikler
4. Kimyasal Bağ
5. Bileşikler ve Formülleri
6. Karışımlar
1.Atomun Yapısı
Saçlarımızın elektriklenmesi, araba kapısına
çarpan parmak uçlarımızın elektriksel yük
boşalmasından dolayı karıncalanması, cam çubuğun
kumaşa sürtüldükten sonra kâğıdı çekmesi,
kazağımızı çıkartırken çıtırtıların duyulması,
yıldırımın düşmesi gibi olaylar atomun daha küçük
parçacıklardan var olduğunu bize göstermektedir.
• Atomun çekirdeğinde pozitif (+) yüklü olan
proton (p+) ve yüksüz olan nötron (n), negatif
(-) yüklü olan elektron (e- ) ise çekirdeğin
etrafında dönmektedir.
•
Elektronun hareketi esnasında, çekirdek ile
elektron arasında bir çekim kuvveti oluşur.
Elektronlar çekirdeğin etrafında sabit bir yerde
durmazlar.
Elektronlar çekirdekten belirli uzaklıklarda
hem kendi etraflarında hem de çekirdek
etrafında çok hızlı hareket ederler. Bu sebeple
çekirdeğe düşmezler, çekirdek tarafından da
çekildiklerinden de dışarı fırlamazlar.
• Çekirdekte bulunan proton ve nötronlar,
elektrona göre oldukça yavaş hareket ederler.
Elektronlar çekirdek etrafında 2,18 x 108 cm/s
hızla dönerler.
• Kütle no=Proton sayısı + Nötron sayısı
• Atomun çekirdeğinde bulunan proton ve
nötronun kütlesi hemen hemen birbirine
eşittir. O halde şunu diyebiliriz, atomun kütlesi
çekirdeğinde toplanmış durumdadır.
• Elektronun kütlesi ise proton ve nötrona göre
çok küçüktür. 1 elektronun kütlesi proton veya
nötronun kütlesinin 2000 de biri kadardır.
ATOM MODELLERİ
DALTON
Dalton atomların içi dolu, berk ve bölünmez küreler
olduğu fikrini ortaya attı.
THOMSON
Thomson’un ortaya koyduğu atom modeline göre,
atom bir üzümlü keke benzemektedir.
Kek atomdaki pozitif yükleri, rastgele dağılmış olan
üzüm taneciklerini de eletronları ifade etmektedir.
RUTHERFORD
Rutherford atomdaki pozitif yüklerin küçük bir
hacimde olması gerektiğini, negatif yüklerin ise bu
küçük hacimli çekirdeğin etrafında ve aralarında
büyük boşluklar olacak şekilde bulunması gerektiği
fikrini ortaya attı.
BOHR
Bohr, elektronların çekirdek çevresinde istediği gibi
dönmeyeceğini belirtti.
Her elektronun çekirdeğin etrefında belirli bir
mesafede dönmesi gerektiği fikrini ortaya attı.
Modern Atom Teorisi
• Elektronlar atom çekirdeğinin çevresinde çok bir hızla
döner. Bu nedenle gerçekte elektronların bulunduğu
yerin belirlenmesi mümkün değildir.
• Bu modele göre elektronların bulunduğu bir yerden
değilde bulunabileceği bölgelerden bahsedilmektedir.
Yani elektronun gerçekte belirli bir yörüngesi ya da
katmanı yoktur.
2.Element ve Sembolleri
Elementler :
Aynı cins atomlardan oluşan, fiziksel ya da kimyasal yollarla
kendinden daha basit ve farklı maddelere ayrılamayan saf
maddelere element denir.
Bir elementi oluşturan bütün atomların büyüklükleri ve atomların
arasındaki uzaklık aynıdır. Fakat bir elementin atomları ile başka bir
elementin atomlarının büyüklükleri ve atomların arasındaki
uzaklıkları farklıdır.
Aynı elementten yapılan farklı maddeler de aynı cins atomlardan
oluşurlar.
Elementlerin Özellikleri
1- En küçük yapı birimleri atomlardır.
2- Aynı cins atomlardan oluşurlar.
3- Kendinden daha basit ve farklı maddelere
ayrılamazlar.
4- Saf maddelerdir.
5- Sembollerle gösterilirler.
Element Çeşitleri
• Atomik Yapıdaki Elementler
Bazı elementleri oluşturan aynı cins atomlar doğada
tek başlarına bulunurlar. Böyle atomlara sahip
elementlere atomik yapılı elementler denir. Atomik
yapılı elementlerin en küçük taneciği atomlardır.
Demir, bakır, alüminyum, çinko, kurşun, altın gibi
elementler atomik yapılıdır.
• Moleküler Yapıdaki Elementler :
Bazı elementleri oluşturan aynı cins atomlar
doğada ikili (veya daha fazla sayıda atomdan
oluşan karmaşık yapılı) gruplar halinde
bulunurlar.
Böyle atomlara sahip elementlere moleküler
yapılı elementler denir. Moleküler yapılı
elementlerin en küçük taneciği moleküllerdir.
• Günümüzde bilinen 118 element vardır. Bu
elementlerin 92 tanesi doğada bulunurken geri kalanı
da laboratuarlarda elde edilen yapay elementlerdir.
• Elementler sembollerle gösterilir ve her elementin
kendine özgü sembolü vardır. Element sembolü
yazılırken;
• Sembol tek harfli ise büyük harfle yazılır.
• Sembol iki veya üç harfli ise ilk harf daima büyük,
diğer harfler küçük yazılır. (Sembollerin iki veya üç
harften oluşmasının nedeni, bazı elementlerin baş
harflerinin aynı olmasıdır).
Elementlerin sembollerle gösterilmesinin nedeni,
bütün Dünya’da ortak bir bilim dili oluşturmak,
bilimsel iletişimi ve yazımlarını kolaylaştırmaktır.
Elementlerin bütün Dünya’da kullanılan sembolleri
aynı olmasına rağmen isimleri dillere göre farklıdır.
(Türkçe, Rusça, Çince, Japonca da element isimleri
farklı olmasına rağmen sembolleri aynıdır).
Bazı elementler ve kullanım yerleri, sembolleri
Hidrojen (H) :
• İlk olarak 1776 yılında Henry Cavendish
tarafından keşfedilmiştir.
• Hidrojen ismi ise Antoine Lavoisier tarafından
verilmiştir.
• Bilinen renksiz en hafif gazdır.
• Suyun, canlıların ve petrol gibi birçok maddenin
yapısında bulunur.
• Roket yakıtı olarak kullanılır.
Bor (B) :
• 1808 yılında Humphry Davy, Gay–Lussac ve
Thenard tarafından ilk defa elde edilmiştir.
• Oda koşullarında katı halde bulunur.
• Isıya dayanıklı renkli cam imalatında,
seramiklerde ve roket yakıtlarında kullanılır.
Azot (N) :
• Azot ilk olarak 1772 yılında Daniel Rutherford
tarafından keşfedildi.
• Renksiz ve kokusuz bir gazdır.
• Canlılar için gerekli temel elementlerden biridir.
• Sıvı azot soğutma amacıyla kullanılır.
• Bazı azot bileşikleri tarımda gübre olarak kullanılır
Doğada Kullanılan Elementlerin Benzerliği
Doğadaki canlı ve cansız varlıkların tamamı
elementlerden oluşur. Canlı varlıkları oluşturan
elementlerden bir kısmı aynı zamanda yeryüzünün
yapısını da oluşturur.
Aynı elementlerden oluştukları halde canlı vücudu,
yeryüzü veya diğer maddelerin yapısı arasında
farklılıkların bulunmasının nedeni, canlı vücudunu,
yeryüzünü veya diğer maddeleri oluşturan elementlerin
farklı sayı, çeşit ve şekillerde dizilmesidir.
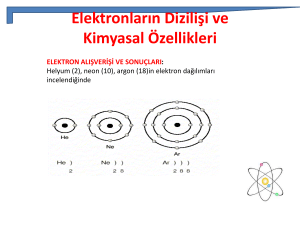
3. Elektronların Dizilimi ve Kimyasal
Özellikler
• Helyum (2), neon (10), argon (18)in elektron
dağılımları incelendiğinde
• Eğer bu üç elementin birer elektronu daha olsaydı, her
birinde yeni bir katman oluşacaktı. Çünkü her üçünün
de en dıştaki katmanları tamamen dolu durumdadır.
• 1.Katmanda en çok 2 elektron bulunması durumu
dublet kuralı, 2. ve 3. katmanlarda en çok 8 elektron
bulunması durumu oktet kuralı olarak adlandırılır.
• Helyum dublet, neon ve argon oktet kuralına uyar.
Oktet veya dublet kuralına uyan atomlar kararlı yapıya
sahiptir.
• Atom elektron alarak kararlı hale geçerse elektron
sayısı>proton sayısı olur. Bu tür iyonlara negatif(-)
yüklü iyon (anyon)denir.
• Atom elektron vererek kararlı hale geçerse elektron
sayısı(+)yüklü iyon (katyon)denir.
• Atomlar kaybettikleri elektron sayısı kadar
+yüklü, kazandıkları elektron sayısı kadar –
yüklü olurlar. Not: iyon yükü =proton sayısıelektron sayısı
• Eğer iyon anyonsa sembolün sağ üst kısmına –
işareti konur ve aldığı elektron sayısı yazılır.
Katyonsa + işareti konur ve sayısı yazılır.
Elementlerin Atom Modelleri
• DEVAMI 2.SLAYTTADIR