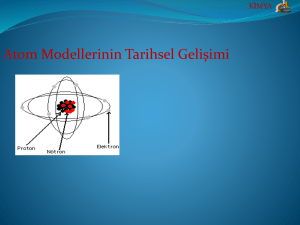
Atom ve Yapısı
Esra Arslan
•
•
•
•
•
Özel Gösteri 1
Özel Gösteri 2
Özel Gösteri 3
Özel Gösteri 4
Özel Gösteri 5
ATOM
• Maddenin küçük bölünemez parçacıklardan
oluştuğu düşüncesini ilk olarak Yunanlı filozof
Democritus ortaya atmış ve bu parçacıklara
eski Yunanca “bölünemez” karşılığı olan
“atomos” adını vermiştir
• Kronolojik sırası ile maddeyi oluşturan temel
parçacık olan atomun yapısı ile ilgili olarak
sunulan modelleri, bunların doğru ve yanlış
yönlerini inceleyelim.
Dalton Atom Modeli
• John Dalton 19. yüzyılın başında atom ile ilgili
ilk bilimsel yaklaşımı öne sürmüştür. Dalton’a
göre atomlar içi dolu kürelerden oluşmaktadır.
Dalton atom modeli özellikleri
• Elementler çok küçük bölünemez küre şeklindeki
parçalardan (atomlardan) oluşmuşlardır.
• Bir elementin tüm atomları büyüklük, kütle ve
diğer özellikler yönünden birbirinin aynıdır.
• Fiziksel ve kimyasal değişimlerde atomlar
parçalanamaz ve yeniden oluşturulamazlar.
• Atomlar belli sabit oranlarda birleşerek bileşik
moleküllerini oluşturur.
• Bir bileşiğin moleküllerinin hepsi aynıdır.
Dalton atom modelinin açıklayamadığı
özellikleri:
• Atomun boşluklu yapısını,
• Atomun parçalanmasını,
• Atomun yapısındaki elektriksel yapıyı ve
taneciklerin elektriksel yüklerini,
• İzotop atom kavramını açıklayamamıştır.
Thomson Atom Modeli
• Joseph John Thomson 1897 yılında atomun daha
küçük parçalardan oluştuğunu öne sürmüştür.
Thomson atomun yapısını üzümlü keke
benzeterek modelini açıklamıştır. Bu modele göre
kek; pozitif yüklere, üzümler ise negatif yüklere
benzetilmiştir.
• J. J. Thomson aynı zamanda elektronlar için
yük/kütle (e/m) oranını ölçmüştür. Böylelikle
atomların daha küçük parçacıklar içerdiğini
ispatlamış oldu.
Thomson atom modelinin özellikleri:
• Atomlar yaklaşık 10-8 cm olan kürelerdir.
• Atom elektrik yükü bakımından nötr olduğu
için, atomda (+) yükü karşılayacak kadar (-)
yüklü tanecik, küre içine dağılmıştır.
• Elektronların kütlesi çok küçüktür ihmal
edilebilir. Atomun kütlesini büyük oranda
protonlar oluşturur.
• Thomson atom modeli üzümlü keke benzer.
Thomson atom modelinin açıklayamadığı
özellikleri:
• Atomun yapısındaki pozitif ve negatif yüklerin
konumunu doğru tespit edememiştir.
• Atomun yapısındaki yüksüz nötronun varlığını
belirleyememiştir.
Rutherford Atom Modeli
• Rutherford alfa taneciklerinin ince levhada saçılmalarını
inceledi. Deney sonucunda:
• Deneyinde radyoaktif kaynaktan çıkan alfa ışınlarını çok
ince levha üzerine gönderdi.
• Alfa ışınlarının çok büyük bir kısmının altın levhadan
direk geçtiği ve kaynağın tam karşısında parıldamalar
meydana getirdiğini gözlemledi.
• Ancak bunun yanında çok az bir kısmın 90 dereceden
büyük bir açıyla saptığını da belirledi.
• Bu sapmanın sebeplerini düşündüğünde bunun ancak
pozitif yüklerin küçük bir merkezde toplanmış olması ve
alfa ışınlarının bu merkezle etkileşmesinden dolayı
saptığını ileri sürdü.
Rutherford atom modeli özellikleri:
• Atomun (+) yükünün tümü atomun merkezinde,
çok küçük hacimsel bir bölgede toplanmıştır. Bu
kısma atomun çekirdeği denir.
• Çekirdek etrafında dairesel yörüngelerde
dolanmakta olan (-) yüklü elektronlar vardır.
• Elektronların bulunduğu hacim, çekirdeğin
hacminden çok büyüktür.
• Çekirdekteki (+) yük miktarı, bir elementin tüm
atomlarında aynı, farklı elementin atomlarında
farklıdır.
• Bir atomda çekirdekteki yük sayısı, elektron
sayısına eşittir.
Rutherford atom modelinin
açıklayamadığı özellikler:
• Elektronların çekirdek etrafındaki dağılımını
açıklayamamıştır.
• Çekirdeğin kütlesini protonların kütlesine eşit
kabul etmiştir. Çekirdekte yüksüz taneciklerin
olabileceğini ifade etmiş fakat nötronun
varlığını açıklayamamıştır.
• Atomların yaydığı spektrumlar Rutherford
atom modeliyle açıklanamamıştır. Bu nedenle
yeni atom teorileri ortaya atılmıştır
Bohr Atom Modeli
• Bohr hidrojen atomlarının yaydığı ışınları
inceleyerek yeni bir atom modeli önermiştir.
Bohr atomların farklı dalga boylarında ışımalar
yapmasını, elektronların enerji seviyeleri
arasındaki geçişlerinden kaynaklandığını
düşündü.
Bohr atom modeli özellikleri:
• Atomdaki elektronlar çekirdek etrafında belirli uzaklıkta
(yörünge) bulunur.
• Her yörüngenin enerjisi farklıdır.
• Yüksek enerji düzeyinde buluna bir elektron düşük enerji
düzeyine inerse aradaki enerji farkına eşit enerjide ışın yayılır.
• Elektronlar en küçük enerji düzeyinde (temel düzey)
bulunmak ister. Madde ısıtıldığında elektronlar daha yüksek
enerji düzeyine geçer. Bu durumdaki atomlar uyarılmış
haldedir.
• Çekirdeğin etrafında çekirdekten uzaklaştıkça enerjisi artan 7
enerji düzeyi vardır. En düşük enerji düzeyi 1 olmak üzere
enerji düzeyleri tam sayı ile numaralanır. Yörüngeler K, L, M,
N, O, P, Q harfleri ile veya 1, 2, 3, 4, 5, 6, 7gibi rakamlar ile
gösterilebilir.
Bohr atom modelinin açıklayamadığı
özellikler:
• Hidrojen ve hidrojen gibi tek elektronlu
iyonların spektrumlarını açıklayabilmişken, çok
elektronlu atomların spektrumlarını
açıklayamamıştır.
• Manyetik alanın emüsyon spektrumuna
etkisini açıklayamamıştır.
• Elektronun ikili (dalga-parçacık) karakterini
hesaba katmamıştır.
Modern Atom Teorisi
• Önceki atom modellerinin eksiklikleri göz önüne
alınıp, bilim adamlarının yaptığı deney ve
gözlemlere dayanarak modern atom teorisi
geliştirilmiştir. Bu teori günümüzde de geçerliliğini
korumaktadır.
• 1924 yılında W. Pauli elektronların değişik enerji
seviyelerine (katman) dağılışları ve enerji
seviyeleri arasındaki elektron geçişleri hakkında
Pauli ilkesini ortaya koydu.
• E. Schrödinger kendi adıyla anılan denkleminde
elektronların bulunma ihtimallinin yüksek olduğu
uzay bölgelerini tespit etmiştir. Bu bölgelere
orbital denir.
Modern atom teorisinin özellikleri:
• Bir elektronun yeri ve hızı aynı anda belirlenemediğinden,
elektronun çekirdek etrafında bulunma olasılığından
bahsedilir.
• Elektronlar (+) yüklü atom çekirdeği etrafında belirli enerji
düzeylerinde (katman), orbital (elektron bulutu) adı verilen
hacimsel bölgelerde hareket ederler.
• Elektronlar dalga özelliği gösterir.
• Orbitaller elektronların çekirdek etrafında bulunma
olasılığının en fazla olduğu bölgelerdir.
• Herhangi bir temel enerji seviyesinde n2 kadar orbital
bulunur.
• Her temel enerji seviyesinde orbital sayısının 2 katı kadar
elektron bulunabilir. Buna göre bir temel enerji
seviyesindeki en fazla elektron sayısı 2n2
• Atom çekirdeği etrafındaki her temel enerji düzeyi
(katman), belirli sayıda orbital denilen alt enerji
düzeylerinden (alt katman) oluşmuştur.
Slaytımız bitmiştir.
Zaman ayırıp izlediğiniz için
teşekkürler.