BİYOENERJETİK
Doç.Dr S.C
1
• Canlı hücrelerin ve organizmaların
,yaşamak,büyümek ve üremek için bir iş
yapmaları gerekmektedir
• Gelişmiş organizmalarda enerjiyi bir
formdan diğer bir forma dönüştürmek
kimyasal reaksiyonlar ile gerçekleşmektedir
2
• Biyoenerjetik,canlı sistemlerde enerji
transferini ve kullanımını tanımlamaktadır
• Biyoenerjetik ,enerji dönüşümleri ile ilgili
genel bir fizik bilimi olan termodinamiğin
özel bölümünü oluşturmaktadır
Termodinamik
• İnsan organizmasında enerji dönüşümleri
termodinamik yasalara uygun gerçekleşmektedir
• Termodinamikte, bir hücre veya birbiri ile
reaksiyona giren iki madde, sistem olarak
tanımlanır.
4
• Termodinamiğin 1.yasası:
• Enerjinin korunumu ile ilgilidir; Bir sistem içindeki
enerji dönüşümünde, enerji artmaz eksilmez ,
sistem ve çevresinin toplam enerjisi sabit kalır
• Enerji şekil değiştirebilir
5
• Termodinamiğin 2.yasası; Entropi (S) ile
ilgilidir
Entropi bir sistemin düzensizliğinin ifadesidir
Sistem denge halindeyken entropi max dur
Çözünme,erime ve buharlaşma olaylarında entropi
artar
6
• Sistemin düzensizliğinin artması
durumunda S’nin değeri pozitifdir (+).
• Sistemin düzensizliğinin azalması
durumunda S’nin değeri negatifdir (-).
7
• Serbest enerji (G), sistemin iş yapmak için
kullanılabilir enerjisidir.Sistemin serbest
enerjisinde değişiklik bir iş yapılmasıyla birlikte
olur. Bu iş kimyasal iş veya kimyasal enerji
şeklinde olabilir.
• Kimyasal reaksiyonlarda enerji veren bir reak
enerji gerektiren bir diğer reaks yürütmek için
eşleşebilir
8
• Sabit sıcaklıkta ve sabit basınç altında gerçekleşen
kimyasal reaksiyonlara eşlik eden enerji
değişikliklerini Gibbs-Helmholtz denklemi
tanımlar
• ΔG = ΔH –TΔS
• ΔG :Serbest enerji değişimidir
• ΔG (-) enerji açığa çıkar ve reak kendiliğinden
ilerler ekzergonik reksiyon
9
G<0 reaksiyon ekzergonik’tir.
• Ekzergonik reaksiyon, yazıldığı şekilde soldan sağa doğru
kendiliğinden ilerler
• G değeri negatif () ve büyük olan reaksiyonlar
(ekzergonik reaksiyonlar), termodinamik olarak elverişli
reaksiyonlar olarak tanımlanırlar
10
• G>0 ise reaksiyon endergonik’tir.
• Endergonik reaksiyon, yazıldığı şekilde
soldan sağa doğru kendiliğinden ilerlemez.
11
• ΔG: (+) ise reaksiyon için enerjiye gerek
• sinim vardır ,endergonik reaksiyon
• ΔG: (0) ise reaksiyon dengededir,enerji
değişimi sıfırdır, kimyasal iş yapılmamaktadır
• ΔH :Entalpi değişimi(kalori veya joule)
• ΔH (-) ise çevrelerine ısı salar ve ekzotermik
reaks dur
12
• ΔH (+) ise endotermik,çevrelerinden ısı alırlar
• S:entropi,sistemdeki karmaşıklığı ve
gelişigüzelliği tanımlar
• ΔS:sistemin entropi değişikliğidir, termodinamiğin
2.kanunu ile ilgilidir.
• T ΔS:sistem tarafından çevreye yayılan ve iş
yapmakta kullanılamıyan enerji
• T:mutlak sıcaklık(Kelvin)
13
• Standart serbest enerji değişikliği
• Bir reaksiyonun standart şartlarda serbest enerji
değişikliği standart serbest enerji değişikliği
olarak tanımlanır ve bu, Go sembolü ile
gösterilir.
• Biyokimyasal reaksiyonlarda [H+]= 10-7 ( pH 7.0 ) olduğu
koşullar, standart koşullar olarak kabul edilir ve standart
serbest enerji değişikliği ΔG'0 olarak gösterilir.
14
aA+bB
cC + dD
[C][D]
ΔG = ΔG0 + R T ln
[A][B]
R:gaz sabiti:8.315 J/mol.K
T:mutlak sıcaklık
ΔG=0 olduğunda (kimyasal denge halinde)
[C][D]
K(denge)=
[A][B]
15
0= ΔG'0 + R T ln Kdenge
ΔG'0 =- R T ln K denge Kdenge= K'eq
ln=2.303 log 10
ΔG'0 =-2,303RT log K denge
K denge ve ΔG'0 den biri bilindiğinde diğeri hesaplanabilir
K'eq
ΔG'0
> 1.0
(–)
1
< 1.0
0
reaks yönü
dengede
(+)
16
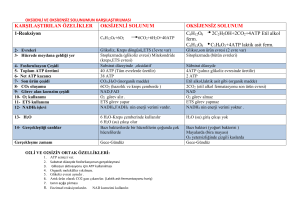
ATP + H20
ADP + Pi reaksiyonu için ΔG'0 = –30.5 kJ/mol ve
Keq =2.105 mol/L olduğundan hidroliz , ürünler yönünde ilerler.
17
Glukoz + Pi Glukoz-6-fosfat + H2O
ATP + H2O ADP + Pi
Goı= 13, 8 kJ/mol
Goı= 30, 5 kJ/mol
Glukoz + ATP Glukoz-6-fosfat + ADP
Goı= 16, 7 kJ/mol
Toplam reaksiyon ekzergoniktir.
18
Ekzergonik ve endergonik olayların
kenetlenmeleri
Termodinamik olarak gerçekleşmeleri zor olan endergonik
reaksiyonlar ,ekzergonik reaksiyonlar ile kenetleneşerek
gerçekleşebilirler
A
B
ΔG' 0 = +13 kJ/ mol
Endergonik olan bu reaksiyon için 250C’da K'eq değeri 1.15.10-3
olarak hesaplanır.Bu reaksiyon ATP hidrolizine kenetlendiğinde
ATP+ H2O ADP + Pi + H+
ΔG' 0 = –30.5kJ/ mol
İki reak taraf tarafa toplanır ΔG' 0 değeri bulunur
19
A + ATP + H2
B + ADP + Pi + H+
ΔG' 0 = – 17.5 kJ/ mol
Kenetlenme reaksiyonun K'eq değeri ΔG' 0 değerinden hesaplanır
K'eq :2.67.102
Kenetli reaksiyonun ΔG' 0 ve K'eq değerleri farklıdır
Hücreler okside olabilen substratları serbest enerji kaynağı olarak
kullanır ve ATP yi yüksek kons da tutarlar
Hücrelerde ATP/ADP oranı yüksek düzeyde (~ 500 M–1 ) tutulur
Bütün canlılarda biyolojik enerjinin taşınmasında, yüksek
enerjili fosfat bileşiği olan adenozin trifosfat (ATP)
molekülü rol oynamaktadır.
21
ADP ile Pi’tan oluşturulan ATP, daha sonra kimyasal
enerjisinin bir kısmını
-metabolik ara maddeler ve küçük ön maddelerden
makromoleküllerin sentezi,
-konsantrasyon gradientine karşı membranların bir
tarafından diğer tarafına maddelerin taşınması
-mekanik hareket gibi endergonik süreçler için
kullanır
22
Canlılarda moleküllerin yıkılımı katabolizma
Yeni bileşiklerin yapıldığı sentez reaksiyonları anabolizma
Anabolik ve katabolik olaylar birlikte metabolizmayı
oluşturmaktadırlar.
23
ATP’nin hidrolizi için aktivasyon enerjisi nispeten yüksektir.
ATP, grup transferi yoluyla
enerji sağlar
24
Canlı organizmada, hidroliz standart serbest enerji değişimi
yüksek,
ATP’den başka bileşikler de vardır. Bu bileşikler, ya ATP gibi
yüksek enerjili fosfat bileşikleridir ya da
asetil-CoA gibi tiyoesterlerdir.
25
ATP hidrolizi
ATP nin yapısında fosfoanhidrit bağlarının (~ P ) hidrolizi
sonucunda ADP veya AMP oluşur. ATP’de iki, ADP’de ise
bir adet yüksek enerjili fosfoanhidrid bağı bulunur.
AMP’de ise yüksek enerjili bağ yoktur.
Hücrede, ATP ve ADP, Mg2+ iyonları ile kompleks yapmış
olarak bulunmaktadır.
ATP’nin katıldığı reaksiyonları hücre içi Mg2+iyon
konsantrasyonu etkiler
26
ATP nin ortofosfat bölünmesi: ß-γ fosfoanhidrid bağı
hidrolize uğrar; ADP ve Pi oluşur..
27
ATP’nin pirofosfat bölünmesi :
α-ß fosfoanhidrid bağı hidrolize uğrar; AMP ile PPi ( inorganik
pirofosfat) oluşur.
ATP’nin pirofosfat bölünmesi, ortofosfat bölünmesine göre daha
ekzergonikdir.
PPi den 2Pi oluşumu ile ATP den pirofosfat yoluyla oluşan
enerji artar
28
ATP, biyolojik sistemlerde serbest enerjinin uzun süreli
depolanmış halinden ziyade enerjinin aktarılmasından
sorumludur,ve dak içinde kullanır
ATP bir yandan sentez edilirken bir yandan da kullanılır
ATP turnover ı oldukça yüksektir.Örn dinlenme durumunda
bir insan 24 st içinde 40kg ATP tüketir
Yoğun ekzersiz gibi hızlı tüketim durumunda ise ATP
tüketim hızı dak da 0.5 kg.
29
Bazı biyosentez reaksiyonlarında yüksek enerjili bileşik olarak
serbest nukleotidler kullanılır,(GTP,UTP,CTP)
ATP+UDP
ADP+UTP
ATP+UMP
ATP+AMP
enz.kinaz
ADP+UTP
2ADP
30
ATP hidrolizi ile eşleşme reaksiyonları
Yağ asid oksidasyonunun ilk basamağında ,yağ asidleri
AKOA ya bağlanır, endergonik reaksiyondur
ATP hidrolizi ile eşleşerek ekzergonik hale getirilir
31
Pirofosfatın ,fosfataz enzimi varlığında hidrolizi
İle reaksiyon açil KOA yönünde ilerler
ATP protein sentezine katılan aminoasitlerin
aktivasyonunda da fonksiyonel.
ATP pirofosfat olarak bölünür
İlk aşmada aasit ve ATP den amino açil adenilat
oluşur
2.aşamada aaçil tRNA oluşur
32
ATP nin yüksek fosfat transfer potansiyelini etkileyen faktörler
ATP hidrolizi, pH, Mg+2 konsantrasyonu ve ATP nin yapısal
özelliklerine bağlidır
pH 7 de ATPnın baskın olan iyonik formu ATP-4
Düşük pH da ATP nin oksijen atomları protonlanır , atomlar
arası elektrostatik itme azalır ve hidroliz eğilimi azalır. ΔG' 0
daha (+) bir değer olacağından reaks ATP hidrolizi yerine ATP
sentezi yönünde ilerler
33
Hücre içi ATP , ADP, Pi Mg +2 iyonu ile kompleks ATP
hidrolizinin serbest enerjisi Mg +2 kons dan etkilenir
ATP nin fosfat transfer potansiyelini ATP yapısındaki özellikler
de etkiler
1)Rezonans stabilizasyonu
2)Elektrostatik itme
3)Hidrasyona bağlı stabilizasyon
34
1)Rezonans stabilizasyon:termodinamik kararlılığını arttırır
(Oksijen atomları P ile çift bağ karakterli 4 bağ
yapar(rezonans stabilizasyon) bu nedenle daha kararlı
ATP nin –yüklü oksijen atomu + yüklü fosfor atomu
arasındadır ,bu durum elektrostatik bakımından uygun
olmayan durum oluşturmaktadır
35
Anorganik fosfatın
Rezonans şekilleri
2)ATP ,fizyolojik şartlarda (pH 7 ) 4(-) yük taşır,elektronların
biririni itmelerinden dolayı elektrostatik gerilimden serbest enerji
artar,kararlılık ise azalır.
ADP 3 (-) yük taşır,ATP ye göre daha kararlıdır
36
Hidroliz ürünlerinden ADP ve P, ATP ye göre daha
çözünür bir bileşiktir
Çözünürlük te reaksiyon dengesinin sağa kayması ile
ATP hidrolizi kolaylaşır
37
ATP /ADP döngüsü
Hidroliz ΔG' 0 değeri ATP den büyük olan bileşiklerden
ADP ye fosforil bileşikler transfer edilerek ATP sentezi gerçekleşir
ATP çeşitli metabolik yollarda moleküllere fosforil grubunu trasfer
ederek bu molekülleri reaks girmeleri için aktifler
Aerobik org larda ATP kaynağı oks-fosf lasyon
Oksidasyon ekzergonik
Fosf orilasyon endergonik komponent
Subs düzeyinde fosforilsyon , oksidasyon olmadan yüksek enerjili
bileşiklerden ADP ye fosf grup transferi ile
38
Glikolizde, subsrat düzeyinde fosforilasyon 1,3 BPG-----3fosf gliserat
PEP------------pıruvat
ADP den ATP oluşur
TCA siklusunda suksunil KOA dan-----süksinat
Oluşumunda ADP den ATP olşur
Kreatin fosfat------kreatin oluşur
enz :kreatin kinaz—ADP den ATP oluşur
Kreatin fosfat isk kası,kalp kas,sperm,beyinde bulunur
ATP/ADP oranı hüc de yüksek ise depolanır.
İhtiyaç durumunda kreatin kinaz ile ATP oluşur
39
Hücrenin enerji statüsünü, enerji yükü ve fos forilasyon
potansiyeli belirler
= Enerji yükü=
[ATP ] 1 / 2[ADP ]
[ATP ] [ADP ] [AMP]
Fosforilasyon potansiyeli
[ ATP]
=[ ADP ][ P ]
i
40
Hücrede nukleotidlerin tümü AMP olduğunda enerji yükü
sıfırdır
ATP olduğunda ise 1 dir
Fosf potansiyeli yaklaşık 500 M -1 de tutulur
Elektron transfer potansiyeli
Canlı sistemlerde metabolik yollardaki işlemler oksidasyonredüksiyon ile sonlanır.
Oksidasyon, elektron verme
Redüksiyon , elektron alma
41
Elektronun alımı veya uzaklaşması için gerekli enerji ise
elektromotif potansiyel veya elektromotif kuvvet olarak
adlandırılır ve E ile gösterilir,birimi Volt
Oksidoredüksiyon reaksiyonunda elektron veren molekül
ya da iyon indirgeyici elektron alan ise oksitleyici olarak
adlandırılır
Organizmada gerekli ATP nin önemli kısmı ETZ de oluşmakta
Elektronlar moleküler oksijene aktarılırken enerji oluşur
42