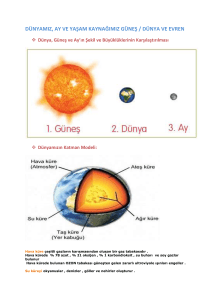
Dosyayı indir - Başkent Üniversitesi
advertisement

BAġKENT ÜNĠVERSĠTESĠ TIP FAKÜLTESĠ ĠÇ HASTALIKLARI ANA BĠLĠM DALI CERRAHĠ TEDAVĠ SONRASI ADJUVAN KEMOTERAPĠ ALAN VE ALMAYAN EVRE II KOLON KANSERLĠ HASTALARIN KLĠNĠK VE PATOLOJĠK ÖZELLĠKLERĠNĠN VE SAĞKALIMLARININ KARġILAġTIRILMASI UZMANLIK TEZĠ Dr. Betül AYDIN BUYRUK Tez danıĢmanı Doç. Dr. Özden ALTUNDAĞ Ankara / 2010 1 BAġKENT ÜNĠVERSĠTESĠ TIP FAKÜLTESĠ ĠÇ HASTALIKLARI ANA BĠLĠM DALI CERRAHĠ TEDAVĠ SONRASI ADJUVAN KEMOTERAPĠ ALAN VE ALMAYAN EVRE EVRE II KOLON KANSERLĠ HASTALARIN KLĠNĠK VE PATOLOJĠK ÖZELLĠKLERĠNĠN VE SAĞKALIMLARININ KARġILAġTIRILMASI UZMANLIK TEZĠ Dr. Betül AYDIN BUYRUK Tez danıĢmanı Doç. Dr. Özden ALTUNDAĞ Ankara / 2010 2 TEġEKKÜR Ġç hastalıkları uzmanlık eğitimimi en iyi Ģekilde tamamlamamı sağlamak için yapmıĢ oldukları katkılardan dolayı baĢta değerli hocam, bilim insanı sayın Prof. Dr. Mehmet Haberal olmak üzere, Ġç Hastalıkları Anabilim Dalı BaĢkanı Nurhan Özdemir Acar‘a, bilgi ve tecrübeleriyle meslek hayatımı Ģekillendiren tüm kıymetli hocalarıma, Asistanlık sürem boyunca bilgi ve deneyimlerinden yararlandığım, bireysel ve bilimsel desteğini daima hissetiğim, tüm yoğun çalıĢmalarına rağmen beni kırmayıp tez danıĢmanım olmayı kabul eden çok değerli hocam Tıbbi Onkoloji Bilim Dalı öğretim görevlesi Doç. Dr. Özden Altundağ‘a, Kendilerinden bir Ģeyler öğrenme fırsatı bulduğum tüm iç hastalıjları uzmanlarına, birlikte çalıĢmaktan mutluluk duyduğum tüm asistan arkadaĢlarıma, asistanlık sürem boyunca acıtatlı tüm anıları paylaĢtığım, desteğiyle, dostluğuyla her zaman yanımda olan sevgili arkadaĢım Uzm. Dr. Nurcan Alhan‘a, Tüm zorluklara rağmen sevgisini benden esirgemeyen ve daima destek olan biricik eĢim Dr. Aytuğ Buyruk‘a Hayat boyu sevgi ve desteklerini hiç esirgemeyen sevgili anneme, babama ve ağabeyime, Sonsuz Ģükran ve teĢekkürlerimi sunarım….. Dr. Betül AYDIN BUYRUK i ÖZET Evre II kolon kanserli hastaların küratif cerrahi sonrası prognozları oldukça iyidir. BeĢ yıllık sağkalım süreleri T4N0 için % 72, T3N0 için % 85 oranında değiĢmektedir. T4, vasküler veya perinöral invazyon, kötü diferensiye tümörler, cerrahi sınır pozitifliği, tanı anında perforasyon ve obstruksiyon kliniği ya da 12 den az lenf nodu çıkarılması gibi yüksek risk faktörlerinden en az birine sahip olan hastalara adjuvan kemoterapi önerilmekle birlikte evre II kolon kanserli hastalarda adjuvan tedavinin yeri halen tartıĢmalıdır. ÇalıĢmamızda evre II kolon kanserinde yalnızca cerrahi tedavi alan hastalarla ile cerrahi tedavi sonrası adjuvan kemoterapi uygulanan hastaların klinik ve patolojik özelliklerinin ve sağkalımlarının retrospektif olarak karĢılaĢtırılması amaçlanmıĢtır. Bu çalıĢmaya 1999-2007 tarihleri arasında BaĢkent Üniversitesi Tıp Fakültesi Hastanesi Genel Cerrahi bölümünde opere edilmiĢ olan 57 evre II kolon kanserli hasta dahil edildi. ÇalıĢmaya katılan 57 hastanın 43‘üne(% 75,4) cerrahi tedavi sonrasında adjuvan kemoterapi verilmiĢti. 14 hasta.(%24,6) ise sadece küratif cerrahi sonrasında izleme alınmıĢtı. Kemoterapi alan ve almayan hastaların yaĢ ortalaması 64,6 idi. Hastaların izlem süresi 16 ile 108 ay arasında değiĢmekteydi (ortalama 36 ay). TNM evrelemesine göre T4 lezyonu olan toplam 26 hastanın 23‘üne (%21,4) cerrahi tedavi sonrasında adjuvan kemoterapi uygulandığı (%53,5), 3 hastaya ise sadece izlem yapılmıĢ olduğu saptandı. Rekürrens saptanan 12 hastadan 11 hastaya (%25,6) cerrahi tedavi sonrasında adjuvan kemoterapi verilmiĢti. Genel sağkalım ve rekürrens üzerinde etkili olabilecek faktörler incelendiğinde T4 lezyon varlığının rekürrens üzerine etkisi istatiksel olarak anlamlı bulundu (p = 0.015).Ancak genel sağkalıma etkisi saptanmadı (p = 0.89). Kemoterapi alan 43 hastada klinik ve patolojik özelliklerin rekürrens ve genel sağ kalıma etkisi incelendiğinde ise hiçbir faktörün etkisi istatistiksel olarak anlamlı bulunmadı. ÇalıĢmamız özellikle T4 tümör varlığında evre II kolon kanserli hastalarda nüksün daha sık olduğunu doğrulamaktadır. Evre II kolon kanserli hastaların tedavi alıp almamasına bireysel özelliklerin değerlendirilmesiyle karar verilmelidir. ii ABSTRACT Patients with stage II colon cancer have a relatively good prognosis after curative resection. Five- year overall survival rate is ranging from % 72 for T4N0 to % 85 for T3N0. Adjuvant chemotherapy is commonly recommended in patients who have at least one of the high risk factors including T4 tumor, vascular or perineural invasion, poor differantiation, positive surgical margine, perforation and obstruction at diagnosis or less than 12 lymph nodes removed at surgery. Hovewer, adjuvant treatment is stil debatable for patients with stage II colon cancer. Aim of our study was retrospectively to compare clinic and pathological features and overall survival of patients with stage II colon cancer who received adjuvant chemotherapy after surgical treatment with the patients who did not receive adjuvant chemotherapy. Fifty-seven patients with stage II colon cancer who were operated at Department of Surgery in BaĢkent University School of Medicine between 1999 and 2007 were enrolled into the study. In this study; 43 patients (%75,4) was treated with adjuvant chemotherapy after surgery. However, 14 patients (%24,6) did not receive chemotherapy after curative surgery. The mean age was 64,6. Follow-up period of patients was ranging from 16 to 108 months (mean follow-up period was 36 months). According to TNM staging system, out of 26 patients with T4 lesions, 23 were treated with adjuvant chemotherapy after surgery (%53,5). The adjuvant chemotherapy was given after surgical treatment in 11 patients of 12 patients who had recurrence (25,6%). The factors that may impact on overall survival and recurrence were examined and the presence of T4 tumors in patients with stage II colon cancer were statistically significant on the recurrence (p = 0.015). Hovewer, the presence of T4 tumors was not found to be associated with overall survival (p = 0.89). When the effects of clinicopathological features on recurrence and overall survival were examined in 43 patients who treated with chemotherapy, no factor was not associated with either recurrence or overall survival. Our study confirmed that patients with stage II colon cancer having especially T4 tumor had a more frequent recurrence. In patients with stage II colon cancer, adjuvant treatment should be decided by evaluating the individual characteristics. iii ĠÇĠNDEKĠLER TEġEKKÜR ..................................................................................................... i ÖZET ............................................................................................................... ii ABSTRACT ................................................................................................... iii ĠÇĠNDEKĠLER............................................................................................... iv KISALTMALAR ........................................................................................... vi ġEKĠLLER ................................................................................................... viii TABLOLAR ................................................................................................... ix 1. GĠRĠġ ve AMAÇ ................................................................................... 1 2. GENEL BĠLGĠLER ............................................................................... 3 2.1. Kolorektal Tümörlerde Epidemiyoloji ............................................................. 3 2.2. Anatomi ........................................................................................................... 4 2.3. Histoloji ............................................................................................................ 5 2.4. Etyoloji ............................................................................................................. 6 2.5. Kolon Kanseri Karsinogenezi ........................................................................ 11 2.6. Kolorektal Kanserde Histopatoloji ................................................................ 12 2.6.1. Adenokarsinom .................................................................................. 13 2.6.2. Müsinöz Adenokarsinom ................................................................... 13 2.6.3. Küçük Hücreli Karsinom .................................................................... 14 2.6.4. Undiferansiye Karsinom .................................................................... 14 2.6.5. Skuamöz / Adenoskuamöz Karsinom ................................................. 14 2.6.6. Seyrek Görülen Kolorektal Karsinomlar ............................................ 14 2.7. Tümör Yayılımı ve Metastaz ......................................................................... 14 2.8. Kolorektal Kanserlerin Klinik Özellikleri ..................................................... 15 2.9. Kolorektal Kanserlerde Tanısal Değerlendirme ............................................. 16 2.10. Kolorektal Kanser Ġçin Tarama Programları ve Tarama Yöntemleri ........... 17 iv 2.11. Kolorektal Kanserlerin Evrelemesi ve Prognostik Faktörleri ........................ 20 2.11.1. Evreleme ........................................................................................... 20 2.11.2. Prognostik Faktörler ......................................................................... 26 2.12. Tedavi ............................................................................................................ 33 2.12.1. Cerrahi Tedavi ................................................................................... 33 2.12.2. Radyoterapi ....................................................................................... 34 2.12.3. Kemoterapi ........................................................................................ 35 3. ADJUVAN KEMOTERAPĠNĠN EVRE II KOLON KANSERĠNDE ETKĠNLĠĞĠ ............................................................... 46 3.1. Evre II kolon kanseri popülasyonunda risk belirlenmesi ............................... 46 3.2. Yüksek Riskli Evre II Hastalığın klinik Tanımlamaları ................................ 47 3.3. Evre II Kolon Kanserinde Adjuvan Kemoterapi ile Ġlgili ÇalıĢmalar ........... 48 3.4. Evre II kolon kanseri popülasyonunda kemoterapi toksisitesi ...................... 51 4. GEREÇ VE YÖNTEM ........................................................................ 53 4.1. Ġstatistik......................................................................................... 54 5. BULGULAR ........................................................................................ 55 5.1. Genel Klinik Özellikler .................................................................................. 55 5.2. Adjuvan Kemoterapi Alan ve Almayan Hastalarda Klinik Özellikler ........... 58 5.3. Tedavi ............................................................................................................. 60 5.4. Sağkalım ......................................................................................................... 60 5.5. Kemoterapi Alan ve Almayan Gruplarda Klinikopatolojik Özelliklerin Sağkalım ve Rekürrens Üzerine Etkisi ........................................................... 66 6. TARTIġMA ......................................................................................... 72 7. KAYNAKLAR..................................................................................... 84 v KISALTMALAR KRK : Kolorektal Kanser NSAĠĠ : Nonsteroid antiinflamatuvar ilaçlar TNF : Tümör nekroz faktör HPKK : Herediter polipöz kolorektal kanserler HNPKK : Herediter nonpolipöz kolorektal kanserler FAP : Familyal adenomatöz polipozis APC : Adenomatöz polipozis coli GH : Growth hormon MSI : Mikrosatellite instabilite CEA : Karsinoembriyojenik antijen CA 19-9 : Karbonhidrat antijen 19-9 AJCC : American Joint Committe on Cancer GĠS : Gastrointestinal sistem LAR : Low-anterior rezeksiyon APR : Abdomino-pelvik rezeksiyon WHO : World Health Organisation BT : Bilgisayarlı tomografi KT : Kemoterapi DM : Diabetes mellitus HT : Hipertansiyon FA : Folinik asit LV : Leucovorin 5-FU : 5-Fluorourasil TNM : Tümör Nod Metastaz FOLFIRI : 5-Fluorourasil (5-FU) + Folinik asit (FA) + irinotekan FLOX : 5-Fluorourasil (5-FU) + Oksaliplatin + Folinik asit (FA) FOLFOX : 5-Fluorourasil (5-FU) + Folinik asit (FA) + Oksaliplatin LN : Lenf nodu MMR : Mismatch repair geni DCC : Deleted in Colon Cancer EGFR : Epidermal growth faktör reseptörü vi NCCN : National Comprehensive Cancer Network ASCO : American Society of Clinical Oncology KOAH : Kronik obstruktif akciğer hastalığı NSABP : National Surgical Adjuvant Breast and Bowel Project DNA : Deoksiribonükleik asit TGF beta : Transforming Growth Factor beta IGF-1 : Insülin Like Growth Factor-1 PET : Pozitron Emisyon Tomografisi HSK : Hastalıksız sağkalım GSK : Genel sağkalım GA : Güven aralığı DGKT : DıĢkıda gizli kan testi MSI-H : Yüksek frekanslı mikrosatellite instabilite fenotipi vii ġEKĠLLER Sayfa No: ġekil 2.1. Kolon anatomisi.............................................................................................. 4 ġekil 2.2. Kolon duvarının histolojik yapısı ................................................................... 5 ġekil 2.3. Kolorektal kanserin geliĢiminde oluĢan moleküler genetik olaylar .............. 11 ġekil 2.4. Astler-Coller evrelemesi ................................................................................ 22 ġekil 2.5. TNM evrelemesi ............................................................................................ 25 ġekil 2.6. TNM evrelemesinin histopatolojik görüntüsü ............................................... 25 ġekil 5.1. Tüm Vakaların Rekürrenssiz (Hastalıksız Sağkalıma) Sağkalım Eğrisi ....... 71 ġekil 5.2. Tüm Vakaların Genel Sağkalım Eğrisi.......................................................... 71 viii TABLOLAR Sayfa No: Tablo 2.1. KRK‘lerin Dünya Sağlık Örgütü Histolojik Sınıflaması .............................. 12 Tablo 2.2. Yüksek riskli olgularda KRK tarama önerileri .............................................. 20 Tablo 2.3. 1932 Dukes evrelemesi ................................................................................ 21 Tablo 2.4. 1936 Dukes evrelemesi ................................................................................. 21 Tablo 2.5. Astler-Coller sınıflaması .............................................................................. 22 Tablo 2.6. TNM sınıflaması ........................................................................................... 24 Tablo 2.7. Evrelere göre beklenen ortalama 5 yıllık sağkalım oranları ......................... 24 Tablo 2.8. TNM evre sisteminde evre gruplaması ve diğer sistemler .......................... 26 Tablo 5.1. Olguların demgrafik özellikleri yönünden dağılımı ..................................... 56 Tablo 5.2. Tümör lokalizasyonu dağılımı ...................................................................... 57 Tablo 5.3. Cerrahi rezeksiyon tipleri ............................................................................. 57 Tablo 5.4. EĢlik eden hastalıkların dağılımı .................................................................. 57 Tablo 5.5. KT alan ve almayan gruplara göre olguların demografik ve klinik Özellikleri yönünden incelenmesi ................................................................ 59 Tablo 5.6. Olgulara uygulanan adjuvan kemoterapi rejimleri ....................................... 60 Tablo 5.7. Olgulara uygulanan kemoterapi kür sayısı dağılımı .................................... 60 Tablo 5.8. Genel sağkalım üzerinde etkili olabilecek faktörler ............................... 61-62 Tablo 5.9. Hastalıksız sağkalım üzerinde etkili olabilecek faktörler ........................ 63-64 Tablo 5.10. Hastalıksız sağkalım üzerinde etkili olabileceği düĢünülen risk faktörlerin çoklu değiĢkenli etkilerinin Cox regresyon yöntemine göre incelenmesi ........................................................................................ 65 Tablo 5.11. Rekürrens ve genel sağkalım üzerinde yaĢ ve tümör büyüklüğünün Etkisinin incelenmesi ................................................................................... 65 Tablo 5.12. KT alan grup içerisinde rekürrens ve genel sağkalım üzerinde yaĢ ve tümör büyüklüğünün etkisinin incelenmesi .......................................... 66 Tablo 5.13. KT alan grup içerisinde genel sağkalım üzerinde etkili olabilecek faktörler ................................................................................................. 67-68 Tablo 5.14. KT alan grup içerisinde hastalıksız sağkalım üzerinde etkili olabilecek faktörler ............................................................................... 69-70 ix 1. GĠRĠġ ve AMAÇ Kolon adenokarsinomu gastrointestinal sistemin en çok rastlanan kanseridir. Erkek ve kadınlarda görülen kanserlerin yaklaĢık % 10‘unu kolorektal kanser oluĢturmaktadır. Amerika BirleĢik Devletleri (ABD)‘de kansere bağlı ölüm nedenleri arasında kolorektal kanser ikinci sırada yer almaktadır (1). Erken evrede tanısı konarak küratif cerrahisi yapılan hastaların bir kısmında zamanla lokal veya uzak tümör nüksleri geliĢmekte ve buna bağlı olarak 5 yıllık sağkalım oranları evre 1 tümörlerde %93,evre II tümörlerde % 78, evre 3 tümörlerde ise % 64 oranında olmaktadır (2). AJCC sınıflamasına göre kolon kanserinde evre II, 2A ve 2B olarak gruplara ayrılmıĢtır. Evre II A (T3N0M0) da tümör muskularis propria üzerinden subseroza veya peritonu olmayan perikolik ya da perirektal dokulara invazedir, lenf nodu tutulumu ve metastaz yoktur. Evre II B (T4N0M0)de ise tümör organ ya da yapılara direk olarak invaze ve/veya viseral peritonu tutmuĢ olup lenf nodu tutulumu ve metastaz yoktur (3). AJCC ve CAP (Amerikan Patoloji Birliği) kolon kanserinde evre II sınıflaması yapmak için minumum 12 lenf nodunun incelenmesi gerektiğini bildirmiĢtir (4,5). Sadece küratif cerrahi yapılan evre II kolon kanseri hastalarda genel sağkalım oranının yaklaĢık olarak %70-80 olduğu belirtilmiĢtir (6). Bu olumlu sağkalım sonuçlarına rağmen bazı evre II hastalar lenf nodu pozitif hastalarınkine benzer Ģekilde daha yüksek bir relaps riskine sahiptirler (7). Bazı meta-analiz sonuçlarına göre adjuvan kemoterapi evre II kolon kanserli hastalarda % 30‘ lara varan genel sağkalım avantajı sağlamakta ve yaklaĢık olarak % 5‘lik mutlak fayda göstermektedir (8). Yapılan bazı çalıĢmalarda ise postoperatif tedaviyle istatiksel olarak anlamlı hiçbir sağkalım avantajı bulunamamıĢtır ve evre II kolon kanseri hastaları için adjuvant kemoterapi kullanımının rutin olarak uygulanmaması önerilmiĢtir.(9,10) Bu çalıĢmada BaĢkent Üniversitesi Tıp Fakültesinde 1999-2007 yılları arasında sadece küratif cerrahi yapılan ve takip edilen evre II kolon kanserli hastalar ile adjuvan kemoterapi verilen evre II kolon kanserli hastaların yaĢ, cins, tümör boyutu ve gradı, diseke edilen lenf nodu sayısı, lenfovasküler invazyon varlığı, tümörün lokalizasyonu gibi klinik patolojik özellikleri karĢılaĢtırılmıĢtır. Her iki grup hastaların hastalıksız ve genel 1 sağkalımlarının retrospektif olarak karĢılaĢtırılması amaçlanmıĢtır. Günümüzde hala hangi evre II hastanın adjuvan kemoterapi alıp almaması gerektiği net olarak kesinliğe kavuĢmamıĢtır. Ayrıca ülkemizde bu konuda retrospektifte olsa bir çalıĢma yapılmamıĢtır. Bu yüzden bizim yaptığımız analiz evre II kolon kanserli hastaların prognozu ve kemoterapiden fayda görüp görmediği konusunda bilgiler verebilir. 2 2. GENEL BĠLGĠLER 2.1. Kolorektal Tümörlerde Epidemiyoloji Kolorektal kanserler (KRK) geliĢmiĢ ülkelerde akciğer ve meme karsinomlarından sonra en sık ölüme neden olan malignite grubunu oluĢturmaktadır ve insidansı birçok ülkede artıĢ göstermektedir. KRK‘de beĢ yıllık sağkalım oranı tüm hastalar için ortalama % 40 kadardır. Dünyada her yıl ortalama 800.000 yeni KRK tanısı konulmaktadır bu da tüm kanserlerin % 10‘u kadardır (11). Yapılan otopsi çalıĢmalarında 50 yaĢ ve üzeri vakalarda; % 0.5-2 oranında invaziv KRK, % 1- 1.6 oranında in situ karsinom, % 7-10 oranında 1 cm ve üzerindeki büyüklükte adenom, %25-40 oranında herhangi bir boyutta adenom bulunma Ģansı vardır (12). Daha çok ileri yaĢ grubu olan bu kanser türü 50 yaĢından sonra artmaktadır ve 60-70 yaĢlarında en yüksek düzeye ulaĢmaktadır. Ortalama yaĢ erkeklerde 63, kadınlarda 62‘dir. Rektal bölgedeki tümörlerde kadın /erkek oranı 2/1 iken daha proksimalde yer alan tümörlerde cinsiyet farkı bulunmaz. Erkeklerde görülme sıklığı kadınlara göre biraz daha fazla iken kadınlarda mortalite oranı daha yüksektir. Ortalama olarak tüm KRK‘lerin %25‘i çekum ve çıkan kolonda, %25 ‗i rektum, sigmoidde ve inen kolonda, %10‘u transvers kolonda, %8‘i çıkan kolonda, %12‘si çekumda yerleĢim gösterir. Senkron kanser, birden fazla bölgede aynı anda malignite bulunması durumudur ve hastaların %2-5‘inde görülür. ABD‘de yapılan çalıĢmaların ortak analizlerinde sıklık hızı 1980 ortalarına kadar artarken 1985‘ten itibaren azalmaya baĢlamıĢtır. Sıklıktaki azalma için değiĢik faktörlerin rolü olabileceği ileri sürülmüĢtür. Bir çalıĢmada toplumun, diyet ve yaĢam Ģekli değiĢikliği ile KRK insidansının %66-75 oranında azaltılabileceği belirtilmiĢtir (13). Diyetsel faktörler dıĢında aspirin ve NSAĠĠ kullanımının rolü (14) ve kanser taramaları ile adenomatöz poliplerin çıkarılmıĢ olmalarının da kanser insidansındaki düĢüĢün nedeni olabileceği belirtilmiĢtir (15). KRK‘in geliĢmesinde çevresel faktörlerle birlikte genetik faktörlerde önemli bir rol oynamaktadır. Bugün için hastalığın her iki faktöründe karmaĢık etkileĢimleri sonucu ortaya çıktığı kabul edilmektedir. 3 2.2.Anatomi Kalın Barsak (ġekil 1); ileumun bitiminden anüse kadar uzanır ve ortalama 150 cm uzunluğu ile sindirim kanalının 1/5‘ini oluĢturmaktadır. Kalın barsaklar periton içinde ve retroperitoneal alanda karaciğer, dalak, mide, duedonum, ince barsaklar, böbrekler, üreterler ve mesane gibi çok sayıda organla komĢuluk göstermektedir. Kalın barsak ince barsaklardan daha geniĢtir ve ileum-çekum birleĢme yerinde kalın barsak içeriğinin ince barsağa geçiĢini engelleyen ileoçekal valv olarak adlandırılan bir kapak bulunmaktadır. Kalın Barsak çekum, çıkan kolon, transvers kolon, inen kolon, sigmoid kolon ve rektum olmak üzere bölümlere ayrılmıĢtır (ġekil 2. 1) ġekil 2.1. Kolon Anatomisi (Netter) Kalın barsak superior ve inferior mezenterik arterlerden beslenirler. Kolonun venöz dönüĢü bu arterlere eĢ giden venlerle olur. Superior ve inferior mezenterik venler, vena lienalis ile birleĢerek portal sistemi oluĢturmaktadır. Arterler boyunca yer alan kalın barsak lenfatikleri dört ana ganglion grubunda toplandıktan sonra cysterna chyli aracılığıyla venöz sisteme dökülür (16). 4 Kalın barsağın innervasyonu otonom sinir sistemi ile olmaktadır. Sempatik lifler T712‘den çıkar ve submukozal (Meissner) ve myenterik (Auerbach) sinir uçlarında sonlanırlar. Parasempatik innervasyon, sağ kolonda sağ vagus ile sol kolonda L1-3‘den gelen lifler ile olur. Sempatik sistem hareketleri ve sekresyonu inhibe ederken, parasempatik sistem uyarıcı etki gösterir (16). Kolonun lenfatik drenajı arterler boyunca yer almaktadır ve dört kademeden oluĢur. Submukoza ve subseroza tabakalarından çıkan lenf kanalları ilk olarak kolon duvarı komĢuluğundaki epikolik lenf bezlerine boĢalır. Ġkinci lenfatik istasyon ise marjinal arter boyunca yer alan parakolik lenf bezlerinden oluĢur. Ara (Ġntermedier) lenf bezleri ise üst ve alt mezenterik arterlerin ana dalları boyunca yer alırlar. Dördüncü grup lenf bezleri SMA-ĠMA‘nın aortadan çıktıkları yere yakın ana (―main-prinsipal‖) lenf bezleridir (17). 2.3.Histoloji Kalın barsak duvarı dört tabakadan oluĢmaktadır: Mukoza, submukoza, muskularis propria ve seroza ( perikolik yağ dokusu). Mukozada epitelyum, lamina propriya ve muskularis mukoza olmak üzere üç tabakaya ayrılır.(ġekil 2.2) ġekil 2.2. Kolon duvarının histolojik yapısı Tunika Mukoza: Mukozal yüzey tek sıralı alçak kolumnar veya küboidal epitelle döĢelidir ve absobtif hücreler ile goblet hücrelerini içerir. Mukozal yüzeye açılan Lüberkühn kriptleri de matür absobtif hücreler ve goblet hücreleriyle devamlılık 5 göstermektedir. Buna ek olarak immatür ve indiferansiye prekürsör hücreler, endokrin hücreler ve Paneth hücreleri de kriptlerin bazalinde çok miktarda bulunur. Kolon mukozası ince barsak mukozasından daha fazla goblet hücresi içerir. Paneth hücrelerinin çok sayıda eozinofilik sekretuar granülü bulunmaktadır ve lizozim, epidermal büyüme faktörü gibi ürünler içerir. Muskularis mukoza kapillerler ve lenfatiklerle sarılı kas ve sinir lifleri içerir. Tunika Submukoza: Lamina proprianın hücresel içeriğine sahip, nöral pleksusu (Meissner pleksusu) bulunan, gevĢek bağ dokusundan oluĢmuĢ bir tabakadır. Tunika Muskularis: Ġçte sirküler, dıĢta longitudinal kas tabakalarından oluĢmuĢtur ve bunların arasında Auerbachi pleksusu mevcuttur. Tunika Seroza: Tek sıralı yassılaĢmıĢ ya da küboidal mezotelyal hücreler ile döĢeli peritondan ve fibroelastik dokudan oluĢur. Kan damarları ve lenfatikler içerir. Çekum, appendiks, transvers kolon ve sigmoid kolonu tam olarak sarar (18). 2.4. Etyoloji Kolon kanseri geliĢimine etkisi olduğu düĢünülen faktörler arasında; diyet, çevresel faktörler, yaĢ, adenom ve karsinom öyküsü, özellikle inflamatuvar barsak hastalığı olmak üzere diğer predispozan hastalıklar ve aile öyküsünün olması sayılabilir (19, 20). Bu durumlar hastaları kolon kanserine yatkın hale getirse de, hastaların neredeyse % 70‘inde tanımlanabilen bir risk faktörü yoktur. Adenomlar: Kolorektal karsinomların büyük çoğunluğunun adenom zemininden geliĢtiği kabul edilmektedir. Adenomlar displastik kalın barsak epiteli ve destekleyici stroma içeren benign tümörlerdir. Tek ya da çok sayıda olabilirler. Elli yaĢ altında sık görülmez iken yetmiĢ yaĢ ve üstünde görülme sıklıkları %53-%63 arasındadır. Kanser geliĢme sıklığı benzer olmakla birlikte adenomlar erkeklerde kadınlardan üç kat fazla görülmektedir (17, 21). Adenomlar boyutlarına, makroskopik görünümlerine (sesil, saplı, düz), yapısal oranlarına (tubüler, villöz, tubülovillöz) ve displazi derecelerine (hafif, orta, ağır) göre sınıflandırılabilirler. Genelde çıkarılan tüm adenomatöz poliplerin %65-80‘i tübüler, %10- 6 %25‘i tübülovillöz ve sadece %5-10‘u pür villöz adenomdur (22). Normal barsak mukozasından adenom, adenomdan da kanser geliĢme süreci oldukça değiĢkendir. Adenom-karsinom sürecinde kolon mukozası aĢamalardan geçerek sonuçta invaziv kansere dönüĢür. Bazı faktörler normal epiteli uyararak bölünmekte olan farklılaĢmamıĢ hücrelerin kriptlerden ayrılıp villusların yüzeyine geçmesine neden olur. Bu hücrelerin mukoza yüzeyinde sürekli proliferasyonu sonucu polip, diğer deyiĢle adenom oluĢur. Poliferasyon sürerken bez yapıları giderek normal dokuya daha az benzerlik gösterirler ve zamanla bu düzensiz büyüme muskularis mukozayı geçip submukozayı invaze ederek invaziv kanser haline gelir (22). Adenomların kansere dönüĢme riski polibin çapı, sayısı, histolojik tipi ve atipi derecesi ile iliĢkilidir. Histolojik tiplerine göre kanser geliĢme sıklığı villöz adenomda %15-%40, tubulovillöz adenomda %15-20, tubuler adenomda %5-8 Ģeklinde bulunmuĢtur. Bu oran, çapı 1 cm‘nin altında olan tubuler adenomlarda %0,3, tubulovillöz adenomlarda %1,5, villöz adenomlarda %2,5 iken 2 cm‘nin üstündeki tubuler adenomlarda %6,5, tubulovillöz adenomlarda %11,4, villöz adenomlarda %17‗dir (17, 21, 23). YaĢ: Kolon kanserinin % 90‘dan fazlası 50 yaĢından büyük hastalarda meydana gelmektedir. YaĢla birlikte artan kolonik mutasyonlar buna sebep olarak gösterilmektedir (24). Cinsiyet: Kolon kanseri insidansı kadınlarda daha yüksek iken, rektum kanseri erkeklerde daha yaygındır. Irk: Kanser geliĢimi Afro-Amerikan‘larda beyazlardan daha yaygındır ve mortalite daha yüksektir. Tütün kullanımı: Sigara içenlerde yaklaĢık 2,5 kat yüksek adenom riski gözlenmektedir (25). Diyet: Diyetin KRK oluĢumunda önemli bir etiyolojik faktör olduğu sanılmaktadır. Obezite, özellikle abdominal obezite ve artmıĢ vücut kitle indeksi, KRK riski ve mortalitesinde artıĢla iliĢkili bulunmuĢtur. DoymamıĢ hayvansal yağlar, yüksek doymuĢ bitkisel yağlar içeren düĢük lifli ve yüksek kalorili beslenme kolonik mukozada kanser geliĢimini uyarabilen birtakım değiĢikliklere sebep olurlar. Kolon mukoza epitelyum hücrelerinin rejenerasyon direncinin ve mukus kalitesinin kaybına neden olur. Ġntraluminal 7 mikroflora ve içeriği değiĢip, epitel hücre membranlarında yağ asit oranının yükselmesine, lipid peroksidasyon radikallerinin artmasına yol açar. Ayrıca sitokinler, prostaglandinler, interlökinler, tümör nekroz faktör-alfa (TNF) ve nitrik oksit gibi iltihabi mediyatörler mukoza epitel destrüksiyonunun kalıcı hale gelmesine neden olur. Bazı çalıĢmalar diyetteki belli elementlerin neoplazik geliĢmeleri önleyici olduğunu göstermektedir. Selenyum, dithiothionlar, thioeterler, terpenler ve karotenoidlerin kolon mukoza yüzeyindeki serbest oksijen radikallerini indirgeyerek ‗antikarsinojen‘ etki gösterdikleri düĢünülmektedir (22, 26). Safra asitleri (kenodeoksikolik asit gibi) gıda katkı maddeleri, alkol ve iyonize edici radyasyon halen araĢtırma aĢamasında olan diğer bazı potansiyel karsinojenlerdir. (22) Safra asitinin barsakta artması ile KRK arasında iliĢki olduğu gösterildikten sonra sekonder safra asiti artıĢına yol açan kolesistektominin de etken olabileceği ileri sürülmüĢtür (27). Folat, E ve D vitamini eksikliği kanser riskini arttırabilir. Günlük 1,25- 2,0 g kalsiyum alımı bir çalıĢmada daha düĢük bir nüks adenom riskiyle bağlantılı bulunmuĢtur (28). Alkol tüketimi ile KRK riski artıĢı arasında ilgi gözlenmiĢse de bu iliĢki tam net değildir. Risk artıĢının, alkolün folat emilimini azaltması veya folat alımının azalmasına bağlı olabileceği belirtilmiĢtir (25). Enflamatuvar barsak hastalığı: Kronik ülseratif koliti ve Crohn hastalığı olanlarda kolon kanser riskinin hastalık süresi ve yaygınlığı ile orantılı olarak arttığı bilinmektedir. Bu grupta ortalama %3-8 olan kanserleĢme oranı, hastalığın baĢlangıcından 10 yıl sonra % 10‘a, 25 yıl sonra ise %30‘lara kadar yükselmektedir. Pankoliti olanlarda daha sık görülen kanserler, çoğu kez multifokal geliĢim gösterir (29). Crohn‘lu hastalarda kolon kanseri genel toplumdan daha erken yaĢta görülür ve çoğunluğu müsinöz karsinomlardır. Cerrahi by-pass yapılan segmentte veya striktür geliĢen segmentte daha sık görülür. Genetik Faktörler: Genel popülasyonda, birinci derece akrabasının birinde kanser geliĢen bireylerde nispi risk 1,72‘ye çıkarken, iki akrabası etkilenenlerde 2,75‘e yükselmektedir. Hastalığın gerçek herediter formu, tüm KRK‘lerin % 6‘sını oluĢturmaktadır. Herediter KRK‘ler; herediter polipöz kolorektal kanserler (HPKK) ve herediter nonpolipöz kolorektal kanserler (HNPKK) olarak adlandırılırlar. HPKK; polipozis zemininden geliĢen KRK‘lerdir. Sporadik vakalara oranla daha genç yaĢlarda görülürler. Senkron ya da 8 metakron KRK‘ler Ģeklinde görülür. Polipozis zemininde geliĢen KRK‘ler; FAP, Gardner (epidermal inklüzyon kistleri, kemikte osteomalar ve kolonik polipler), Turcot (kolonik polipler ve beyin tümörleri) ve Herediter flat (yassı) adenom sendromunda olduğu gibi otozomal dominant geçiĢ gösteren sendromlarda daha sık görülmektedir (26). Familyal Adenomatöz Polipozis (FAP): FAP % 90‘dan fazla geçiĢli, ergenlik döneminde geliĢen, yüzlerce polip Ģeklinde ortaya çıkan, otozomal-dominant bir kalıtsal hastalıktır. Zaman içerisinde invaziv kanser geliĢme riski %100‘ dür. Kromozom 5q21 üzerindeki adenomatöz polipozis koli (APC) geninde meydana gelen germ-serisi mutasyonlar tanımlanmıĢtır. APC geninin eksikliği, yüksek β-katenin transkripsiyon aktivitesiyle birlikte bozuk sinyal iletimine neden olmaktadır (22). Herediter Nonpolipöz Kolorektal Kanserler (HNPKK): HNPKK grubu da otozomal dominant kalıtım gösteren sendromlardır. Bütün KRK‘in %2- 6‘ sını oluĢtururlar. (30) HNPKK genetiğinde; h MSH2, h MLH1, h PMS1 ve h PMS2 genleri DNA replikasyonu sırasında oluĢan baz çifti yanlıĢ eĢleĢmelerini tamir etmede rol oynayan genler olup bu genlerdeki mutasyonlar düzeltilemeyen genetik hatalara ve HNPKK ‗ya yol açabilmektedir (31). Lynch-1 ve Lynch-2 alt grupları bulunmaktadır. Proksimal kolon tutulumu, müsinöz veya kötü diferansiye histoloji, psödodiploidi ve senkron ya da metakron tümör gibi belirgin klinik özelliklerle karakterize hastalıklardır. Lynch I, kolon dıĢı tutulumun olmadığı bu grupta tümör genellikle erken(ortalama 45) yaĢlarda baĢlayıp %70 oranında proksimal kolonu tutar. Hastalardaki, yaklaĢık % 75‘lik bir yaĢam boyu kanser riskiyle 50 yaĢından önce görülen kolon kanserine rağmen yüksek bir sağkalım gözlenmektedir. Lynch II, baĢta endometriyum, over, üreter/renal pelvis, mide, ince barsak, hepatobiliyer trakt olmak üzere kolon dıĢı tümörlerin eĢlik ettiği gruptur. HNPCC tanısı için 1990 yılında alınan ve ―Amsterdam kriterleri‖ olarak geçen ―International Collaborative Group on Hereditary Non-polyposis Colorectal Carcinoma‖ (ICG-HNPCC) kriterleri revize edilerek Ģu Ģekilde belirlenmiĢtir: a. Ailede biri 1. derecede olmak üzere iki ya da üç bireyde histopatolojik olarak tanı almıĢ kolorektal karsinom bulunması. b. Kolorektal karsinomun en az iki jenerasyonda ortaya çıkması. c. En az bir vakanın 50 yaĢ altında tanı alması. d. Kolorektal karsinoma neden olabilecek Familyal Adenomatöz Polipozis sendromlarının olmaması (23). 9 Diğer Risk Faktörleri: - Üreterokolik anastamozlar: Üreterik stomada artmıĢ neoplaziyle birliktedir. Patogenezde, idrarla atılan karsinojenler ve idrarın oluĢturduğu mukozal hasarı onarma dönemindeki proliferasyon suçlanmaktadır (32). - Önceki pelvik radyasyon öyküsü: Radyasyonun tetiklediği mutasyonlar sonucu pelvik bölgeye radyoterapi alanlarda 5- 10 yıl sonra yüksek kolorektal kanser oranları izlenmiĢtir (33). - Obezite: Sağlıksız diyetteki karsinojenler ve artmıĢ insülin seviyeleri patogenezde sorumlu tutulmuĢtur (34). - Streptokokus Bovis bakteriyemisi: Bu bakterinin kolonosit proliferasyonunu arttırabileceği düĢünülmektedir. (35) - Akromegali: Son yıllarda akromegalili hastalarda, tübülovillöz adenom ve kolorektal kanser riskinin arttığı net olarak ortaya konmuĢtur. Patogenezde GH / IGF-1 aksının olduğu vurgulanmıĢtır. 155 akromegalili hastada yapılan çalıĢmada adenom sıklığı % 25, kolorektal kanser sıklığı ise % 5 bulunmuĢtur. Kolorektal kanser riskinin normal populasyona göre 13 kat fazla olduğu ve bunun da özellikle 50 yaĢ üstünde daha sık olduğu görülmüĢtür. Hastalığın tedavisi ile IGF-1 düzeylerinin düĢtüğü ve adenomatöz polip ve kolorektal kanser sıklığının azaldığı gösterilmiĢtir (36). - Diabetes Mellitus: Diabetes mellituslu hastalarda kolon kanseri insidansında artıĢ olduğunu gösteren çalıĢmalar mevcuttur (37). Ġnsülinin, kolonik mukozal hücreler için önemli bir büyüme faktörü olduğunu ve kolonik tümör hücrelerini uyardığını gösteren çalıĢmalara dayanılarak hiperinsülinemik seyreden olgular için olası bir açıklama getirilmeye çalıĢılmıĢtır (38). - Aspirin ve Nonsteroidal Antiinflamatuar Ġlaçlar (NSAĠĠ) :Kolon kanseri geliĢiminde aspirin ve diğer NSAĠĠ ilaçların koruyucu etkisini gösteren önemli çalıĢmalar mevcuttur (39). Kardiyovasküler hastalıktan koruyucu dozlarda uzun süreli düzenli aspirin kullanımının (en az 10 yıl) kolon kanserinden koruyucu etkiye sahip olduğu gözlenmiĢtir. 10 2.5. Kolon Kanseri Karsinogenezi Kolon karsinogenezi, hiperproliferatif mukozadan polipe dönüĢümü ve displaziyle noninvaziv lezyona ve sonrasında invaziv ve metastatik kapasiteye sahip tümör hücrelerine dönüĢümü içermektedir. KRK, birden fazla genetik değiĢikliğin birikiminden kaynaklanan benzersiz birçok basamaklı karsinogenez modelidir. Evrelere göre yapılan moleküler analizler, bu progresyonun en sık 8 p, 17 p ve 18 q olmak üzere heterozigozite kaybı dahil çeĢitli genetik instabilite tipini kapsadığını göstermiĢtir. 17 p delesyonu p53 fonksiyon kaybından sorumludur ve 18 q, ―kolon kanserinde eksilen tümör süpresör geni‖ (DCC) ve ― pankreatik 4‘te eksilen gen‖ i (DPC4) içermektedir. Kromozom 18 q heterozigozitesinin kaybı prognostik öneme sahiptir. Kolon karsinogenezi, DNA mismatch-tamir sisteminde meydana gelen kayıplar sonucunda da ortaya çıkabilir. Özellikle sporadik kanserlerdeki hMLH1 ve hMSH2 kaybı tekrarlayan DNA nükleotid birimlerinin adezyon veya delesyonunu hızlandırmaktadır. Bu MSI, tip II reseptörlerdeki bir mutasyona bağlı olarak, TGF-β‘nın aracılık ettiği büyüme inhibisyonunun kaybına katkıda bulunmaktadır. Kromozom 5q21 üzerindeki APC geninin mutasyonları FAP‘ den sorumludur ve APC, β-katenin ile birlikte hücresel sinyal ve adhezyonla iliĢkilidir. APC genindeki değiĢiklikler, tümör progresyonunun erken dönemlerinde ortaya çıkmaktadır. K-ras ve N-ras gibi ras ailesinden protoonkogenlerdeki mutasyonlar dönüĢüm için önemlidirler ve bunlar erken tümör geliĢiminde yaygındırlar. ġekil 2.3. Kolorektal Kanserin GeliĢiminde OluĢan Moleküler Genetik Olaylar 11 KRK‘lerin % 90‘ı adenokarsinomdur ve proksimal tümörler gün geçtikçe daha sık görülmektedir. Sol taraflı kanserler annüler olma eğilimiyle tıkanmaya neden olurken, sağ taraflı tümörler daha çok polipoittirler ve klinik olarak sessizdirler. Hastaların üçte biri baĢlangıçta metastaz geliĢtirir. % 50‘si sonradan metastaz geliĢtirmektedirler (40). 2.6. Kolorektal Kanserde Histopatoloji KRK‘lerin büyük kısmı sigmoid kolon ve rektumda görülmektedir. KRK‘ler makroskobik olarak dört tipte görülebilir. Bazen tümörler birkaç tipin özelliğini birarada gösterebilirler. 1. Ekzofitik/fungatif/polipoid, intraluminal geliĢim 2. Endofitik/ülseratif tip, intramural geliĢim 3. Difüz infiltratif/linitis plastika tipi- endofitik, intramural geliĢim 4. Annüler-peçete halkası seklinde, lümeni daraltan geliĢim Sag kolon tümörleri fungatif/polipoid tipte geliĢirken, sol kolondaki tümörlerde genellikle ülseratif ya da annüler tipte geliĢim Ģekli izlenmektedir. Difüz infiltratif tipteki kanserler en sık distal kolonda görülmektedir. inflamatuvar barsak hastalığı zemininde geliĢen KRK‘lerde makroskopik olarak belirgin bir tümöral görünüm olmadığından endoskopik ve radyolojik olarak tanı güçlüklerine yol açmaktadır (41, 42). Tablo 2. 1. KRK‘lerin Dünya Saglık Örgütü (WHO) histolojik sınıflaması. . Adenokanser . Müsinöz adenokanser . Taslı yüzük hücreli kanser . Küçük hücreli kanser . Skuamöz hücreli kanser . Adenoskuamöz kanser . Medüller kanser . Undiferansiye kanser 12 2.6.1. Adenokarsinom KRK‘lerin %85-90'ı adenokanser tipindedir. Adenokanserler atipik tümör hücrelerinin degiĢik boyutlarda ve Ģekillerde adenoid yapıları oluĢturması ile karakterlidir. Adenoid oluĢturma özelliğine ve yaygınlıgına dayanılarak iyi diferansiye, orta derecede diferansiye ve az diferansiye olarak grade‘lendirilir (41, 42). Hastaların % 15-20‘si grade 1 ya da iyi diferansiyedir. % 60-70 grade 2 ya da orta diferansiye, %15-20‘si grade 3 ya da az diferansiyedir. Grade 1 karsinomlar mikroskopik olarak adenoma epiteline benzer. Hücreler uniform görünümde, polarite kaybı yok veya minimaldir. Grade 2 tümörlerde tübüler yapılar basit olabileceği gibi kompleks ve hafif düzensiz Ģekilli olabilir. Nükleer polaritede hafif-orta düzeyde kayıp vardır. Grade 3 tümörlerde glandüler-tübüler yapı tümüyle ortadan kalkmıĢtır. Nükleer polarite tümüyle bozulmuĢtur. Hücrelerde pleomorfizm belirgindir (43). Histolojik gradın sağkalıma etkili olduğu belirlenmiĢtir (44). 2.6.2. Müsinöz Adenokarsinom TaĢlı yüzük hücreli karsinomlar da (müsin birikimi intrasitoplazmik olduğunda hücre çekirdeğini bir kenara iterek taĢlı yüzük hücreli kanser adını alır) bu gruba eklendiğinde, kolorektal karsinomlar içinde görülme sıklığı % 10‘dur. Müsinöz karsinoma tanısı için müsinöz komponentin tümörün % 50‘sinden fazla olması gerekmektedir. Müsinöz karsinomlar bazı durumlarda daha fazla görülür. Bunlar; genç eriĢkin ve çocukların kanserleri, villöz adenoma zemininde geliĢmiĢ tümörler, ülseratif kolitli ve radyoterapi alan hastalarda geliĢen tümörler ve düĢük kolorektal kanser sıklığı olan ülkelerde görülen tümörlerdir. Bu grup tümörler daha ileri evrede olup daha fazla perirektal yayılım, daha fazla lenf düğümü tutulumu ve daha kötü prognoz gösterirler (43). Müsinöz karsinomlar ve taĢlı yüzük hücreli karsinomlar grade III olarak kabul edilirler (44). 13 2.6.3. Küçük Hücreli Karsinom Histopatolojik olarak akciğerin küçük hücreli karsinomu ile aynı özellikleri taĢır ve kolorektal kanserlerin % 1‘inden azını oluĢturur. Tanı sırasında hemen tüm olgularda lenf düğümü ve karaciğer metastazı vardır ve prognozu kötüdür. Bu tümörün tanısı immünhistokimyasal olarak kromogranin, sinaptofizin, NSE ve Leu-7 nin gösterilmesi ile konur. 2.6.4. Undiferansiye Karsinom Tümörü oluĢturan hücreler glandüler ve diğer daha az görülen diferansiye tümör hücrelerine benzemez. Kolorektal tümörlerin % 1‘ini oluĢturmaktadır. Tümör hücreleri genellikle iyi sınırlı, tek düze ve küçük / orta büyüklükte nükleosludur. 2.6.5. Skuamöz / Adenoskuamöz Karsinom Genellikle ülseratif kolit, pelvik radyasyon ve Ģistozomiazisli olgulara ikincil olarak geliĢen kolorektal karsinomlarda sıktır. Bu tümörün tanısı için hastada baĢka bir odakta skuamöz hücreli karsinom olmamalıdır. 2.6.6. Seyrek Görülen Kolorektal Karsinomlar Karsinosarkom, koryokarsinom alanları içeren adenokarsinom, clear hücreli adenokarsinom ve hepatoid adenokarsinomdur. 2.7. Tümör Yayılımı ve Metastaz Tüm kolon tümörleri, doğrudan komĢu yapılara, lenfatikler ve kan damarları yolu ile uzak organlara yayılabilirler. Metastatik yayılım en sık bölgesel lenf nodları ve karaciğere olur. 14 Diğer sık görülen metastaz bölgeleri; periton, akciğer ve overlerdir. Daha nadir metastaz bölgeleri santral sinir sistemi, kemik, testis, uterus ve oral kavitedir (45). 2.8. Kolorektal Kanserlerin Klinik Özellikleri Kolorektal kanserli hastaların çoğu semptomlar ortaya çıktıktan sonra tanı almaktadır. Kolon kanserlerinin klinik bulguları genellikle primer tümörün kolonda yerleĢtiği lokalizasyona göre ortaya çıkmaktadır. Sağ kolon tümörlerinde, barsak alıĢkanlığında herhangi bir değiĢiklik görülmemektedir. Ancak mukus sekrete eden büyük çaplı tümörler diyareye neden olabilmektedir. Sağ kolon tümörlerinde defekasyonla birlikte genellikle fark edilmeyen kronik kan kaybı olmaktadır. Hastalardaki kronik kan kaybı demir eksikliği anemisi ile sonuçlanabilmektedir. Karın ağrısı, sol kolon lokalizasyonlu kanserlerde ve özellikle alt kadranlarda ortaya çıkmaktadır. Bu hastalarda sıklıkla barsak alıĢkanlıklarında değiĢiklik ve hematokezya görülmektedir. Transvers kolonun sağ tarafına yerleĢen tümörler, sağ üst kadran ağrısı ve bulantı gibi bilio-pankreatik patolojiyi düĢündürecek semptomlar gösterirken, sol tarafta yerleĢen tümörler yemek sonrası dolgunluk hissi ve epigastrik ağrı gibi mide patolojilerini taklit eden semptomlar vermektedir. Sol kolon çapı ve geniĢleme özelliği sağ kolona göre daha az, barsak içeriği daha Ģekilli olduğu ve tümörler anüler Ģekilde büyüdükleri için tıkanma belirtileri daha sık görülür. DıĢkı çapında incelme, dıĢkılama sayısında artıĢ, aĢırı gaz Ģeklinde bulgular olabilir (46). Rektal kanserlerde tipik olarak rektal kanama, sık dıĢkılama ihtiyacı ve tam boĢalamama hissi görülür. Geç devrede komĢu organ tutulumu ile perineal veya sakral bölge ağrıları görülür. Kilo kaybı ve ateĢ, kolon kanserlerinde daha nadir görülen semptomlardır. Kolonik tıkanma ve perforasyon baĢlıca görülen akut semptomlardır. Kolonik tıkanma, ileri evre tümörlerde ve özellikle de yaĢlı hastalarda görülmektedir. Tam tıkanıklığın geliĢtiği hastalar, gaz-gayta çıkaramama, bulantı-kusma, abdominal distansiyon ve kramp tarzında karın ağrısı Ģikayetleri ile acil servise baĢvurmaktadırlar. Hastalar bu aĢamada acil operasyona alınmazsa, nekroza uğrayan barsak segmentinin karın içine açılması sonucu, fekal peritonit ve sepsis tablosu görülebilmektedir. Kolonik tümör perforasyonlarının 15 mortalite ve morbiditesi çok yüksek, sağ kalım oranları ise diğer tümör evrelerine göre düĢüktür. Çok nadir olarak kolon kanserlerinin ilk bulgusu metastaz yaptığı organa ait klinik özellikler ile ortaya çıkmaktadır. Masif karaciğer metastazı sarılık ve kaĢıntıya neden olabilir, asit nedeniyle distansiyon görülebilir (47). 2.9. Kolorektal Kanserlerde Tanısal Değerlendirme KRK‘in tanısı, tüm tümörlerde oldugu gibi tümörden kuskulanmak ve bütün belirtilerin degerlendirilmesi ile konur. Hastalığın tanısında dikkatli öykü, belirtilerin degerlendirilmesi ve fizik muayene önemlidir. Fizik muayenenin bir parçası olan dijital rektal muayenenin yapılması rektum kanserinin tanınmasında yararlıdır. Dijital rektal muayene basit, uygulaması kolay bir fizik muayene metodu olup, anal kanaldan itibaren 7 cm mesafede bulunan lezyonların saptanmasında oldukçayararlıdır. Tüm KRK‘lerin yaklasık %20'si bu bölgede yerlestiginden dijital rektal muayene fizik muayenenin bir parçası olarak mutlaka yapılmalıdır. KRK düsünülen hastada ilk olarak tanısal amaçlı aĢağıdaki tetkikler yapılmalıdır: . Dijital rektal muayene ve dıskıda gizli kan testi (DGKT) . Kolonoskopi . Kolonoskopik biyopsi Baryumlu Kolon Grafisi: KRK tanısında en sık kullanılan tanı yöntemlerinden biridir. Çift kontrast kolon grafisi daha doğru sonuçlar verir. BaĢlangıç değerlendirme için daha ucuz olabilir ancak endoskopik çalıĢmalar, histolojik bilgi, potansiyel terapötik giriĢim olanağı ve genel anlamda daha iyi bir sensitivite ve spesifisite sağlamaktadır. Hatalı değerlendirmeler %15 oranında görülebilir. 16 Rektosigmoidoskopi: KRK‘lerinin yaklaĢık %55-60‘ı rektosigmoid bölgede lokalizedir. Bu nedenle rektosigmoidoskopinin tanıda önemi büyüktür. Fleksibl sigmoidoskop ile 60 cm'lik kolon kısmı incelenebilir. Ayrıca lezyondan biyopsi alma imkânı da sağlar. Kolonoskopi: Kolonun fiberoptik endoskop ile incelenmesi bütün kolonun görüntülenmesine imkân veren çok önemli bir tetkiktir. Lezyondan biyopsi almanın yanı sıra kolonun baĢka bir yerinde patoloji olup olmadığının tespit edilmesine imkân verir. Ayrıca radyolojik olarak Ģüpheli lezyonların kesin tanısında da önemli bir yer tutar. Tedaviye baĢlamadan önce evreleme ve takip amacıyla aĢağıdaki tetkikler mutlaka yapılmalıdır: . Akciger grafisi, . Abdomen ve pelvisin BT ile degerlendirilmesi, . Tam kan sayımı, . Karaciğer ve böbrek fonksiyon testleri, . Tam idrar tetkiki, . Tümör belirleyicileri. Kemik filmleri, ürografi, sistoskopi, MR, PET, lokal yayılımı ve metastazları göstermek açısından seçilmis vakalarda yapılabilir. Ġzlemde bulgu ve belirtilere göre değiĢik tetkikler yapılır. CEA, CA 19-9, CA 72-4 gibi tümör belirleyicileri hastalığın takibinde yararlıdır, ancak tanıda yerleri yoktur. Ameliyat sonrasında giderek yükselen CEA seviyesi nüks veya metastaz açısından anlamlıdır. Ayrıca prognostik bir değeri vardır. ArtmıĢ CEA seviyelerinin yüksek rekürrens oranını gösterdiği bildirilmektedir (48, 49). 2.10. Kolorektal Kanser Ġçin Tarama Programları ve Tarama Yöntemleri Amerikan Kanser Cemiyeti, kolon kanserinin erken tanısı için tarama kılavuzları geliĢtirmiĢtir. Kolon kanseri için çok çeĢitli erken tanı testleri mevcuttur. Hem erkek hem de kadınların 50 yaĢından baĢlamak suretiyle tüm test seçeneklerini doktorlarıyla tartıĢması gerekmektedir. Son zamanlarda daha ağırlık kazanan düsünce hastaların risk faktörlerine göre sınıflandırılması ve taramaların bu sınıflandırma esas alınarak yapılmasıdır. 17 50 yaĢ üzerindeki, özgeçmisinde veya aile öyküsünde adenomatöz polipozis veya kolorektal kanser öyküsü olmayan ve gizli veya aĢikar gastrointestinal kanaması olmayan kisiler düĢük risk grubunu olustururlar. Bu kiĢilerde tarama Ģu Ģekilde yapılır; .Yıllık dıĢkıda gizli kan testi (DGKT) .Her 5 yılda bir fleksibl sigmoidoskopi .Yıllık DGKT ve 5 yılda bir fleksibl sigmoidoskopi .Her 5 yılda bir çift kontrastlı baryum enema .Her 10 yılda bir kolonoskopi Tarama programlarına; hastaların kiĢisel, ailesel risk faktörleri ve medikal öyküleri değerlendirilip hastaların risk grupları sınıflandırılarak baĢlanmalıdır. Tüm yöntemlerin avantaj ve dezavantajları belirlenmelidir ve tarama yöntemi seçimi buna göre Ģekillenmelidir. Eğer tarama yöntemiyle anormal bir sonuç alınırsa hekim kolonoskopi ile kolon ve rektumu kapsayacak tam bir yapısal değerlendirme önermelidir. -DıĢkıda Gizli Kan Testi: Yılda bir kez diyet kısıtlaması ile birlikte guaiac temelli bir test ya da diyet kısıtlaması yapılmadan immunhistokimyasal yöntemli bir test kullanılarak dıĢkıda gizli kan testi (DGKT) önerilmelidir. Rehidrasyon yapılmadan ardıĢık 3 dıĢkı örneğinin her birinden 2 örnek incelenmelidir. Herhangi bir örnekte pozitif bulgu saptanırsa kolonoskopi yapılmalıdır. Kolorektal kanserler ve adenomlar aralıklı olarak kanayabildikleri için bir örnekte yalancı negatiflik % 50 dir. Tek bir DGKT‘nin duyarlılığı % 30-50 arasında düĢük oranlarda iken, yıllık tekrarlandığında % 92‘lere kadar kanserleri saptama oranı vardır (50). -Sigmoidoskopi: Fleksible sigmoidoskopi 5 yılda bir önerilmelidir. Sigmoidoskopinin ulaĢabildiği mesafede kolorektal kanserlerin üçte ikisi saptanmaktadır. Sigmoidoskopi ile saptanan kanserden sonra kolonoskopi yapılması tartıĢmalıdır ve kiĢisel değerlendirme yapılmalıdır. Bazı çalıĢmalar distal adenoma yokluğunda proksimal ileri adenom görülme prevalansının % 2-5 oranında olduğunu göstermiĢtir (51). -Kolonoskopi: Kolonoskopi her 10 yılda bir önerilir. Kolonoskopi poliplerin tanısını, çıkarılmasını ve kolon boyunca saptanan kanserlerden biyopsi alınmasını sağlar. Bununla birlikte kolonoskopi diğer testlere göre daha pahalı, daha riskli ve daha rahatsızlık 18 vericidir. Kolon polipleri tanısal amaçlı ya da tarama amacıyla yapılan kolonoskopilerin % 40‘ında bulunur. Kural olarak kolonoskopi esnasında saptanan tüm polipler snare ve elektrokoter yardımı ile çıkarılır (52). -Çift Kontrastlı Kolon Grafisi: 5 yılda bir çift kontrast baryum enema tetkiki yapılması önerilmektedir. Ortalama risk grubundaki olgularda kolorektal kenser riski ya da insidansını azalttığına dair randomize çalıĢmalar yoktur. Sensitivitesi, 1 cm‘den küçük poliplerde % 50-80 iken, 1 cm‘den büyük poliplerde % 70-90 olarak bildirilmektedir. Görülen polipler çıkarılamaz ve kitleden biyopsi alınamaz. Bunun yanı sıra artefakt görme ve diğer bazı bulguları (dıĢkı gibi) polip olarak görme olasılığı daha fazladır. Anormal bulgu saptanan olgularda daha sonra kolonoskopi yapılması gerekir. Tüm kolonu göstermesi, yaygın kullanımı ve yaklaĢık büyük poliplerin yarısını gösterebilmesi nedeniyle alternatif yöntemdir (53). -Sanal Kolonoskopi: Sanal kolonoskopi ya da bilgisayarlı tomografik kolonografi, kolonun bir spiral bilgisayarlı tomografi (BT) ile tarandığı ve oluĢturulan üç boyutlu görüntülerin bir radyolog tarafından gözden geçirildiği yeni bir teknolojidir. Yakın tarihli bir çalıĢma, konvansiyonel kolonoskopiyle kıyaslanabilir bir duyarlılık ( boyutu 6 mm‘den küçük polipler için %88,7‘ye %92,3) göstermiĢtir. Bu prosedürde hasta standart kolon hazırlığı ile hazırlanmakta, hava verilmekte ve bu da hastalar için konforlu bir yöntem olmamaktadır, ayrıca hasta radyasyona maruz kalmaktadır. Bununla birlikte invaziv değildir ve majör komplikasyonları yoktur. AraĢtırmalar dıĢında yaygın taramalar için henüz hazır değildir (54). -Karsinoembriyojenik Antijen (CEA): CEA genel KRK taraması için kullanıĢlı değildir. CEA, kanserlerin yaklaĢık %60‘ı gözden kaçtığı için düĢük bir prediktif değere sahiptir. Akciğer, mide ve pankreas kanserlerinde de değeri yüksek bulunmaktadır. Sigara içenlerde CEA yüksek değerlerde çıkabilmektedir. Ancak, preoperatif evrelemede ve postoperatif takiplerde nüksü belirlemede yararlı olduğu gösterilmiĢtir. (55) -K-ras: K-ras geni, KRK‘lerin % 50‘sinde mutasyona uğramıĢtır ve gaytada saptanması, potansiyel olarak güçlü bir tarama stratejisini yansıtmaktadır. Bu, günümüzün aktif çalıĢma alanlarından biridir (56). 19 Tablo 2.2.Yüksek Riskli Olgularda Kolorektal Kanser Tarama Önerileri (57) Ailesel Risk Kategorisi Tarama Önerileri 1) ≥60 yasında birinci derece yakınında 1) Ortalama risk gibi ancak 40 yasında adenomatöz polip ya da kolorektal kanser baĢlamalı olan ya da ikinci derece yakınında KRK 2) 40 yasında ya da en genç tanı olanlar konan bireyin tanı yasından 10 yıl 2) 2 ya da daha fazla yakınında a kolon önce baĢlayarak her 5 yılda bir kanseri ya da < 60 yasında birinci derece 3) Ortalama risk olarak değerlendirilir yakınında KRK ya da adenomatöz polip 4) 10-12 yaĢlarında baĢlayarak olan bir kiĢi varsa kolonoskopi e, yıllık sigmoidoskopi 3) KRK olan bir 2. derece ya da 3. derece 5) 20 -25 yasında baĢlayarak ya da ilk herhangi bir yakını olanlar b,c tanı konan bireyin tanı yaĢından 10 yıl 4) Gen tasıyanlar ya da FAP için riskli önce baĢlayarak her 1- 2 yılda bir olanlar d kolonoskopi 5)Gen tasıyanlar ya da HNPKK için riskli olanlar a Birinci derece yakınlar anne-baba, kardeĢ ve cocukları kapsar b Ġkinici derece yakınlar büyük anne –baba, teyze –hala ve dayı-amcalardır c Üçüncü d FAP‘ e AAPC derece yakınlar büyük büyük anne – baba ve kuzenlerdir ın altgrupları, Gardner Sendromu, bazı Turcot Sendromlu aileler ‗ de, proksimal kolonik adenomlar sık görüldüğünden kolonoskopi yapılmalıdır. 2.11. Kolorektal Kanserlerin Evrelemesi ve Prognostik Faktörleri 2.11.1.Evreleme Kolorektal karsinomları evrelemede üç farklı sistem kullanılır: - Dukes sistemi - Astler-Coller sistemi 20 - TNM sistemi 1932‘de Dukes rektal karsinomların evrelemesinde yeni bir sistem oluĢturdu ve bu kolon karsinomlarına da uygulandı. Prognozla direkt iliĢkisi olduğundan dolayı bu evreleme sistemi günümüzde pek çok kiĢi tarafından kullanılmaktadır. Bu sistemde sınıflama tümörün derinliği ve lenf bezi tutulumuna göre A,B,C olarak yapılmıĢtır (Tablo 2. 3). 1936 yılında Dukes, kendi sınıflamasını modifiye ederek C evresini C1 ve C2 Ģeklinde ayırmıĢtır (Tablo4). Dukes sınıflaması kolay ve anlaĢılır olması nedeniyle önemini korumaktadır.(58,59) 1954 yılında Astler ve Coller tarafından baĢka bir evreleme sistemi geliĢtirilmiĢtir. Temelde Dukes sistemine benzemekle birlikte, derinlikleri farklı olan tümörlerde lenf düğümü tutulumunu da değerlendirmesiyle farklılık göstermektedir. (Tablo 2. 4) (60,61). Tablo 2. 3. 1932 Dukes evrelemesi Evre A Tümör tüm kolon duvarında sınırlı, muskülaris propriayı aĢmamıĢ. Evre B Tümör tüm kolon duvarını tutup muskülaris propriayı aĢmıĢ, kolonda serozayı invaze etmiĢtir. Lenf bezi tutulumu yok. Evre C Tümör lenf bezi metastazı göstermektedir. Tablo 2. 4. 1936 Dukes evrelemesi Evre A Tümör kolon duvarında sınırlı, muskülaris propriayı aĢmamıĢ Evre B Tümör tüm kolon duvarını tutup muskülaris propriayı aĢmıĢ, kolonda serozayı invaze etmiĢtir. Lenf bezi tutulumu yok. Evre C1 Lenf bezlerinde metastaz yok. Evre C2 Mezenterik kan damarları etrafındaki lenf bezlerinde metastaz mevcut. 21 Tablo2. 5. Modifiye Dukes (Astler-Coller) Sınıflaması Dukes A Tümör mukozaya sınırlıdır. Dukes B1 Muskularis propria tutulmustur. Dukes B2 Seroza veya perirektal yag dokusu tutulmustur. Dukes C1 B1+lenf bezi tutulumu. Dukes C2 B2+lenf bezi tutulumu. Dukes D Uzak metastaz (B3 ve C3: komĢu organ ya da yapılara perforasyon ya da invazyon) ġekil 2.4. Astler-Coller evrelemesi. TNM sınıflamasını kullanan Amerikan BirleĢik Kanser Komitesi (AJCC) kolon kanseri evrelemesi 2003 yılında güncellenmiĢtir. Evre II ve III hastalar bölünerek ayrıca sınıflandırılmıĢ ve vasküler ya da lenfatik invazyonlar dahil edilmiĢtir. Tümör ya da T evresi, tümör boyutunun aksine barsak duvarına penetrasyon derinliğini tanımlamaktadır. AJCC evreleme sistemi, tutulu lenf nodu sayısını sağkalımın önemli bir göstergesi olarak sorumlu tutmaktadır. Dört ya da daha fazla sayıda pozitif lenf nodu veya barsak duvarına gros ve mikroskobik penetrasyon düĢük sağkalıma neden olmaktadır. Bazı evre II hastalar heterojen sonuçlar sergilemektedirler ve yüksek relaps riskiyle, nod pozitif hastalarınkine benzer sonuçlara sahiptirler (40). 22 T= Primer tümör TX: Primer tümörü bilinmeyen T0: Primer tümörü yönünde bulgu yok Tis: Karsinoma in situ T1: Tümör submukozaya invaze T2: Tümör muskülaris propria‘ya invaze T3: Tümör muskülaris propria‘yı subserozaya ya da non-peritonealize perikolik dokuya kadar invaze ediyor pT3a: Muskülaris propria sınırından <1 mm öteye invazyon pT3b: Muskülaris propria sınırından 1-5 mm öteye invazyon pT3c: Muskülaris propria sınırından 5-15 mm öteye invazyon pT3d: Muskülaris propria sınırından >15 mm öteye invazyon T4: Tümör komĢu organ ya da yapılara invazyon göstermekte (pT4a) ve/veya visseral peritonu perfore etmektedir (pT4b). N= Bölgesel lenf bezleri NX: Bölgesel lenf bezleri değerlendirilememekte N0: Lenf bezi metastazı yok N1: 1-3 lenf bezi metastazı mevcut N2: 4 ya da daha fazla lenf bezi metastazı mevcut M= Uzak metastaz MX: Uzak metastaz değerlendirilememekte M0: Uzak metastaz yok M1: Uzak metastaz mevcut Makroskopik olarak diğer organ veya yapılara yapıĢık tümörler T4 olarak sınıflandırılır. Ancak eğer yapıĢıklık yerinde mikroskopik olarak tümör yoksa sınıflandırma pT3 olmalıdır. Vasküler veya lenfatik invazyon varlığı veya yokluğu V ve L alt sınıflamasıyla yapılmalıdır. 23 Perirektal veya perikolik yağlı dokudaki düzgün sınırlı metastatik nodüller lenf nodu metastazı olarak kabul edilmeli ve N evrelemesinde sayılmalıdır. Ancak irregüler sınırlı peritümöral nodüller vasküler invazyon olarak kabul edilirler ve T katagorisinin, mikroskopik vasküler invazyon için V1 veya makroskopik invazyon için V2 alt grubu olarak kodlanmalıdır. Tablo 2. 6. TNM sınıflaması Evre 0 Tis N0 M0 Evre 1 T1-T2 N0 M0 Evre IIA T3 N0 M0 Evre IIB T4 N0 M0 Evre IIIA T1-T2 N1 M0 Evre IIIB T3-T4 N1 M0 Evre IIIC Herhangi bir T N2 M0 Evre IV Herhangi bir T Herhangi bir N M1 Tablo 2. 7. Evrelere göre beklenen ortalama 5 yıllık sağkalım oranları 5 yıllık sağkalım Evre Evre 0-I % 90 Evre II % 70-85 Evre III % 55-70 Evre IV % 10 24 ġekil 2.5. TNM evrelemesi ġekil 2.6. TNM evrelemesinin histopatolojik görüntüsü 25 Tablo 2. 8. TNM evre sisteminde evre gruplaması ve diğer sistemler TNM evre TNM kriteri Dukes Astler-Coller Evre 0 Tis, N0, M0 Evre I T1, N0, M0 A A T2, N0, M0 A B1 Evre II A T3, N0, M0 B B1 Evre II B T4, N0, M0 B B2 Evre III A T1-2, N1, M0 C C1 Evre III B T3-4, N1,M0 C C2/C3 Evre III C Herhangi T,N2,M0 C C1/C2/C3 Evre IV Herhangi T,Herhangi N,M0 D 2.11.2. Prognostik Faktörler CAP (College of American Pathologists; Amerikan Patolojistleri Birliği) kolorektal karsinomada prognostik ve prediktif değeri olduğu düĢünülen faktörlerle ilgili olarak bir bildiri yayınlamıĢtır. CAP tarafından prognostik etkisi olduğu düĢünülen ve çalıĢılan tüm değiĢkenler göz önüne alınarak I‘ den IV‘ e kadar olan kategorilerde sınıflandırmıĢlardır (62). Kategori I; Çok sayıda sağlıklı istatistiksel analiz ile prognostik önemi saptanmıĢ ve yayınlanmıĢ çalıĢmaların olduğu prognostik faktörler. AJCC evreleme sisteminin T,N ve M sınıflamasının tümü, kan veya lenfatik damar invazyonu, küratif cerrahi sonrası rezidüel tümör ve preoperatif CEA yükselmesi de bu kategori içinde değerlendirilmiĢtir. Kategori IIA; Hem biyolojik hem de klinik açıdan çalıĢılmıĢ ve defalarca sonuç açısından prognostik veya prediktif değeri olduğu saptanmıĢ, ancak istatiksel geçerliliği kanıtlanmamıĢ faktörler. Tümör gradı, neoadjuvant tedavi sonrası rezidüel tümör ve tümörün radial sınır durumu. 26 Kategori IIB; Ümit verici, ancak yeterli çalıĢmanın olmadığı prognostik faktörler. Histolojik tip, konak lenfoid yanıtı, MSI‘ in yüksek derecesi (MSI-H), heterozigot INT0114‘ un kaybı, tümör sınırının düzenliliği. Kategori III; Prognostik değerini saptamak için yeterli çalıĢmanın olmadığı faktörler. DNA içeriği, 18q DCC dıĢındaki moleküler belirteçler, perinöral invazyon, mikrodamar dansitesi, tümör hücresi ile iliĢkili protein ve karbonhidratlar, peritümöral fibrozis, peritümöral inflamatuvar cevap, fokal nöroendokrin diferansiyasyon, proliferasyon. Kategori IV; Prognostik önemi olmayan faktörler. Tümör boyutu ve kaba tümör görünümü (gros konfigürasyon ). * T Evresi-- T evresi major bir prognostik markerdır. T4 tümörlerin prognozları kötüdür. T4 klasifikasyonu bitiĢik dokulara tümörün yayılmasını ve visseral periton perforasyonunu içermektedir. Visseral periton tutulumu olan hastaların ortalama sağkalım süresinin bitiĢik dokulara tümör yayılımı olan hastalara göre daha kısa olduğu gösterilmiĢtir. Parietal periton penetrasyonunun nodal tutulumdan daha kötü prognostik faktör olduğu ve TNM evreleme sisteminde revizyon gerektirdiği öne sürülmüĢtür (63). * Lenf Nodu Değerlendirmesi--TNM evreleme sisteminin bir parçası olarak, lenf nodu analizi prognoz hakkında bilgi sağlamaktadır. Ġlginç olarak, nodal tutulumu olmayan hastalar için bile analiz edilen lenf nodlarının sayısı prognostik bilgi sağlamaktadır. Guideline‘lar rezeke edilen örnekte 12 ya da fazla lenf nodunun incelenmesini önermektedir (64). Çünkü daha az rejyonel lenf nodunun incelenmesi nod-negatif ve nodpozitif hastalarda kötü prognoz ile iliĢkilendirilmiĢtir. (64) Daha az rejyonel lenf nodunun incelenmesi tamamlanmamıĢ cerrahi iĢlem ya da patolojik incelemenin yetersiz inspeksiyonu demektir ve tümörün daha düĢük derecelendirilmesine ve adjuvan tedaviden fayda görememesine neden olabilir. National Cancer Database‘in yaptığı geniĢ popülasyonlu bir çalıĢma 35,787 hastada rezeke edilen lenf nodu sayısının sağkalım süreleri ile iliĢkisini araĢtırmıĢtır (63). 1-7 lenf nodu rezeksiyonu yapılan hastalarla karĢılaĢtırıldığında, 8-12 ya da 13‘ten fazla lend nodu eksize edilen hastalarda ölüm riski % 19- 32 daha düĢük saptanmıĢtır. (P < .01) * Lenfovasküler Ġnvazyon--Kötü prognozla ilgili bir histolojik bulgudur. Bu terim endotel ile çevrili damarda tümör hücrelerinin görülmesini tanımlamaktadır. 600‘den fazla 27 hastanın çok değiĢkenli analizinde, lenfovasküler invazyonun rekürrens riskini 2,8 kat artırdığı gösterilmiĢtir. (P < .001) BaĢka bir çalıĢmada, T ve N evresi ile venöz invazyonun kombine edilmesi prognozu belirlemede standart TNM sistemine göre daha iyi performans göstermiĢtir (63). Bu çalıĢmanın sonuçlar üzerindeki belirgin etkilerine rağmen, bu risk faktörünün bildiriminde belirgin heterojenite bulunmakta ve yüksek oranda gözlemciye bağlı varyasyonlar görülmektedir (63). Yine de, lenfovasküler invazyon evre II kolon kanserinde yüksek riski belirlemede klinik olarak kullanıĢlı bir markerdır. * Rezeksiyon bölgesinde rezidüel tümör---Güçlü prognostik değeri olduğu gösterilmiĢtir. R0: Tümör histolojik olarak tamamen negatif sınırla rezeke edilmiĢ. R1: Gros olarak rezeke edilmiĢ, mikroskopik olarak pozitif sınır R2: Gros olarak inkomplet rezeksiyon ile gros pozitif sınır * Tumor Grade---Tümörü yapısal ve gland formasyonu gibi sitolojik özelliklerine göre kategorize edilmesidir. Her ne kadar gradeleme sistemlerinin belli bir standardı olmasa da, çoğu kötü diferansiye ya da indiferansiye tümör grubunu belirlemede yeterli olmaktadır. YaklaĢık 80.000 kolorektal CA hastasını içeren geniĢ çaplı bir çalıĢmada 5 yıllık sağkalım sürelerinin iyi ve orta diferansiye tümörlerde sırasıyla % 51 ve %59‘ken, az diferansiye tümörlerde % 39 olduğu gösterilmiĢtir. (63) Benzer bulgular evre II hastalar için de bildirilmiĢtir. (63) Müsinöz histoloji kötü diferansiye kabul edilir ve iyi-orta diferansiye adenokarsinomalardan daha kötü sonuçlara sahiptir. * Karsinoembriyojenik Antijen (CEA)---Karsinoembriyojenik antijenin ( CEA ) preoperatif yüksek seviyesi kanser rekürrensi için kötü bir prognostik faktördür. CEA seviyesi ile ilgili mevcut veriler değiĢik olmasına rağmen prognostik cut-off olarak saptanan preoperatif düzeyin 5ng/ml üzerinde olması CAP‘ a göre kategori I kötü prognostik faktör olarak kabul edilmektedir. Preoperatif CEA seviyesi yüksek olan hastalarda potansiyel olarak küratif bir cerrahi sonrası normale gelmemiĢse risk artmaktadır. CEA‘ nın bağımsız bir prognostik faktör olduğunu gösteren çalıĢmalar mevcuttur. Preoperatif CEA seviyesinin pognostik öneminin olduğu göz önüne alındığında, operasyon öncesi serum CEA düzeyinin ölçülmesi önerilmektedir. (65) 28 * Histolojik Tip---Kolorektal kanserin birkaç spesifik tipi baĢlı baĢına prognostik önem taĢımaktadırlar. TaĢlı yüzük hücreli karsinomalarda, intrasellüler musin birikimiyle sitoplazma ve nükleusun perifere itilmesi ile oluĢan taĢlı yüzük görünümü hücrelerin %50‘ sinden fazlasında görülmektedir. Bu histolojik tipin prognozu kötüdür. (66) Musinöz karsinomların ( %50 den fazlası musin içeren ) prognostik önemi ise tartıĢmalıdır. Küçük hücreli ( akciğer dıĢı oat cell ) tümörler açık olarak kötü prognostik özellikler gösteren yüksek dereceli nöroendokrin tümörlerdir. Ancak fokal nöroendokrin diferansiyasyonunun prognostik önemi belirsizdir. (CAP kategori III) Ancak fokal olmayan nöroendokrin diferansiyasyonunun kötü prognoz göstergesi olduğu gösterilmiĢtir. (67) Medüller karsinom, glandüler yapı içermeyen ve daha önce undiferansiye olarak sınıflandırılmıĢ farklı büyüme paterni ile karakterize bir alt tiptir. Tipik olarak lenfositlerle ile infiltredir. Bu histolojik alt tip yüksek-MSI ( MSI-H ) ile bağlantılı olarak daha ılımlı prognoz taĢımaktadır. (68) * Konak Lenfoid Yanıtı---Lenfositik infiltrasyon olumlu bir prognostik faktör olarak tanımlanmaktadır ancak bağımsız bir belirteç olup olmadığı belli değildir. Çünkü bu bulgu, iyi bir prognostik faktör olan MSI-H ile birliktelik göstermektedir. (65) * Tümör Sınır Konfigürasyonu---Tümörün sınır yapısı bağımsız bir prognostik faktör olarak görülmektedir. Yapılan çok yönlü bir çalıĢmada tümör sınır yapısının düzensiz olmasının negatif prognostik etki gösterdiği görülmüĢtür. (65) * Obstrüksiyon ve Perforasyon---Obstrüksiyon ve perforasyon ile komplike olan kolorektal kanserlerin daha kötü bir prognoz sergiledikleri kabul edilmektedir. NSABP çalıĢmasında Dukes B ve C kolorektal kanserli 1021 hasta değerlendirilmiĢ ve barsak obstrüksiyonun prognozu oldukça etkilediği görülmüĢtür. Yapılan bir retrospektif değerlendirmede de obstrüksiyonla baĢvuran hastalarda toplam 5 yıllık sağkalım %31 iken, kontrollerde %59 olarak saptanmıĢtır. Lokalize perforasyonu geliĢen hastalarda 5 yıllık sağkalım %44 olarak saptanmıĢ. Gastrointestinal Tümör ÇalıĢma grubunun (GITSG) yaptığı çok yönlü bir analizde de obstrüksiyonun tümörün Dukes evresinden bağımsız 29 olarak önemli bir prognostik faktör olduğunu, perforasyonun da yalnızca hastalıksız sağkalım üzerinde kötü prognostik etki gösterdiğini bulmuĢlardır. (65) * Mikrosatellite Ġnstabilite (MSI): Sporadik kolorektal kanserlerin patogenezinde iki farklı mutasyon yolağı vardır; MSI ve CI yolakları. Mikrosatellitler daha çok dinükleotidler Ģeklinde çok sayıda tekrarlanan nükleotidlerden oluĢan kısa zincirli DNA parçalarıdır. MSI, DNA mismatch repair genlerinin mutasyonları ya da promoter hipermetilasyonu nedeniyle oluĢan DNA replikasyon hataları ve tekrarlayan DNA sekanslarındaki değiĢikliklerden kaynaklanmaktadır. Herediter nonpolyposis kolon CA olan hastaların büyük çoğunluğunda, aynı zamanda sporadik kolon kanseri hastalarının % 15-20‘sinde bulunmaktadır. (64) Genetik destabilitizasyonun bu formu tipik olarak MMR genlerinde bozukluğa yol açmaktadır. HNPKK tümörlerinde MLH-1 ve MSH-2 gibi MMR genlerinde mutasyonlar saptanmıĢtır. Bu genler hatalı onarılan nükleotidlerin proteinlerini kodlarlar. MMR defekti olan tümörlerin fenotipi ‘’ yüksek frekanslı MSI fenotipi ‘’ ( MSI-H) olarak adlandırılmaktadır. Kolorektal kanserli hastaların çoğu (yaklaĢık % 85) tipik olarak LOH (Allelic loss; allel kaybı), kromozomal amplifikasyon ve kromozomal translokasyonları içeren CI yolağı ile geliĢen kanserlerdir. Bunlar mikrosatellitstabil ( MSS ) tümörleri olarak bilinirler. MSI-H tümörleri, düĢük-MSI ( MSI-L) veya MSS kolorektal tümörlerden göreceli olarak farklılıkları taĢırlar. MSI-L ve MSS tümörleri benzer davranıĢ gösterme eğilimindedirler. MSI-H tümörler daha çok sağ tarafa yerleĢim gösterirler. Yüksek grad ve musinöz tipte olma eğilimindedirler. Karakteristik olarak peritümöral lenfositik infiltrasyonda artıĢ vardır ve diploid yapı göstermektedirler. Buna karĢılık MSS tümörleri anoploid yapıdadırlar. MSI-H kolorektal kanserli hastaların tanı esnasında, primer tümörlerinin geniĢ olma ve nod negatif olma olasılığı daha fazladır. MSI-H kolorektal kanserli hastaların uzun dönemdeki prognozu eĢ evredeki MSS kolorektal kanserli hastalardan daha iyidir. (69) * 18q Allel Kaybı ( DCC gen kaybı )--- Allel kaybı (LOH) tüm kolorektal kanserlerin yarısından fazlasında ortaya çıkan 18 kromozomun uzun kolundaki kayıptır. 18q allel kaybı tipik olarak DCC (deleted in colon cancer ) genini kapsar. Deleted in colon cancer (DCC) proteini bu kromozom tarafından kodlanmaktadır. (63) DCC gen ekspresyonu birçok kolorektal kanserde büyük ölçüde azalmıĢ veya yoktur. DCC‘ nin kaybı metastaz ve 30 kötü prognoz ile iliĢkilidir. DCC geninin spesifik ürünü Netrin-1 reseptörü olduğu saptanmıĢtır. Normal durumlarda bu reseptör nöronal aksonların göçüne aracılık etmektedir. Netrin-1 bağlanması olmadığında DCC apopitozisi uyarmaktadır. Bağlanma olduğunda ise apoptozis bloke olur. 18q allel kaybı sonucu olarak DCC kaybı olması ve apoptozisin bozulması beklenebilir. Böyle durumda ise kemoterapiye direnç geliĢmesi söz konusu olmaktadır. Watanabe ve arkadaĢları Natioal Ġntergroup Adjuvant çalıĢmalarından ( INT 0035 veya INT 0089 ) birinde tedavi almıĢ hastaların patolojik tümörlerinde potansiyel prognostik bir belirteç olarak 18q allel kaybını değerlendirmiĢler. MSI durumu ve 17p, 8p ve p53 ile p21WAF1 / CIP1 proteinlerin seviyelerini de değerlendirilmiĢ. 18q allel kaybı hastaların %49‘ unda saptanmıĢ. 18q allel kaybı olan evre III tümörlü hastalarda 5 yıllık sağkalım %50 iken, allel kaybı olmayanlarda ise %69 olarak bulunmuĢ (p=0,005). Bu analizde diğer markerlerde değerlendirilmiĢ ve prognostik önemleri görülmemiĢtir. (70) Evre II ve evre III kolon kanserli 118 hasta üzerinde yapılan diğer bir çalıĢmada ise 18q allel kaybının kötü prognostik etkisi olduğu bulunmuĢtur. Evre II olan hastalarda 5 yıllık hastalıksız sağkalım %54 olarak saptanmıĢ. 18q allel kaybı olmayan Evre II olanlarda ise daha iyi klinik sonuçlar elde edilmiĢ ve 5 yıllık hastalıksız sağkalım %96 olarak saptanmıĢtır. Çok yönlü yapılan bir analizde de 18q allel kaybının hem 5 yıllık hastalıksız sağkalım hem de tüm sağkalım üzerinde kötü prognostik etki gösterdiği belirlenmiĢtir. (71) * DĠğer Molecular Markerların Değerlendirilmesi—p53, PIK3CA ve KRAS mutasyonları ve vasküler endotelial growth faktör, laktat dehidrogenaz ve telomeraz ekspresyonunun, erken evre kolon kanser çalıĢmalarında prognostik olarak anlamlı olduğu gösterilmiĢtir. Ancak, klinikte kullanılabilmeleri için ileri değerlendirmeler gerekmektedir. (63) Molecular markerlar histolojik markerlardan bağımsız değildir. Örneğin, tümör lenfositik infiltratı daha iyi sonuçlarla iliĢkilidir ve MSI tümörlerinde daha sık görülmektedir. Benzer olarak, 18q LOH vasküler invazyon için yeterli gibi görünmektedir. (63) GeliĢmekte moleküler tekniklerin baĢarısı, mevcut patolojik tekniklerden daha fazla prognostik baĢarı sağlayacak gibi görünmektedir. * Perinöral Ġnvazyon---Daha önce yapılan çalıĢmalarda perinöral invazyonla rekürrens riskinin arttığı ve 5 yıllık sağkalımda kötüleĢme olduğu ileri sürülmüĢtür. Çok yönlü 31 yapılan analizlerde ise perinöral invazyonun prognostik öneminin yeterli düzeyde olmadığı görülmüĢtür. * Tümör Büyüklüğü ve Konfigürasyonu---Yapılan çalıĢmalarda hem tümör büyüklüğünün hem de konfigürasyonunun prognostik önem taĢımadığı gösterilmiĢtir. Yayınlanan bir derlemede 319 hasta incelenmiĢ ve Dukes B2 olan tümörlerinin ortalama çapı C2 (p<0.001 ) ve D (p<0.05 ) olan tümörlerden daha büyük olarak saptanmıĢ. Ancak 5 yıllık sağkalıma etkisi olmadığı saptanmıĢtır. Tümör konfigürasyonu ekzofitik ( mantarımsı ), endofitik ( ülseratif ), diffüz infiltratif ( linitis plastika ) veya annüler olarak tanımlanmaktadır. ÇalıĢmaların çoğunda bu konfigürasyonların hiç birisinin bağımsız prognostik önem taĢımadığı gösterilmiĢtir. (65) * Hemoraji ve Rektal Kanama---Kanama ile kendini gösteren tümörlerin, daha erken saptandığı ve bu nedenle daha iyi bir prognozla seyredebilecekleri belirtilmiĢtir. Ancak verilerle bu doğrulanmamıĢtır. Yapılan bir geniĢ çalıĢmada tek yönlü analiz ile prognostik önemi gösterilmesine rağmen, çok yönlü analizlerde gösterilmemiĢtir. Sonuç olarak, kanamanın prognostik önem taĢımadığı görülmektedir. (65) * Primer Tümör YerleĢim Yeri---NSABP verilerine göre sağ tarafa yerleĢen tümörlerin sola yeleĢen tümörlerden daha kötü prognoz gösterdikleri ileri sürülmüĢtür. Ancak bazı çalıĢmalarda da solda yerleĢim gösterenlerin daha kötü prognoz sergiledikleri bildirilmiĢtir. Birkaç çalıĢmada ise primer tümör lokalizasyonun prognostik önemi olmadığı gösterilmiĢtir. (65) Prognostik faktörler sık olarak bildirilmektedir ancak, tedavi sonrası verimliliği öngören faktörleri belirlemek çok daha zordur. Bir markerın prediktif ve prognostik karakterinin ayrımı tedavi edilen ve edilmeyen hastalardan örnek alınmasını gerektirmektedir. Kötü prognozu göseren markerların her zaman tedaviye yanıtı belirlememesi nedeniyle, bu durum çoğu çalıĢmanın kritik limitasyonudur. 32 2.12. Tedavi 2.12.1. Cerrahi Tedavi Kolorektal kanserlerin primer tedavisi cerrahidir. Cerrahi ile hastaların %50‘sinde kür saglanabilmektedir. Cerrahide temel ilke, tümörlü kısım ile birlikte proksimal ve distal normal barsak bölümünü, vasküler yapıları ve lenf bezlerini içeren barsak mezosunu çıkarmaktır. Yeterli bir lenf nodu diseksiyonundan bahsedebilmek için ortalama 12-14 lenf nodu rezeke edilmelidir. Radikal ve palyatif cerrahi olmak üzere iki temel cerrahi yaklasım sekli vardır. Radikal cerrahi, tümörün saglam barsak kısmı ve mezosu ile birlikte genisçe çıkarılmasıdır. Palyatif cerrahi ise sınırlı rezeksiyon, by-pass veya kalıcı stoma uygulamalarını kapsamaktadır. (72, 73, 74)Peritoneal yayılım, batında asit varlığı, çok sayıda hepatik metastaz varlığı ve çok sayıda pulmoner metastaz varlığında palyatif cerrahi tedavi yapılır. Ancak; soliter akciğer ve karaciğer lezyonlarıında küratif rezeksiyon yapılması doğru bir yaklaĢımdır. Karaciğer ve akciğerde rezektabl metastaz geliĢmiĢ olan seçilmiĢ hastaların %25-40‘ında cerrahi küratifdir. Günümüzde kolon tümörlerinin rezektabilitesi %92, kür amaçlı yapılan operasyonlarda ölüm oranı %2‘dir. Cerrahi sonrası 1. yıl içindeki endoskopik kontrol, olabilecek cerrahi sınır nükslerinin saptanmasında önemlidir. (75, 76) Tümörün lokalizasyonuna göre uygulanan cerrahi yöntem farklılıklar göstermektedir; Çekum tümörlerinde; sag hemikolektomi Çıkan kolon tümörlerinde; sag hemikolektomi Transvers kolonun sag yarısındaki tümörlerde; genisletilmis sag hemikolektomi Transvers kolonun ortasında yerleĢen tümörlerde; genisletilmis sag hemikolektomi ve transvers kolon rezeksiyonu Transvers kolonun sol yarısındaki tümörlerde; genisletilmis sol hemikolektomi Ġnen kolon yerlesimli tümörlerde; sol hemikolektomi Sigmoid kolon tümörlerinde; sigmoid kolon rezeksiyonu Metakron kolon tümörlerinde; total kolektomi (ancak tümörlerin yerlesim yerine göre cerrahi teknik degisebilir) Rektumda lokalize kanserlerin cerrahisi ise daha farklıdır. Üç farklı yöntem uygulanabilmektedir. Bunlar; "low anterior rezeksiyon" (LAR), "abdominopelvik rezeksiyon" (APR) ve "koloanal anastomoz ile birlikte total proktektomi" olarak 33 sıralanabilir. Rektumda lokalize kanseri olan hastalar için yasam kalitesi açısından en önemli nokta sifinkterin korunmasıdır. (72) 2.12.2. Radyoterapi Kolorektal kanserlerde, primer tedavi cerrahi olmasına ragmen, tek basına cerrahi ile elde edilen sonuçların yüz güldürücü olmaması, adjuvan tedavileri gündeme getirmistir. Kolon kanserinde radyoterapinin yeri olmamakla birlikte rektum kanserlerinin tedavisinde önemli yer tutmaktadır. (72) Rektum Kanserinde Radyoterapi Rektum pelvis içinde yer almakta ve anal dentat çizginin tranzisyonel mukozasından sigmoid kolona kadar uzanmakta, rigid sigmoidoskopi ile anal kenardan 10-15 cm ölçülmektedir. Pelvisin kemik yapıları rektuma cerrahi eriĢilebilirliği kısıtlamakta ve negatif sınırlara ulaĢmayı engelleyerek, lokal rekürrens riskini artrırmaktadır. ArtmıĢ lokal rekürrens riski nedeniyle, rektal CA‘nın lokal tedavisi kolon kanserinden farklıdır. Lokal nüks oranları; T1-2N0M0 tümörlerde %10‘dan az olup T1N1M0 ve T3N0M0 tümörlerde %15-35, T3-4N1-2M0 tümörlerde ise %45- 65‘tir. Lokal nüks oranlarının yüksek olması nedeniyle cerrahi tedaviye ek olarak preoperatif veya postoperatif dönemde radyoterapi uygulanmaktadır. (77) Preoperatif Radyoterapi: Rektum kanserlerinde preoperatif dönemde uygulanan radyoterapinin faydaları; cerrahi sırasında olusacak tümör hücre ekilmesinin önlenmesi, radyoterapiye duyarlılıgın artması, tümör hacminin küçültülmesi ve bu sayede rezektabilitenin artması, ince barsak komplikasyonlarının postoperatif radyoterapiye oranla daha az olması ve abdominoperineal rezeksiyon operasyonu yerine sifinkter koruyucu bir cerrahi girisime olanak saglamasıdır. (78, 79) Postoperatif Radyoterapi: Postoperatif radyoterapinin avantajları; patolojik evrenin bilinmesi, cerrahi sırasında tümör yatagına konulan klipslerin yardımı ile tümör yatagının belirlenmesi ve böylece "boost" dozunun sınırlı bir alana verilmesinin saglanmasıdır. Dezavantajları ise hipoksik bir ortamın yaratılması, radyoterapi alanı içine ince barsak segmentlerinin girmesi, APR uygulanan hastalarda perineal skarın saha içine dahil edilmesi gerekliliği nedeniyle sahanın büyük tutulmasıdır. (80) Preoperatif ve postoperatif 34 radyoterapinin karĢılaĢtırıldığı bir çalısmada; T3 veya N1-N2 hastalar randomize edilerek preoperatif veya postoperatif radyoterapi verilmiĢtir. Preoperatif dönemde radyoterapi alan hastalarda lokal nüks oranı postoperatif döneme göre oldukça azalmıs fakat 5 yıllık sagkalımda önemli bir fark saptanmamıĢtır. (81) Radyoterapinin konkomitant olarak 5-FU ile birlikte uygulanması ile postoperatif radyoterapi alan hastalarda genel sagkalımda ve lokal kontrol açısından daha iyi sonuçların elde edildigi çalıĢmalar da mevcuttur. Özellikle 5-FU infüzyonel olarak uygulandıgında bolus uygulamaya göre hastalıksız ve genel sagkalımda daha iyi sonuçların elde edildiği görülmüĢtür. (82) 2.12.3. Kemoterapi Adjuvan tedavi primer tümörün rezeksiyonu sonrası, kalmıĢ olabilecek okkült, canlı tümör hücrelerini elimine ederek hastanın sağkalım süresini uzatmayı amaçlayan uygulanan tedavidir. Adjuvant kemoterapinin kullanılabilmesi için, kullanılan ajanların tümör hücrelerini etkin bir Ģekilde eradike edebilmesi ve risk-yarar oranının göz önünde bulundurulması gerekmektedir çünkü adjuvan tedavi alan çoğu hasta zaten cerrahi ile tedavi edilmiĢtir. ABD‘de kolorektal CA mortalitesindeki azalma artmıĢ surveyans çalıĢmaları ve adjuvan tedavideki geliĢmelere bağlanmıĢtır. Ancak, kolon CA dünya çapında majör bir ölüm nedeni olmaya devam etmektedir. Adjuvant kemoterapinin kulanımı için karar hastanın hastalık evresi ve tedavi ile beklenen risk azalıĢı ile belirlenen rekürrens riskine dayanarak belirlenir. Standard TNM evreleme sistemine göre Evre I hastaların rezeksiyon sonrası kür Ģansları yüksektir ve adjuvan tedavi ek fayda sağlamayacaktır. Evre II kolon kanserlerinde potansiyel küratif cerrahi rezeksiyon yapılmalıdır. Rutin adjuvan kemoterapi önerilmemektedir. 5-FU+Folinik asit (FA) (Mayo rejimi, 6 kür) tedavisi ile %2 oranında hastalıksız sağkalım avantajı gösterilmistir. Fakat evre II kolon kanserli hastalarda potansiyel küratif cerrahi sonrasında adjuvan kemoterapi kullanımı konusunda tam bir uzlası yoktur. Evre III kolon kanserlerinde potansiyel küratif cerrahi rezeksiyon yapılmalıdır. Akabinde 6 ay süre ile adjuvan kemoterapi uygulanmalıdır. Her ne kadar terminoloji lokalize metastazın rezeksiyonu sonrası verilen kemoterapiyi tanımlamak için kullanılsa da, adjuvan tedavi evre IV (metastatic) kanser için uygun bir seçenek değildir. (63) Evre IV kolon kanserli ve baĢlangıçta metastazlı olan hastalarda tedavi Ģu sekilde özetlenebilir; 35 1- Ġzole karaciger metastazında lezyon basit wedge rezeksiyon veya segmentektomi ile çıkartılabiliyorsa aynı seansta primer tümör ve metastazın rezeksiyonu yapılabilir. Karaciger metastazı çıkarılamayan hastalarda, hastanın klinik tablosuna göre primer tümöre yönelik palyatif cerrahi giriĢim yapılabilir. Hastalar daha sonra kemoterapi açısından degerlendirilmelidir. 2- Over metastazları primer tümör cerrahisi sırasında çıkarılmalıdır. Bu hastalar daha sonra kemoterapi açısından değerlendirilirler. 3- Ġlk cerrahi sırasında çıkarılmayan operabl karaciger metastazları ve/veya akciger metastazları kısa süre (1-3 ay) sonra ikincil giriĢimlerle tedavi edilir. Bekleme esnasında kemoterapi verilir. Ġkincil girisim öncesi tekrar genel değerlendirme (klinik ve radyolojik) yapılır. 4- Kemoterapi, tolere edebilecek hastalarda uygulanmalıdır. 5- Palyatif radyoterapi, kanama, tıkanma veya ağrıyı hafifletmek için yapılabilir. 6- Potansiyel küratif karaciğer metastazlarının rezeksiyonundan sonra ek sistemik tedavinin rolü henüz kesinleĢmiĢ değildir. (83, 84) Kemoterapinin kolon kanserindeki kullanımı fluorouracil (5-FU) ve antihelmintik ajan levamisolün rezeksiyon sonrası genel sağkalım oranlarında artıĢa neden olduğunun gösterildiği 1990‘a dayanmaktadır. Bu bulgu 1994‘te 5-FU ile leucovorin (LV)‘in kombine edildiği bir çalıĢma ile doğrulanmıĢtır. 1998‘de 5- FU/LV‘ün 5-FU/levamisol‘e üstünlüğü gösterilmiĢ ve levamizol kullanımı bırakılmıĢtır. 2003‘te oxaliplatin (Eloxatin) ve 5FU/LV kombinasyonunun tek baĢına 5-FU/LV‘ten daha üstün olduğu gösterilmiĢtir ve daha sonra oral ajan capecitabinin (Xeloda) etkinliğinin iv 5-FU/LV‘e denk olduğu gösterilmiĢtir. Evre III kolon kanseri üzerine güncel çalıĢmalar capecitabinin kombinasyon rejimlerine entegrasyonunu ve adjuvan tedavilere monoklonal antikor eklenmesini araĢtırmaktadır. 36 Fluoropyrimidinler Intravenöz Fluorouracil Fluorouracil kolorektal kanserinde sistemik tedavinin köĢe taĢını oluĢturmaktadır. Pirimidin nükleotid sentezinde hız kısıtlayıcı bir enzim olan timidilat sentetazı inhibe ederek etki eden fluorine olmuĢ bir pirimidindir ve fluorourasilin bu enzimle etkileĢimini stabilize ettiği düĢünülen indirgenmiĢ bir folat olan lökovorinle birlikte uygulanır.(64) 19 randomize çalıĢma ile 3300 hastanın değerlendirildiği bir meta-analizde fluorourasil ile birlikte lökovorin uygulamasında kolorektal kanserinde %50‘den fazla tümör küçülmesi ve tek baĢına fluorourasil ile karĢılaĢtırıldığında sağkalım oranlarında orta derecede ancak istatistiksel olarak anlamlı artıĢ olduğu görülmüĢtür. Fluorourasil ve lökovorin alan metastatik kolorektal kanserli hastaların yaklaĢık % 20‘sinde tümör boyutunda %50‘den fazla azalma görülmüĢ ve ortalama sağkalım oranı yaklaĢık 6 aydan 12 aya çıkmıĢtır (64). Fluorouracil değiĢik toksisite profilleri olan değiĢik tedavi Ģemaları Ģeklinde uygulanabilir. Neutropeni ve stomatit 4-5 haftalık süre içinde her 5 günde bir uygulanan bolus fluorourasil ve leucovorin tedavisinde en sık görülen yan etkilerdir (Mayo Clinic rejimi). Bolus fluorourasil ve leucovorinin 6-8 hafta süreyle uygulanması sonucu (Roswell Park rejimi) daha yüksek oranda diyare görüldüğü bildirilmiĢtir. Fluorourasili sürekli infüzyon olarak veren rejimler daha az hematolojik ve GIS toksisite ile iliĢkilidir ancak daha yüksek oranda el-ayak sendromu (avuç içi ve ayak tabanlarını içeren eritametöz döküntü) görülmektedir. Her ne kadar tedavi programları önceden bolus uygulamalara göre daha az güvenilir ve pahalı olduğu için tercih edilmeyen fluorourasili içerse de, bu 2 rejim ile sağlanan yaĢam kalitesi arasında az fark olduğu görülmüĢtür. Ayrıca, 6 randomize çalıĢmanın metaanalizi; infüzyonel fluorourasil alan metastatik kolorektal kanserli hastaların yanıt oranı ve ortalama sağkalım sürelerinde, bolus tedavi uygulanan hastalar göre orta derecede iyileĢme görülmüĢtür. (64) Oral Fluoropyrimidinler Fluoropyrimidinleri oral uygulama giriĢimi baĢarısız olmuĢtur. Oral ve intravenöz fluorouracilin metastatik kolorektal kanserli hastalarda karĢılaĢtırıldığı randomize bir çalıĢma IV uygulamanın yanıt oranı ve süresini daha olumlu etkilediği sonucuna varmıĢtır. (64) Yanıt oranlarındaki bu farklılıkların ilacın katabolik enzimi dihidropirimidin 37 dehidrogenazın mukozal konsantrasyonundaki değiĢikliklere bağlı fluorourasilin intestinal emilimindeki dengesizlikten kaynaklandığını düĢünülmektedir. Bu problemi çözmek için 2 strateji kullanılmıĢtır: dihidropirimidin dehidrogenaz tarafından katabolize olmayan emilebilir bir fluorourasil önilaç uygulanması ve oral fluorourasil ile birlikte dihidropirimidin dehidrogenaz inhibitörünün verilmesi. (64) Capecitabine (Xeloda; Roche, Nutley, NJ) oral fluorouracilin ön ilacıdır ve gastrointestinal mukozadan emilerek 3 basamaklı enzimatik reaksiyon ile fluorouracile dönüĢtürülür. Yan etki profili fluorouracilin sürekli infüzyonu ile benzerdir ve el ayak sendromu sıklıkla görülür. ÇalıĢmalar metastatik kolorektal kanserinde baĢlangıç tedavisinde capecitabinin bolus fluorouracil ve leucovorin (Mayo Clinic Rejimi) uygulamasına terapötik olarak denk olduğunu göstermiĢtir ve ortalama tümör progresyonsuz sağkalım ve genel sağkalım oranında belirgin farklılık saptanmamıĢtır (64). Tegafur uracil (Orzel; Bristol-Myers Squibb, New York, NY) fluorouracilin intestinal emilimini engelleyen oral fluoropyrimidin (tegafur)‘in dihydropyrimidine dehydrogenase inhibitörü (uracil) ile birlikte uygulanarak tegafurun daha iyi absorbsyon ve biyoyararlanımını sağlamaktadır. Metastatik kolorektal kanserli hastaların araĢtırıldığı 2 randomize çalıĢmada tegafur+ uracil ve oral leucovorinin yanıt oranı ve ortalama sağkalım süresi açısından parental fluorouracil ve leucovorinle benzer olduğu gösterilmiĢtir (64). Her ne kadar capecitabinin önerilen dozun (günde 2 sefer 1250 mg/m2) terapötik etkisi aylık bolus fluorouracil ve leucovorin uygulamasıyla aynı gibi görünse ve toksisite profili daha hafif olsa da, capecitabine ile parenteral fluorourasil uygulaması (Roswell Park ya da infüzyonel Ģema) karĢılaĢtırıldığında toksisite profilindeki bu değiĢikliğin devam edeceği kesin değildir. Ayrıca, capesitabinin oxaliplatin ve irinotecan gibi diğer iv kemoterapilerle verildiği güncel çalıĢmaların sonuçları tek ajan capesitabin için bildirilen güvenilirlik ve cost-efektiviteyi sorgulamaktadır. (64) Irinotecan Irinotecan carboksilesterazlarla SN-38‘e dönüĢtürülen (Camptosar; Pfizer, New York, NY) natural alkaloid camptothecinin semisentetik derivatividir. DNA replikasyonu esnasında DNA‘nın kırılma ve yeniden birleĢmesini katalize eden Topoisomerase I‘i inhibe ederek SN-38 DNA fragmentasyonuna ve programlı hüre ölümüne neden olur. (64) SN-38 38 metabolizması baĢlıca karaciğerde gerçekleĢir ve glukronidasyon ile inaktive olarak biliyer sisteme atılır. SN-38‘in glukronidasyonundan sorumlu olan Uridine diphosphate glucuronosyltransferase isoform 1A1 (UGTA1A) genindeki polimorfizm SN-38‘in inaktivasyonunu azaltmakta ve tedaviye bağlı toksisitede artıĢa neden olmaktadır. Genetic polymorphism için bir tanı testi mevcuttur ancak klinikte yaygın olarak kullanılmamaktadır. ArtmıĢ serum bilirubin düzeyleri de artmıĢ irinotekana bağlı toksisite ile iliĢkilidir ve bu ilaç tipik olarak hiperbilirubinemisi olan hastalara uygulanmamaktadır. Ġrinotekana bağlı en sık ishal, myelosupresyon ve alopesi görülmektedir (64). Randomize çalıĢmalar progresyonsuz ve genel sağkalım sürelerini olumlu etkilediğini göstermiĢtir. Ġrinotekanın metastatik kolorektal kanserli hastaların baĢlangıç tedavilerinde infüzyonel (FOLFIRI) ya da bolus(IFL) fluorouracil ve leucovorin çalıĢmalarına eklenmesinin progresyonsuz ve genel sağkalım oranında artıĢa yol açtığı gösterilmiĢtir (64). FOLFIRI, IFL ve irinotecan artı capecitabini karĢılaĢtıran güncel bir randomize çalıĢmada, FOFIRI alan hastaların daha uzun progresyonsuz ve genel sağkalım oranına sahip olduğunu göstermiĢtir ve infüzyonel yaklaĢımın üstünlüğü görülmüĢtür (85). Ayrıca, irinotecan artı capecitabine içeren rejimlerin, iv fluorourasil içeren rejimler ile karĢılaĢtırıldığında 2 kat daha fazla ciddi kusma, diyare ve dehidratasyon ile iliĢkili olduğu görülmüĢtür. Metastatik kolon kanserli hastalarda irinotekan ile yüz güldürücü sonuçlara dayanarak, irinotekanın kolon kanseri için adjuvan tedavi programlarına eklenmesinin efektif olacağı beklenmektedir. Adjuvan irinotekanın bolus ya da infüzyonel fluorourasil ve lökovorin ile yapılan 3 randomize çalıĢma bu önermeyi incelemiĢtir (86). ġaĢırtıcı bir Ģekilde, bu çalıĢmalardan her biri, irinotekan alan hastalarda tedavide anlamlı bir düzelme olmadan toksisitede artıĢ olduğunu göstermiĢtir. Ġrinotekanın adjuvan tedavideki bu beklenmeyen baĢarısızlığı iyi açıklanamamıĢtır. Ancak klinik pratikte değiĢiklik yapmadan önce randomize klinik çalıĢmaların yapılması gerektiğinin önemini hatırlatmıĢtır (64). Oxaliplatin Oxaliplatin (Eloxatin; Sanofi-Aventis, Bridgewater, NJ) DNA ile bileĢikler oluĢturan ve bozulmuĢ DNA replikasyonu ve sellüler apoptoza neden olan diaminocyclohexane platinum bileĢikleridir. Metastatik kolon CA olan hastalarda tek ajan oxaliplatin verimliliği kısıtlıdır ancak fluorouracil ve leucovorin ile birlikte uygulandığında klinik yarar 39 sağlanmıĢtır. (64) Muhtemelen bu durum oxaliplatin ile indüklenmiĢ thymidylate sentetazın down regülasyonu sonucudur. El ve ayaklarda paresteziler ile karakterize olan kümülatif duyusal nöropati oxaliplatin ile iliĢkili primer toksisitedir. Metastatik kolorektal kanserli hastaların araĢtırıldığı 2 randomize klinik çalıĢmada oxaliplatinin infuzyonel fluorouracil ve leucovorine (FOLFOX) eklenmesi tümör yanıt oranlarını ve hastalıksız sağkalım oranlarını artırmıĢ ve sağkalım sürelerinde olumlu değiĢikliklere yol açmıĢtır (87). Daha ileri çalıĢmalar oxaliplatin ve irinotecan içeren kombinasyonları araĢtırmıĢtır. Yeni tanı almıĢ metastaik hastalığı olan hastaların araĢtırıldığı bu çalıĢmalardan birinde, FOLFOX IFL ya da irinotecan ve oxaliplatin kombinasyonları ile karĢılaĢtırıldığında progresyonsuz ve genel sağkalım oranlarında uzama ile iliĢkili bulunmuĢtur (88). Bu sonucun infüzyonel fluorourasil‘in (FOLFOX‘da dahil edildiği gibi) bolus fluorourasil‘e (IFL‘ye dahil edildiği gibi) üstünlüğünden etkilenmiĢ olabilmesi nedeniyle, 2 ileri çalıĢma oxaliplatin ve irinotecan kombinasyonlarını infüzyonel fluorouracil Ģemasıyla karĢılaĢtırmıĢtır (89,90). Bu çalıĢmaların her ikisinde de tümör yanıt oranları, progresyonsuz sağkalım ve genel sağkalım oranları, birinci basamak tedavi olarak FOLFOX ya da FOLFIRI alan hastalarda istatistiksel olarak ayırtedilememektedir. Her üç ilacı da —fluorouracil, oxaliplatin ve irinotecan—alan hastaların ortalama genel sağkalım süresi yaklaĢık 20 aydır (89,90). Güncel randomize çalıĢmalar capecitabinin metastatik hastalığı olan hastalarda baĢlangıç tedavisi olarak fluorouracil ve leucovorin oxaliplatinle kombinasyonlarının yerini alıp alamayacağını araĢtırmıĢtır. Bu çalıĢmalar her 2 kombinasyonun benzer terapötik fayda ve toksisiteye sahip olduğunu ancak, capecitabin içeren rejimlerin daha yüksek maliyetli olduğunu göstermiĢtir (64). Irinotekanla olan deneyimlerin aksine, 2 randomize çalıĢma adjuvan tedaviye oxaliplatin, fluorourasil ve lökovorine eklendiğinde hastalıksız sağkalım sürelerinde artıĢ olduğu görülmüĢtür (64). Angiogenez Inhibitorleri Malign proliferasyon ve yayılımın kontrol edilmesinde daha güncel bir strateji neoangiogenezin, yani yeni damar oluĢumunun inhibisyonunu içermektedir. Günümüzde, en baĢarılı anti-anjiogenik strateji kan damarı proliferayonunu stimüle eden vasküler endotelial growth faktör üzerine yoğunlaĢmıĢtır (64). 40 Bevacizumab (Avastin; Genetech, South San Francisco, CA) ilerlemiĢ kolorektal kanser hastalarında kemoterapi ile birlikte değerlendirilen vasküler endotelial growth faktörü hedef alan humanize monoklonal antikordur. En sık görülen 2 toksisite reverzibl hipertansiyon ve proteinüridir. Nadir görülen ciddi yan etkiler %1- 2 barsak perforasyonu, %3 ciddi kanama, %2- 3 arteriel embolik hadise ve %1‘den az görülen reversible posterior leukoencephalopathy sendromudur (64). Bevacizumab üzerinde yapılan ilk çalıĢmalarda fluorouracil and leucovorin‘e eklendiğinde metastatik kolorektal kanserli hastalarda tümör cevap oranı ve progresyonsuz surveyde artıĢ gözlenmiĢtir. Takip eden randomize çalıĢmalarda bevacizumabın baĢlangıç tedavisi olarak (64) IFL ve FOLFOX ile kombine edildiğinde ortalama sağkalım süresinde artıĢa yol açtığı gösterilmiĢtir. (20,3 vs 15,6 ay). Ġleri çalıĢmalar tedavi edilmemiĢ metastatik kolorektal kanser hastalarında bevacizumabın FOLFIRI ya da FOLFOX‘a eklenmesinin yanıt oranlarında ve sağkalım sürelerinde artıĢa neden olduğunu teyit etmiĢtir (85). Metastatik kolorektal kanserli hastalarda bevacizumabın etkinliği göz önünde bulundurulduğunda, adjuvan tedavideki rolü pek çok randomize çalıĢmada araĢtırılmaktadır. ABD‘de National Surgical Adjuvant Breast and Bowel Project‘in C-08 çalıĢmalsında evre II ve III kolon kanserli hastaları FOLFOX‘ta bevacizumab alan ve almayanlar olarak randomize etmektedir. Benzer bir çalıĢma Avrupa‘da oxiplatin içeren rejimler için yapılmaktadır. Ayrıca, ECOG araĢtırmacıları yüksek risk evre II kolon kanserli hastalarında FOLFOX ve FOLFOX‘un karĢılaĢtırıldığı büyük, randomize bir çalıĢmaya moleküler markerları dahil etmiĢtir. Bu çalıĢmanın sonuçları elde edilinceye kadar, becavizumabın kolon CA programlarında adjuvan tedaviye dahil edilmesini önermek için erkendir (64). Epidermal Growth Factor Reseptör Ġnhibitörleri Epidermal growth factor reseptörü (EGFR) hücre büyümesi, proliferasyon ve programlı hücre ölümünü etkileyen sinyal yolaklarıyla etkileĢime giren bir transmembran glikoproteindir ve kolon, akciğer, meme, baĢ ve boyunu içeren pek çok dokunun malignensisinde eksprese olmaktadır (64). Kolorektal kanserlerinde tümör hücresi yüzeyinde EGFR ekspresyonu, tümörlerin % 80‘e yakınında bulunmaktadır ve EGFR eksprese eden tümörler daha kötü progresyona sahiptir.(91) EGFR‘nin ekstrasellüler kısmını hedef alan antikorlar ve tirozin kinazın intrasellüler kısmının küçük moleküler inhibitörleri bu transmembran reseptörünün fonksiyonlarını inhibe etmektedir. 41 ġu ana kadar sadece anti-EGFR monoklonal antikorlarından cetuximab (Erbitux; ImClone Systems, Brachburg, NJ) ve panitumumab (Vectibix; Amgen, Thousand Oaks, CA), kolorektal kanserinde kesin olarak etkin olmuĢtur. (92) Her ne kadar erlotinib (Tarceva; Genetech) gibi EGFR‘nin intrasellüler tirozin kinazın parçasının küçük molekül inhibitörleri diğer solid tümörlerde baĢarı gösterse de, kolorektal kanserli hastalarda inaktif gibi görünmektedir. (64) Progresyon gösteren hastalar üzerinde yapılan bir çalıĢmada fluoropyrimidine, irinotecan, oxaliplatin ve haftalık cetuximab tedavisi ile progresyonsuz ve genel sağkalım üzerinde sadece destek tedavisi alan hastalara göre artıĢ görülmüĢtür (64). Ġrinotekana dirençli metastatik kolorektal kanserli hastalarda cetuximab üzerinde yapılan diğer çalıĢmalar tek baĢına cetuximab ile yaklaĢık % 10 tümör cevabı, cetuximab ve irinotecan ile % 20 tümör cevabı olduğunu göstermiĢtir (64) Bu durum cetuximabın irinotekan rezistan tümör hücrelerinin direncini kırabileceğini düĢündürmektedir. Cetuximab tedavisinin en önemli yan etkileri akneiform döküntü, hipomagnezemi, infüzyon reaksiyonlarıdır. Cetuximab infüzyonu alan hastaların yaklaĢık %3‘ünde cetuximab infüzyonuna karĢı ciddi hipersensitivite reaksiyonları geliĢmektedir. Metastatik kolorektal kanser hastalarında akneiform döküntünün olmasının cetuximaba artmıĢ yanıt ile iliĢkili olduğu gösterilmiĢtir (64). CRYSTAL çalıĢması; FOLFIRI‘nin cetuximablı ya da cetuximabsız randomize değerlendirmesi sonucunda cetuximab alan hastalarda tümör yanıt oranlarında (RR, 47% vs 39%) ve progresyonsuz sağkalım sürelerinde (PFS) (ortalama 8, 9 vs 8,0 ay) artıĢ olduğunu göstermiĢtir (93). Her ne kadar bu sonuçlar cetuximabın birinci basamak tedaviye eklenmesinin faydasını destekliyor olsa da, bu rejimlerin becavizumab içeren rejimlerle karĢılaĢtırılması henüz yapılmamıĢtır. Devam eden pek çok çalıĢma, bu soruyu araĢtırmaktadır. Cetuximabın kolon kanserinin adjuvan tedavisindeki rolü henüz net olarak bilinmemektedir. Panitumumab, metastatik kolorektal kanserinde cetuximaba benzeyen tek ajan olduğu gösterilen EGFR humanize monoklonal antikorudur. Haftalıktan ziyade 2 haftalık uygulama Ģemaları bulunmaktadır. 6 mg/kg i.v. olarak 1 saatlik sürede uygulanır (92). Fluorourasil ve irinotekan ya da oxaliplatin tedavisi sonrası hastalıklarında ilerleme görülen hastaların % 9‘u panitumumaba yanıt vermiĢtir. Önceden fluoropyrimidine, irinotecan, oxaliplatin ve tek ajan panitumumab ile tedavi edilen 463 hastada en iyi destek 42 tedavisi ile karĢılaĢtırıldığında, cetuximabta olduğu gibi (ortalama PFS, 8, 0 vs 7, 3 hafta) progresyonsuz sağkalım oranlarında artıĢa neden olduğu gösterilmiĢtir (64). Adjuvan Kemoterapi Uygulamaları 5-FU+FA (Mayo rejimi): 5-FU 425 mg/m2/gün + FA 20 mg/ m2/gün, 1- 5. günler, 28 günde bir tekrar edilir, 6 ay süre ile kullanılır. 5-FU+FA (De Gramont rejimi): FA 200 mg/ m2 i.v. + 5-FU 400 mg/ m2 bolus 1- 2. günler, 5 FU 600 mg/ m2 sürekli infüzyon (24 saat) 1- 2. günler, 15 günde bir, 6 ay süre ile uygulanır. 5-FU+Levamizol: 5-FU 425 mg/ m2 /gün 1- 5. günler, 28 gün sonra haftada bir aynı doz verilir, 1 yıl süre ile kullanılır. Levamizol 50 mg/gün 1-3. günler, 14 günde bir, 1 yıl boyunca kullanılır. Hafta bir yüksek doz 5-FU+FA (Roswell Park rejimi): 5-FU 500 mg/ m2 haftada bir, 6 hafta süre ile kullanılır, 2 hafta ara verilir ve 1 yıl boyunca devam edilir. FA 500 mg/ m2 2 saatlik infüzyon olmak üzere haftada bir, 6 hafta süre ile kullanılır, 2 hafta ara verilir ve tedavi 1 yıla tamamlanır. FOLFOX -4 rejimi: 2 haftada bir, toplam 12 siklus olmak üzere 1 ve 2. günlerde, FA 200 mg/ m2 2 saatlik infüzyon ve 5-FU 400 mg/ m2, 5-FU 600 mg/ m2 22 saatlik infüzyon, 1. gün oksaliplatin 85 mg/ m2 uygulanır. FOLFOX -6 rejimi: 1.gün oksaliplatin 85 mg/m2 2 saatlik infüzyon, FA 400 mg/m2 2 saatlik infüzyon. 1. gün, 5-FU 400 mg/m2 1. gün i.v. bolus sonrasında 2 gün süre ile 1200 mg m2/gün (toplam 2400 mg/m2 46- 48 saatlik) infüzyon olarak uygulanır. Her iki haftada bir tekrar edilir. Capecitabine tablet ve Tegafur-Urasil (UFT tablet)+FA: Capecitabine 1250 mg/m2/gün 14 gün süreyle kullanılıp, 21 günde bir tekrarlanarak, 24 hafta süre ile uygulanır. Tegafur 43 300 mg/m2 /gün ve urasil 1/4 molar oranda p.o. 28 gün süre ile FA 90 mg/gün p.o. 28 gün süre ile 35 günde bir, 5 siklus uygulanır. FLOX: 5-FU 500 mg/ m2 haftalık i.v. bolus, 6 defa; FA 500 mg/ m2 haftalık 6 defa, her 8 haftalık siklusta 1. 3. ve 5. haftalarda oksaliplatin 85 mg/ m2 i.v. ek olarak uygulanır. Adjuvan Tedavi Sonrası Takip Nükslerin % 80‘i baĢlangıç tedavi sonrası 2 yıl içinde görülmektedir. Amerikan Kanser Cemiyeti, rezeksiyon sonrası ilk yılda ve daha sonra bulgular normal ise 3-5 yılda bir olacak Ģekilde kolonoskopi veya çift kontrastlı baryum enema ile total kolonik değerlendirmeyi önermektedir. BaĢlangıç cerrahi ekstirpasyon sırasında, senkron kanserler ekarte edilmeli ve polip tarzındaki metakron maligniteler erkenden saptanıp çıkarılmalıdır. Metastatik Kolorektal Kanser Ġçin Kemoterapi Rejimleri Birinci Basamak Oksaliplatin-bazlı: FOLFOX4 veya 6 ya da CAPOX Ġrinotekan-bazlı: FOLFIRI Ġntravenöz 5-FU rejimiyle birlikte BV: 5-FU ve LV, IFL, FOLFIRI ya da FOLFOX Diğer Rejimler Yalnız kapesitabin Yalnız irinotekan(350 mg/m2) ya da IFL XELOX (oksaliplatin ve kapesitabin) XELIRI (irinotekan ve kapesitabin) Sürekli infüzyon 5-FU( tek baĢına) 44 Ġkinci Basamak Herhangi bir ilk seri veya alternatif tedaviye çapraz direnci olmayan bir rejim (FOLFOX sonrası FOLFIRI, gibi) 45 3. ADJUVAN KEMOTERAPĠNĠN EVRE II KOLON KANSERĠNDE ETKĠNLĠĞĠ AJCC TNM evreleme sistemine göre, toplam hasta sayısının ¼‘ünü oluĢturan evre II hastaların (T3-4N0) küratif cerrahi sonrası prognozları oldukça iyidir. 5 yıllık genel sağkalım oranları T4N0 için % 72, T3N0 için % 85 arasında değiĢmektedir ve adjuvan tedavinin yeri halen çeliĢkilidir. Yüksek risk faktörleri (T4, vasküler veya perineural invazyon, intestinal obstruksyon veya perforasyon, kötü differentsiye tümörler, ya da 12‘den az LN çıkarılması) tanımlanmıĢtır ve elde edilen veriler bu özellikleri olan hastaların % 60 olan 5 yıllık sağkalım sürelerinin evre III hastalara benzer özellikte olduğunu göstermektedir. Bu nedenle her ne kadar etkinliği prospektif olarak geçerlilik kazanmamıĢ olsa da, adjuvant kemoterapi genellikle bu özelliklerden en az birine sahip olan hastalara önerilmektedir (94). 3.1. Evre II kolon kanseri popülasyonunda risk belirlenmesi Evre II kolon kanserli hastalar heterojen bir popülasyondur. Evre II kolon kanserinin değiĢik alt gruplarını belirlemek uygun tedavi programlarının verilmesini sağlamaktadır. Örneğin, T4 primer tümörü olan evre II hastaların 5 yıllık hayatta kalım oranları % 72‘dir. Bu oran T2 primer tümörü ve 4‘ten daha az lenf nodu tutulumu olan 5 yıllık hayatta kalım oranından düĢüktür (% 83) (63). Adjuvan tedaviden görülen fayda ortalama bir evre II hasta için düĢükken, evre II ve III hastaların (hazards ratio ya da odds ratio ile ölçülen ) 5-FU tedavisinden elde edilen yararın benzer olduğunu akılda bulundurmak gereklidir. Bu durum, 5-FU‘dan elde edilen relatif yararın absolü rekürrens riskinden bağımsız olduğunu düĢündürmektedir (örneğin tedavi evreden bağımsız olarak rekürrens riskinde % 15-20 azalmaya neden olabilir). Bu bulgu evre II tümörlerde rekürrens riskini belirlemek için klinik ve patolojik değiĢkenlerin kullanımını desteklemektedir. 46 Ancak, bu öneriler prognostik özelliklerin kemoterapiden sağlanan faydayı değiĢtirmeyeceği varsayılarak yapılmaktadır. BaĢka bir deyiĢle, bu özelliklerin kemoterapiye yanıtı belirlemek için kullanılmayacağı, sadece tedavi yokluğunda rekürrens riskini yansıtacağı varsayılmaktadır. Tersine, predikitif markerlar bir kemoterapiye yanıtı yansıtmaktadır (63). 3.2. Yüksek Riskli Evre II Hastalığın klinik Tanımlamaları Evre II kolon kanseri için yüksek riskli özellikleri tanımlamak üzere kılavuzlar oluĢturulmuĢtur. National Comprehensive Cancer Network Clinical Practice kılavuzu yüksek riskli evre II hastalığı aĢağıdakilerden en az birinin varlığı ile tanımlamaktadır: T4 tumor; kötü histolojik grad (andifferansiye ya da zayıf diferansiye); lenfovasküler tutulum; baĢvuru esnasında barsak obstrüksyonu, lokalize perforasyon ya da ya da belirlenemeyen pozitif sınırları olan T3 lezyonu ve yetersiz örneklenmiĢ lenf nodlarıdır (12‘den az sayıda) (95). Bu guidelinelara göre, yüksek riskli hastalar adjuvan kemoterapi için değerlendirilmelidir. Ancak, bu faktörlerin kötü prognozla iliĢkili olduğuna ya da tedaviye yanıtı belirlediğine dair yeterli kanıt bulunmamaktadır. ASCO tarafından geliĢtirilen guidelinelar benzerdir ancak, nöral invazyonu da yüksek risk özelliği olarak kategorize etmektedir (96). Bu kılavuzda evre II hastalar için adjuvan kemoterapiden olası mutlak yararlanım 5 yıllık sağkalım oranlarında %2- 4 artıĢ olarak tahmin edilmektedir. Consensus kararı mevcut verilerin yüksek-riskli evre II hastalarda adjuvan kemoterapinin kullanımını yeterli derecede desteklemediği yönündedir. Ancak, önceki çalıĢmalardaki yetersiz örnek sayısı ve evre III hastalarda ulaĢılan yararlanım oranlarına ait indirekt veriler seçilmiĢ hastalarda tedaviyi destekleyebilir. Bu kriterler baz alındığında, yüksek riskli özellikler evre II hastaların büyük çoğunluğunda bulunmaktadır. MOSAIC çalıĢmasında değerlendirilen ev II rehastaların % 64‘ü yüksek riskli olarak kategorize edilmiĢtir. Hastaların % 19‘unda T4 lezyonu bulunmakta, % 34‘ünde yetersiz örneklenmiĢ lenf nodları (bu çalıĢmada 10‘dan az sayıda olarak tanımlanmıĢtı), % 17‘sinde barsak obstrüksyonu, % 9‘unda perforasyon bulunmaktaydı ve yüksek riskli patolojik bugular olan kötü diferansiyasyon ve vasküler invazyon hastaların % 10 ve % 4‘ünde görülmüĢtü (97). Diğer risk modelleri de öne sürülmüĢtür. Örneğin, 47 Petersen prognostik modelinde yüksek risk, tümör perforasyonu ya da aĢağıdakilerden birden fazlasının bulunması olarak tanımlamıĢtır: peritoneal tutulum, vasküler invazyon ve pozitif cerrahi sınırlar. 1,625 evre II hastasının değerlendirildiği bir kohort çalıĢmasında yüksek riskli hastalarda düĢük riskli hastalara göre 5 yıllık sağkalım oranlarında belirgin farklılık olduğu gösterilmiĢtir (sırasıyla %45 vs %70, p < .01) (98). 3.3. Evre II Kolon Kanserinde Adjuvan Kemoterapi ile Ġlgili ÇalıĢmalar Ġlk ÇalıĢmalar Erken National Surgical Adjuvant Breast and Bowel Project (NSABP) çalıĢmaları hastaları 5-FU bazlı rejimleri alanlar (semustine, vincristine ve 5-FU ya da 5-FU‘nun preoperatif portal ven infüzyonu) ve gözlenenler olarak randomize etmiĢ, baĢka çalıĢmalar 5-FU artı leucovorin kolunu diğer 5 -FU rejimleri ile karĢılaĢtırmıĢtır (semustine, vincristine ve 5-FU ya da 5-FU ve levamisole ve/veya leucovorin). (99,100) Bu çalıĢmalar evre II/III hastalardaki genel sağkalım oranlarını belirlemeyi hedeflemiĢ ve adjuvan tedavi alan evre II hastalarda istatistiksel olarak anlamlı geliĢim olduğunu göstermede baĢarısız olmuĢtur. GI Intergroup ÇalıĢmaları GI Intergroup tarafından yapılan bir çalıĢma 5-FU/levamisolün evre II ve evre III hastalarda etkinliğini araĢtırmıĢtır. Bu çalıĢma 1,247 hastayı incelemiĢtir, ancak, sadece 318 hastanın incelenmiĢ olması nedeniyle, evre II hastalardaki etkinliğini göstermede yetersiz kalmıĢtır. Sadece gözlemlenen hastalarla karĢılaĢtırıldığında, 5-FU ve levamisol alanlarda rekürrens oranında azalma olduğu görülmüĢtür (% 71vs %79, gözlem vs. 5FU/levamisole, p = .10), ve son raporla neredeyse denk sonuçlara ulaĢılmıĢtır (101,102). Ġkinci bir GI Intergroup çalıĢması yüksek risk evre II/III hastalarda 5-FU bazlı rejmleri araĢtırmıĢ ve optimal bir kemoterapi programı belirlemeyi hedeflemiĢtir. Obstrüksyon, perforasyon ya da tanı anında yakındaki dokulara invazyon ile belirlenen yüksek-risk evre II hastalar, çalıĢma populasyonunun %20‘sini oluĢturmuĢtur. ÇalıĢmanın 4 kolu lökovorin ya da levamizol içeren ya da içermeyen 5-FU kombinasyonlarını içermektedir. Sadece gözlem yapılan hasta grubunun olmamasına rağmen, yüksek riskli evre II kolon kanserli hastalarda elde edilen sonuçlar önceki çalıĢmalara benzer olarak bulunmuĢtur (103). 48 QUASAR 1 ÇalıĢması Evre II hastaları içeren en büyük çalıĢma adjuvan kemoterapi için endikasyon durumu belirsiz kolon ve rektal kanserli hastaları 5-FU ya da lökovorin almak, ya da sadece tedavisiz üzere randomize eden Quick and Simple and Reliable (QUASAR) 1 çalıĢmasıdır. ÇalıĢmaya alınan 3239 hastanın % 92‘si evre I hastalıktı. ÇalıĢmanın en güncel sunumu yapıldığında, değerlendirilen hastaların sağkalım oranlarında kesin bir sonuca ulaĢılmamıĢtır (104). Evre II hastalarda 5 yıllık sağkalım oranlarında %3‘ten %4‘e (p = .04), hastalık rekürrensinde de %3‘ten %4‘e mutlak bir artıĢ olmuĢtur (15,4% vs 19,1%, p = .004). Ancak, bu çalıĢma rektal kanserli hastaları da içermekteydir (29%). Bu hastaların bir kısmı ayrıca adjuvan ya da neoadjuvan radyasyon tedavisi almıĢtı. Bu çalıĢmada adjuvan tedaviden fayda gören hasta çoğunluğunun evre II kolon kanser hastaları ile karĢılaĢtırıldığında, evre II rektal kanserli hastalar olduğu ortaya konmuĢtur (rekürrens oranı 20%-27%, P = .005) (17% vs 20%) (104). Bu hastaların az bir kısmında T4 primer tümör, lenfovasküler invazyon ya da perinöral invazyonla karakterize yüksek riskli hastalık olduğu bildirilmiĢtir (105). ÇalıĢma raporu yayınlandığında daha fazla sonuç elde edilmesi beklenmektedir. MOSAIC ve NSABP C-07 ÇalıĢmaları Oxaliplatinin adjuvant rejimlerde kullanılmaya baĢlanmasıyla, evre II hastaların bundan fayda görebileceği ile ilgili yeni sorular ortaya atılmıĢtır. MOSAIC çalıĢmasında (Multicenter International Study of Oxaliplatin/5-FU/LV in the Adjuvant Treatment of Colon Cancer), 6 aylık 5-FU/LV, 6 aylık 5-FU/LV ve oxaliplatin (FOLFOX rejimi) ile karĢılaĢtırılmıĢtır. Evre II/III kolon kanserinde 3 yıllık hastalıksız sağkalım oranlarına ulaĢılmıĢtır. Ancak, alt grup analizleri evre II hastaların hastalıksız sağkalım oranlarında geliĢme olduğunu gösterememesi nedeniyle (mutlak risk azalması of 3,8%, hazard oranı [HR] = 0.84, 95% güvenlik aralığı [GA] = 0.621.14), FDA oxaliplatin‘in evre III kolon kanserinde kullanımını kısıtladı. ÇalıĢmanın yüksek riskli evre II hastalık ile limitli olması nedeniyle (T4 lezyonu, tümör perforasyonu ya da obstrüksyonu, kötü diferansiye tümör, venöz invazyon, 10‘dan daha az sayıda lenf nodunun analiz edilmesi) oxaliplatin için istatistiksel olarak anlamlı bir fayda gösterilememiĢtir. (mutlak risk redüksiyonu of 7,2%, HR = 0.74, 95% GA = 0.521.06) 49 Yakın zamanda güncellenmiĢ 6-yıllık sağkalım oranı sonuçları 5-FU/LV ya da FOLFOX ile tedavi edilen hastalarda farklılık göstermemiĢtir (106). Benzer sonuçlar NSABP C-07 çalıĢmasında gösterilmiĢ ve oxaliplatinin 5-FU/LV‘e eklenmesinin totalde fayda sağladığını ancak, evre II alt grubunda düzelme olmadığını göstermiĢtir (107). Her iki çalıĢmada, adjuvan tedavi üzerindeki göreceli pozitif etki ve zarar oranları evre II ve III hastaları için benzerdir. Erken Meta-analizler IMPACT B2 çalıĢması (International Multicentre Pooled Analysis of B2 Colon Cancer Trials) modified Dukes' B2 (T3/4, N0) hastalarından bilgi toplayan 5 çalıĢmayı değerlendirmiĢtir (108). Bu hastalar 5-FU ve lökovorin tedavisi almak ya da izlenmek üzere randomize edilmiĢlerdir. Analize 998 hasta dahil edilmiĢ, 5.8 yıl süre ile takip edilmiĢtir. 5-FU/LV ile tedavi edilen hastaların 5 yıllık sağkalım oranları % 82, izlenen hastaların 5 yıllık sağkalım oranları % 80‘dir ve aradaki fark istatistiksel olarak anlamlı bulunmadı. 5 yıllık hazard oranı hastalıksız sağkalım için 0.83 (90% GA = 0.721.07) ve total hayatta kalım oraları için 0.86 (90% GA = 0.681.07) ‘dır. AraĢtırmacılar 5-FU/LV‘in evre II kolon kanserli hastalarda rutin kullanılamayacağı sonucuna varmıĢtır. NSABP C-01 ve C-04 çalıĢmalarında adjuvan tedavinin faydalarını değerlendirilmiĢtir.(63) 4 çalıĢmadaki çok ve az efektif tedavi kollarının karĢılaĢtırılması evre II hastalarda mortalitede %30 azalma olduğunu ve rekürrens riskinde azalma olduğunu göstermiĢtir (P < .05). Evre I hastalarda mortalitenin azalması obstrüksyon, perforasyon ve invazyon gibi kötü prognostik faktörlerden bağımsız olarak gerçekleĢmiĢtir. Her ne kadar analizin amacı evre II hastalıkta kemoterapinin yararını belirlemek olarak bildirilmiĢ olsa da, çalıĢmaların kombine analizi bu amacı gerçekleĢtirmek için yetersiz olması nedeniyle oldukça eleĢtirilmiĢti (63). Evre II/III kolon kanserinin adjuvan tedavisini değerlendiren 7 çalıĢmanın çok değiĢkenli analizi adjuvan tedavinin faydalarını araĢtırmıĢtır (63). Nod negatif hastaların tek değiĢkenli analizi hastalıksız sağkalım oranlarında % 4 mutlak risk azalması olduğunu göstermiĢtir.(HR = 0.83, p = .049). Tümör evresii, nodal durum ve histolojik grade‘e göre uyarlanan bu yaklaĢım, adjuvan kemoterapi ile rekürrens riskinde % 35 azalma (HR = 0.65; 95% GA = 0.580.73) ve ölüm riskinde % 30 azalma olduğunu göstermiĢtir. 50 ASCO, Medicare ve SEER analizleri Evre II kolon kaneri için önerileri geliĢtirmekle yükümlü American Society of Clinical Oncology Uzman paneli tarafından yürütülen bir çalıĢma, analizi gözlem kolu ve 5-FU içeren tedavi kolu olarak kısıtlamıĢtır. Evre II kolon kanserli hastalar için adjuvan kemoterapinin sağkalım süresini belirgin olarak artırmadığı sonucuna varmıĢtır (risk oranı = 0.86, p = .08) (63). AraĢtırmacılar yetersiz çalıĢma boyutları nedeniyle adjuvan tedaviden saptanamayacak kadar az miktarda fayda sağlandığı sonucuna varmıĢlardır. Farklı bir yaklaĢım evre II hastalarda adjuvan kemoterapinin potansiyel faydalarını araĢtırmak üzere Medicare and Surveillance, Epidemiology and End Results (SEER)‘ın verileri kullanılarak yapılmıĢtır. (63) Bu analizde, 65-75 yaĢ arası 3000‘den fazla evre II kolon kanseri hastası belirlenmiĢtir. YaklaĢık % 27‘sine adjuvan kemoterapi verilmiĢtir. Bu gruptaki hastalar daha gençtir, sağlık durumları daha iyidir ve tümör derecesi daha düĢüktür. Mevcut prognostik değiĢkenlere göre ayarlandıktan sonra, adjuvan tedaviyle iliĢkili sağkalım süresi için hazard oranı 0.91 (95% GA = 0.77-1.09) saptanmıĢtır. Bu analiz sonuçları ve adjuvan tedavi kararını etkileyebilecek, obstrüksyon gibi sınırlayıcı prognostik faktörlerin toplanması ile ilgili yetersizlik olması nedeniyle kısıtlanmaktadır. Mevcut kanıtlar değerlendirildiğinde, evre II kolon kanserinde adjuvan 5-FU kemoterapi ile rekürrens ve hayatta kalım oranlarında az miktarda artıĢ olduğunu saptanmıĢtır. Bu durum önceki Oxaliplatin‘in çalıĢmalarda evre II yetersiz hastalarda örnek sağkalım sayısı süreleri nedeniyle üzerinde gösterilememiĢtir. faydalı olduğu gösterilememiĢtir. Bazıları tedaviden görülen relatif yararın, evre II hastalarda tedavinin etkinliğinin en iyi ölçütü olduğunu öne sürmüĢtür (63). Bu nedenle, yüksek risk özelliklerinin belirlenmesi, kötü prognozları sonucu adjuvan tedaviden daha fazla fayda sağlayabilecek evre II hasta grubunu belirlemede faydalı olabilir. 3.4. Evre II kolon kanseri popülasyonunda kemoterapi toksisitesi Evre II kolon kanserinin göreceli iyi prognozu ele alındığında, kemoterapi verilmesi tedavi ile iliĢkili potansiyel risklerin gözden geçirilmesini gerektirmektedir. Oxaliplatin içeren ya da içermeyen, 5-FU/LV rejimlerinin yan etkileri literatürde ayrıntılı olarak bildirilmiĢtir (107). Yakın zamanlı bir faz III çalıĢmasında grade 3 ya da daha yüksek toksisite olarak 51 tanımlanan ciddi yan etkiler, 5-FU/LV tedavisi alan evre II hastaların % 14‘ünde saptanmıĢtır ve hastaların % 6‘sında tedavinin erken dönemde kesilmesine neden olmuĢtur. Oxaliplatin‘in tedavi rejimine eklenmesi bu oranları arttırmıĢtır (Hastaların % 19‘unda ciddi yan etkiler görülmüĢ, % 12‘sinde tedavi kesilmiĢtir). (97) Hastaların büyük çoğunluğunda iyi tolere edilse de, 5-FU bazlı rejimler ölüm dahil ciddi yan etkilere neden olabilir. Çoğu modern çalıĢmada, tedaviye bağlı ölüm oranları %0,5 -1 arasında değiĢiklik göstermektedir (107). Adjuvan tedavinin uzun dönem yan etkileri daha belirsizdir. Bir çalıĢmada, 5-FU tedavisi sonrası yaĢam kalitesinde azalma olmuĢtur ve bazal seviyeler dönmesi 1 yıl gibi bir süre gerektirmiĢtir (109). Oxaliplatin‘in tedaviye eklenmesi nörotoksisite potansiyelini artırmaktadır. Nöropati oxaliplatin kesildikten sonra bir süre daha devam etmektedir. Çoğu nöropati zamanla düzelse de, hastaların az bir kısmında devam etmektedir. C-07 çalıĢmasında adjuvan FOLFOX rejiminde daha düĢük kümülatif oxiplatin dozlarının kullanılmasına rağmen, hastaların % 10‘unda nöropati tedavinin kesilmesinden 2 yıl sonra hala devam etmekteydi (110). Evre II hastalık üzerinde yapılan pek çok çalıĢma monoklonal antikorlar olan cetuximab (Erbitux), panitumumab (Vectibix) ya da bevacizumab (Avastin)‘ı adjuvan tedaviye dahil etmektedir. Adjuvan tedavinin toksisitesi bu biyolojik ajanlarla artıĢ göstermektedir. Örneğin, bevacizumab arteryel tromboembolik olaylar gibi nadir ancak ciddi yan etkilerle iliĢkilidir. Ayrıca, bu yeni ajanların uzun dönem toksisiteleri iyi tanımlanmamıĢtır. Monoklonal ajanların risk ve faydaları daha iyi tanımlanana kadar adjuvan tedavide kullanılmamalıdır. 52 4. GEREÇ VE YÖNTEM Bu çalıĢmaya 1999- 2007 tarihleri arasında BaĢkent Üniversitesi Tıp Fakültesi Hastanesi Genel Cerrahi bölümünde opere edilmiĢ olan ve sonrasında BaĢkent Üniversitesi Tıp Fakültesi Hastanesi Medikal Onkoloji bölümünde takip edilmiĢ ve hala takip edilmekte olan 57 evre II kolon kanserli hasta dahil edilmiĢtir. Evrelemede TNM sistemi kullanılmıĢtır. Evre II kolon kanserli hastalarda adjuvan kemoterapi alan ve almayan hastaların yaĢ, cins, tümör boyutu ve gradı, diseke edilen lenf nodu sayısı, lenfovasküler invazyon varlığı, tümörün lokalizasyonu, tanı anında perforasyon ya da obstruksiyon bulgusu olup olmadığı, patoloji, eĢlik eden sistemik hastalığı, kanser öyküsü gibi klinik patolojik özellikleri incelendi. Kemoterapi alan hastalarda, kemoterapinin tipi, uygulanan kür sayısı gibi değiĢkenler değerlendirilmek üzere kaydedildi. Kemoterapi alan evre II kolon kanseri hastalarından kemoterapi sonrasında en az 2 yıl süre ile takip edilen hastalar çalıĢmaya dahil edildi. Tanı tarihi, patolojik tanı zamanı olarak alındı. YaĢayan hastaların son durumları yakın zamanlı son kontrol bulgularına göre belirlenmiĢtir. Son kontrol tarihleri 6 aydan fazla olan hastalara telefon ile ulaĢılarak son durumları hakkında bilgi alınmıĢtır. Genel sağ kalım süresi tanı tarihinden ölüm tarihine kadar geçen zaman olarak tanımlanmıĢtır. Hastalıksız sağ kalım süresi, tanı tarihinden ilk nüksün saptandığı tarihe kadar geçen süre olarak tanımlanmıĢtır. T4 lezyon, cerrahi sınır pozitifliği, perforasyon, obstruksiyon, lenfovasküler invazyon, 12 den az lenf nodu diseksiyonu yapılması ve kötü diferansiyasyon bulgularını taĢıyan hastalar yüksek riskli hastalar olarak kabul edilmiĢtir. Hastaların sağ kalımları bir ve birden fazla yüksek risk faktörü taĢıma özelliklerine göre de analiz edilmiĢtir. Sadece küratif cerrahi yapılan ve takip edilen evre II kolon kanserli hastalar ile adjuvan kemoterapi verilen evre II kolon kanserli hastaların hastalıksız ve genel sağ kalım analizleri hastanamizdeki kayıtlar incelenerek analiz edilmiĢtir. 53 4.1. Ġstatistik Verilerin analizi SPSS for Windows 11.5 paket programında yapıldı. Tanımlayıcı istatistikler sürekli değiĢkenler için ortalama ± standart sapma veya ortanca (minimum maksimum) olarak kategorik değiĢkenler ise vaka sayısı ve (%) olarak gösterildi. Kategorik değiĢkenlerin rekürrenssiz sağkalım ve genel sağkalım üzerinde istatistiksel olarak anlamlı etkilerinin olup olmadığı Log-Rank testi kullanılarak Kaplan Meier sağkalım analizi ile değerlendirildi. Her bir risk faktörüne iliĢkin sağkalım oranları, beklenen ortalama sağkalım süresi ve %95 güven aralığı hesaplandı. Sürekli değiĢkenlerin rekürrenssiz sağkalım ve genel sağkalım üzerinde istatistiksel olarak anlamlı etkilerinin olup olmadığı ise Tek DeğiĢkenli Cox Regresyon analiziyle değerlendirildi. Her bir değiĢkene ait relatif risk ve %95 güven aralığı hesaplandı. Tek değiĢkenli istatistiksel analizler sonucunda rekürrenssiz sağkalım üzerinde klinik olarak etkili olabileceği düĢünülen risk faktörlerinin birlikte etkilerini incelemek üzere Çoklu DeğiĢkenli Cox Regresyon analizi kullanıldı. Tek değiĢkenli analizlerde p < 0,25 olarak saptanan değiĢkenler aday risk faktörleri olarak çoklu değiĢkenli modele dahil edildi. Kemoterapi alan ve almayan gruplar arasında ortalamalar yönünden farkın önemliliği Student‘s t testi ile ortanca değerler yönünden farkın önemliliği ise Mann Whitney U testi ile incelendi. Nominal değiĢkenler Pearson‘un Ki-Kare veya Fisher‘in Kesin Sonuçlu KiKare testiyle değerlendirildi. p<0,05 için sonuçlar istatistiksel olarak anlamlı kabul edildi. 54 5. BULGULAR 5.1. Genel Klinik Özellikler ÇalıĢmaya katılan evre II kolon kanseri olan 57 hastadan 31 tanesi kadın (%54,4), 26 tanesi erkek (%45,6) idi. Hastaların yaĢ ortalaması 64,8 olup 30 ile 84 arasında değiĢmekteydi. 27 hastanın ek sistemik hastalığı olmayıp (%47,4) 30 hastanın hipertansiyon, diabet, koroner arter hastalığı, ülseratif kolit, KOAH, FAPC gibi kronik hastalıkları mevcut idi.(%52,6) Kronik hastalığı olanların çoğunda HT (%19,3) vardı. 2 hastada FAPC (%3,5), 1 hastada ise ülseratif kolit (%1,8) öyküsü bulunmaktaydı.2 hastada endometrium kanseri ve diffüz B hücreli lenfoma olmak üzere kanser öyküsü mevcut idi. Hastaların izlem süresi 16 ile 108 ay arasında değiĢmekteydi. (ortalama 36 ay) 18 hastanın patolojik tanısı müsinöz adenokarsinom (%31,6), 39 hastanın ise adenokarsinom (%68,4) olarak değerlendirildi. Tümör, 21 hastada sigmoid kolonda(%36,8), 19 hastada çıkan kolonda (%33.3), 6 hastada inen kolonda(10,5), 6 hastada çekumda(%10,5) ve 5 hastada ise transvers kolonda lokalizeydi. 26 hastaya cerrahi yöntem olarak sağ hemikolektomi(%45,6), 18 hastaya sigmoıd rezeksiyon(%31,6), 13 hastaya ise sol hemikolektomi ve segmental rezeksiyon gibi diğer cerrahi yöntemler uygulanmıĢ olduğu saptandı.(%22,8) Kırkbir hastada histolojik grad orta diferensiye (%41), 10 hastada iyi diferensiye, 6 hastada ise kötü diferensiye olarak değerlendirildi. Tümör boyutu ortalama olarak 5 cm olup 2 ve 17 arasında değiĢmekteydi. 12 hastanın patoloji raporunda lenfovasküler invazyon mevcut iken (%21,1), 45 hastada ise invazyon saptanmadı. Tanı anında 3 hastada perforasyon (%5,3), 16 hastada ise obstruksiyon kliniği vardı. 42 hastanın evrelemesinde 12 den fazla lenf nodu diseksiyonu yapıldığı saptandı. (% 73.5) Yine 26 hastada ise T4 lezyon vardı (%45,6). Bir hastada cerrahi sınır pozitifliği vardı (%1,8). Hastaların demografik özellikleri tablo 5. 1 ‗de gösterilmiĢtir. 55 Tablo 5. 1 Olguların Demografik Özellikleri Yönünden Dağılımı DeğiĢkenler n=57 YaĢ 64,8 (30- 84) Cinsiyet Kadın 31 (% 54,4) Erkek 26 (% 45,6) YandaĢ hastalık (+) 30 (% 52,6) Kanser öyküsü (+) 2(% 3,5) Patoloji Müsinöz adenokarsinom 18(%31,6) Adenokarsinom 39(%68,4) Grad Ġyi diferansiye 10(%17,5) Orta diferansiye 41(%71,9) Kötü diferansiye 6(%10,5) Lenfovasküler invazyon (+) 12(%21,1) Disseke edilen lenf nodu sayısı > 12 42(%73,5) <12 15(%26,5) Perforasyon (+) 3(%5,3) Obstruksiyon (+) 16(%28,1) T4 lezyon 26(%45,6) Cerrahi sınır pozitifliği 1(%1,8) 56 Tablo 5.2. Tümör Lokalizasyonu Dağılımı n: 57 % Ġnen Kolon 6 10,5 Çıkan Kolon 19 33,3 Çekum 6 10,5 Sıgmoid Kolon 21 36,8 Transvers Kolon 5 8,8 Tablo 5.3. Cerrahi Rezeksiyon Tipleri n: 57 % Sag Hemikolektomı 26 45,6 Segmental Rezeksıyon 5 8,8 Sıgmoıd Rezeksiyon 18 31,6 Sol Hemikolektomi 8 14,0 Tablo 5.4. EĢlik Eden Hastalıkların Dağılımı n:57 % YOK 27 47,4 HT+KORONER OLAYLAR 7 12,3 HT 11 19,3 DM 1 1,8 KRONIK HEPATIT 3 5,3 ULSERATIF KOLIT 1 1,8 FAPC 2 3,5 HT+DM 2 3,5 HT+DM+KORONER OL. 1 1,8 KBY+DM+KOAH+KAH 1 1,8 HT+KOAH 1 1,8 57 5.2.Adjuvan Kemoterapi Alan ve Almayan Hastalarda Klinik Özellikler ÇalıĢmaya katılan 57 hastanın 43 tanesine cerrahi tedavi sonrasında adjuvan kemoterapi verilmiĢti.(% 75,4) 14 hasta ise sadece küratif cerrahi sonrasında izleme alınmıĢtı.(%24,6) Kemoterapi alan ve almayan hastaların yaĢ ortalaması 64,6 idi. Kemoterapi alan 43 hastadan 21 tanesi kadın (%48,8) 22 tanesi ise erkek hasta idi (%51,2). Ek sistemik hastalığı olan 27 hastanın 19‘ una (%44,2) kemoterapi verilmiĢ olup daha önce bilinen kanser öyküsü olan ve tanı anında remisyonda izlenen 2 hastanında kemoterapi aldığı saptandı. Ülseratif kolit tanısı olan 1 hasta ve FAPC tanısı olan 2 hastaya da cerrahi tedavi sonrasında adjuvan kemoterapi uygulanmıĢtı. Kemoterapi alan 19 hastaya cerrahi tedavi olarak sağ hemikolektomi (%44,2), 14 hastaya sigmoid rezeksiyon (%32,6), 6 hastaya sol hemikolektomi (%14,0), 4 hastaya ise segmental rezeksiyon (%9,3) uygulanmıĢtı. Kemoterapi almayan grupta ise sağ hemikolektomi yapılan hasta sayısı 7 (%50,0), sigmoid rezeksiyon yapılan hasta sayısı 4 (%28,6), sol hemikolektomi yapılan hasta sayısı 2 (%14,3) ve segmental rezeksiyon yapılan hasta sayısı ise 1 (%7,1) olarak değerlendirildi. Müsinöz adenokarsinom patoloji tanısı alan 18 hastanın 11‘ine (%25,6) adjuvan kemoterapi uygulanmıĢtı. Adenokarsinom tanısı alan 39 hastadan da 32‘sine adjuvan kemoterapi verilmiĢti.(%74,4) Kemoterapi alan 9 hastanın patolojisinde lenfovasküler invazyon (% 20,9) vardı.14 hastada ise tanı anında obstruksiyon (%32,6) ve 3 hastada perforasyon (%7,0) kliniği bulunmaktaydı. Yine kemoterapi alan 30 hastada orta diferansiye (%69,8), 8 hastada iyi diferansiye (%18,6) ve 5 hastada ise kötü diferansiye(%11,6) tümör olduğu saptandı. Kemoterapi alan hastaların çoğunda tümör yerleĢim yeri sigmoid kolon ve çıkan kolonda idi (sırasıyla %37,2,%34,9; n:16 ve n:15). TNM evrelemesine göre T4 lezyonu olan toplam 26 hastanın 23‘üne (%53,5) cerrahi tedavi sonrasında adjuvan kemoterapi uygulandığı 3 hastaya (%21,4) ise sadece izlem yapılmıĢ olduğu saptandı. Kemoterapi alan ve almayan her iki grupta da tümör boyutu ortalama olarak 5 cm idi. Kemoterapi alan 30 hastada (%69,8) disseke edilen lenf nodu sayısı 12‘nin üzerindeyken bu oran kemoterapi almayan grupta %85,7 olarak saptandı (n:12). 58 Tablo 5.5. Kemoterapi Alan ve Almayan Gruplara Göre Olguların Demografik ve Klinik Özellikleri Yönünden Ġncelenmesi DeğiĢkenler KT Almayan (n=14) KT Alan (n=43) 64,8 ± 15,9 64,4 ± 9,9 Kadın 10 (%71,4) 21 (%48,8) Erkek 4 (%28,6) 22 (%51,2) YandaĢ Hastalık 8 (%57,1) 19 (%44,2) Kanser Öyküsü - 2 (%4,7) Müsinöz Adenokarsinom 7 (%50,0) 11 (%25,6) Adenokarsinom 7 (%50,0) 32 (%74,4) Sağ Hemikolektomi 7 (%50,0) 19 (%44,2) Segmental Rezeksiyon 1 (%7,1) 4 (%9,3) Sigmoid Rezeksiyon 4 (%28,6) 14 (%32,6) Sol Hemikolektomi 2 (%14,3) 6 (%14,0) Ġyi Diferansiye 2 (%14,3) 8 (%18,6) Orta Diferansiye 11 (%78,6) 30 (%69,8) Kötü Diferansiye 1 (%7,1) 5 (%11,6) 3 (%21,4) 9 (%20,9) Ġnen Kolon 1 (%7,1) 5 (%11,6) Çıkan Kolon 4 (%28,6) 15 (%34,9) Çekum 2 (%14,3) 4 (%9,3) Sigmoid Kolon 5 (%35,7) 16 (%37,2) Transvers Kolon 2 (%14,3) 3 (%7,0) - 3 (%7,0) Obstrüksiyon 2 (%14,3) 14 (%32,6) T4 Lezyon 3 (%21,4) 23 (%53,5) Tümör Boyutu 5 (2-17) 5 (2-12) LN Sayısı >12 12 (%85,7) 30 (%69,8) YaĢ Cinsiyet Patoloji Cerrahi Grad Lenfovasküler Ġnvazyon Tümör Lokalizasyonu Perforasyon 59 5.3.Tedavi Küratif cerrahi sonrasında adjuvan kemoterapi uygulanan 43 hastadan 36‘sına (%83,7) kemoterapi olarak MAYO rejimi (5-FU 425 mg/m2/gün + FA 20 mg/m2/gün) uygulanmıĢtı. 4 hastaya(%9,3) TAMUDEX (3mg/ m2 /gün 3 haftada bir), 2 hastaya (%4,65) FOLFOX4 ve 1 hastaya da (%2,32) UFT verilmiĢti. Hastaların çoğuna 6 kür kemoterapi uygulanmıĢtı. Kemoterapi uygulanan hastalar en az 24 ay süresince takip edilmiĢti (ortalama 38 ay). Tablo 5.6. Vakalara Uygulanan Adjuvan Kemoterapi Rejimleri KT Rejimleri n=43 % MAYO TAMUDEX 3MG/M2 FOLFOX4 UFT 36 4 2 1 83,7 9,3 4,65 2,35 Toplam 43 100,0 Tablo 5.7. Vakalara Uygulanan Kür Sayısı Dağılımı Kür Sayısı 1 5 6 Toplam n=43 % 3 2 38 6,98 4,65 88,37 43 100,0 5.4. Sağkalım Hastaların takiplerinde 12 hastada (%21,1) rekürrens saptandı. Rekürrens saptanan 12 hastadan 11 hastaya (%25,6) cerrahi tedavi sonrasında adjuvan kemoterapi verilmiĢti. Yine izlemde toplam 7 hasta kaybedildi. Kaybedilen hastalardan 6 tanesine (%14,0) kemoterapi uygulanmıĢtı. Genel sağkalım ve rekürrens üzerinde etkili olabilecek faktörler 60 incelendiğinde T4 lezyon varlığının rekürrens üzerine etkisi istatiksel olarak anlamlı bulundu (p : 0.015) ancak genel sağ kalıma etkisi saptanmamıĢtır. (p: 0,89) Bir ve birden fazla risk faktörünün bulunmasının ve lenfovasküler invazyon varlığının rekürrens üzerine etkisi klinik olarak anlamlı bulunurken (p: 0.14 ve p:0.12) genel sağkalıma etkisi istatistiksel olarak anlamlı bulunmamıĢtır (p: 0.6ve p: 0.7) Sadece bir hastada cerrahi sınır pozitifliği olması nedeniyle bu risk faktörünün sağkalım ve rekürrens üzerine etkisi istatistiksel değerlendirilmeye alınamadı. Yine kemoterapi alan hastaların çoğuna MAYO rejimi uygulandığı için kemoterapi protokollerinin sağkalım ve rekürrens üzerine etkisi analiz edilmemiĢtir. Tablo 5.8. Genel Sağkalım Üzerinde Etkili Olabilecek Faktörler -1 DeğiĢkenler Cinsiyet Kadın Erkek YandaĢ Hastalık Yok Var Kanser Öyküsü Yok Var Patoloji Müsinöz Adenokarsinom Adenokarsinom Cerrahi Tipi Sağ Hemikolektomi Segmental Rezeksiyon Sigmoid Rezeksiyon Sol Hemikolektomi Grad Ġyi Diferansiye Orta Diferansiye Kötü Diferansiye Lenfovasküler Ġnvazyon Yok Var Ölüm Oranı Sağkalım Beklentisi Ortalama (%95GA) 3/31 (%9,7) 4/26 (%15,4) 98,9 (83,7-114,1) 72,2 (65,9-78,4) 6/30 (%20,0) 1/27 (%3,7) Log Rank p 0.23 0.631 1.06 0.303 0.04 0.840 0.70 0.403 3.93 0.269 1.06 0.587 0.15 0.700 87,9 (72,3-103,6) 73,7 (66,3-81,0) 7/55 (%12,7) 0/2 (%0,0) 91,9 (79,1-104,8) - 2/18 (%11,1) 83,2 (48,3-118,0) 5/39 (%12,8) 75,7 (69,5-82,0) 2/26 (%7,7) 0/5 (%0,0) 2/18 (%11,1) 3/8 (%37,5) 75,0 (68,8-81,3) 89,3 (65,8-112,8) 63,1 (44,8-81,5) 2/10 (%20,0) 5/41 (%12,2) 0/6 (%0,0) 70,5 (56,5-84,6) 95,0 (81,5-108,6) - 6/45 (%13,3) 1/12 (%8,3) 90,7 (76,0-105,3) 76,9 (71,8-82,0) 61 Tablo. 5.8. (devamı) Genel Sağkalım Üzerinde Etkili Olabilecek Faktörler -2 DeğiĢkenler Perforasyon Yok Var Tümör Lokalizasyonu Ġnen Kolon Çıkan Kolon Çekum Sigmoid Kolon Transvers Kolon Obstrüksiyon Yok Var T4 Lezyon Yok Var Kemoterapi Almayan Alan Risk Grubu Yok Bir Tane Birden Fazla LN Sayısı ≤7 >7 Sağkalım Beklentisi Ortalama (%95GA) Ölüm Oranı 7/54 (%13,0) 0/3 (%0,0) 2.70 0.610 1.14 0.286 0.02 0.899 0.02 0.877 0.72 0.699 0.12 0.731 0.08 0.777 75,0 (66,2-83,8) 92,8 (77,2-108,4) 1/14 (%7,1) 6/43 (%14,0) 73,7 (73,7-73,7) 93,1 (79,7-106,4) 3/17 (%17,7) 1/14 (%7,1) 3/26 (%11,5) 66,9 (56,7-77,0) 73,9 (58,0-89,9) 94,6 (78,0-111,2) 1/9 (%11,1) 6/48 (%12,5) 7/57 (%12,3) 0.706 96,2 (81,5-111,0) 68,9 (59,6-78,3) 3/31 (%9,7) 4/26 (%15,4) Genel 0.14 69,4 (52,6-86,2) 76,4 (69,6-83,1) 68,1 (57,7-78,6) 86,1 (63,0-109,2) - 4/41 (%9,8) 3/16 (%18,8) 2/15 (%13,3) 5/42 (%11,9) p 91,7 (78,8-104,7) - 2/6 (%33,3) 1/19 (%5,3) 1/6 (%16,7) 3/21 (%14,3) 0/5 (%0,0) LN Sayısı ≤12 >12 Log Rank 95,6 (67,7-123,5) 74,3 (67,6-80,9) 86,8 (61,2-112,5) 75,3 (68,5-82,1) 92,0 (79,1-104,8) GA: Güven Aralığı 62 - - Tablo 5.9. Rekürrens (Hastalıksız Sağkalım) Üzerinde Etkili Olabilecek Faktörler -1 Rekürrenssiz DeğiĢkenler Rekürrens Oranı Sağkalım Ortalama (%95GA) Cinsiyet Kadın 7/31 (%22,6) 84,4 (65,5-103,3) Erkek 5/26 (%19,3) 66,4 (55,8-77,0) YandaĢ Hastalık Yok 8/30 (%26,7) 84,0 (66,5-101,4) Var 4/27 (%14,8) 65,0 (54,2-75,8) Kanser Öyküsü Yok 12/55 (%21,8) 86,0 (72,3-99,6) Var 0/2 (%0,0) - Patoloji Müsinöz Adenokarsinom Adenokarsinom 4/18 (%22,8) 81,2 (53,3-109,1) 8/39 (%20,5) 68,5 (59,1-77,8) Cerrahi Tipi Sağ Hemikolektomi 5/26 (%19,3) 65,5 (54,1-76,9) Segmental Rezeksiyon 0/5 (%0,0) - Sigmoid Rezeksiyon 5/18 (%27,8) 73,8 (47,2-100,5) Sol Hemikolektomi 2/8 (%25,0) 65,2 (42,8-87,6) Grade Ġyi Diferansiye 1/10 (%10,0) 76,8 (63,7-90,0) Orta Diferansiye 10/41 (%24,4) 82,1 (65,7-98,5) Kötü Diferansiye 1/6 (%16,7) 66,3 (45,4-87,2) Lenfovasküler Ġnvazyon Yok 8/45 (%17,8) 89,7 (75,3-104,2) Var 4/12 (%33,3) 57,4 (39,2-75,6) Perforasyon Yok 11/54 (%20,4) 86,8 (72,8-100,8) Var 1/3 (%33,3) 37,5 (13,7-61,3) 63 Log Rank p 0.09 0.768 0.082 0.365 0.36 0.547 0.30 0.581 1.44 0.697 0.87 0.646 2.37 0.124 0.38 0.537 Tablo 5.9. (devamı) Rekürrens (Hastalıksız Sağkalım) Üzerinde Etkili Olabilecek Faktörler -2 Rekürrenssiz DeğiĢkenler Rekürrens Oranı Sağkalım Log Rank p 1.62 0.805 0.73 0.393 5.88 0.015 1.04 0,307 3.85 0.146 0.28 0.599 1.10 0.295 - - Ortalama (%95GA) Tümör Lokalizasyonu Ġnen Kolon 1/6 (%16,7) 71,4 (49,1-93,8) Çıkan Kolon 4/19 (%21,1) 65,4 (52,6-78,2) Çekum 1/6 (%16,7) 61,5 (41,7-81,2) Sigmoid Kolon 6/21 (%28,6) 71,9 (45,8-97,9) Transvers Kolon 0/5 (%0,0) - Obstrüksiyon Yok 7/41 (%17,1) 95,3 (83,4-107,2) Var 5/16 (%31,3) 59,9 (45,0-74,8) T4 Lezyon Yok 2/31 (%6,5) 79,0 (72,5-85,6) Var 10/26 (%38,5) 72,2 (53,0-91,3) Kemoterapi Almayan 1/14 (%7,1) 68,7 (59,3-78,1) Alan 11/43 (25,6) 83,4 (68,5-98,3) Risk Grubu Yok 1/17 (%5,9) 71,8 (63,9-79,7) Bir Tane 2/14 (%14,3) 73,7 (60,6-86,8) Birden Fazla 9/26 (%34,6) 73,9 (54,1-93,7) LN Sayısı ≤7 3/9 (%33,3) 75,9 (43,6-108,3) >7 9/48 (%18,8) 67,7 (58,1-77,3) LN Sayısı ≤12 5/15 (%33,3) 72,7 (45,4-100,0) >12 7/42 (%16,7) 70,3 (61,1-79,6) 12/57 (%21,1) 86,5 (73-100) Genel GA: Güven Aralığı 64 Tekli değiĢkenli analizler sonucunda, rekürrensiz sağkalım üzerinde etkili olabilecek lenfovasküler invazyon, T4 lezyonu, bir ve birden fazla risk faktörünün bulunması, tümör boyutu gibi risk faktörleri çoklu değiĢkenli analize alındı. Rekürrens üzerinde etkili olabilecek bütün risk faktörlerine göre düzeltme yapıldığında istatistiksel olarak hiçbir risk faktörünün anlamlı etkisi görülmedi. Tablo 5.10. Rekürrens (Hastalıksız Sağkalım) Üzerinde Etkili Olabileceği DüĢünülen Risk Faktörlerin Çoklu DeğiĢkenli Cox Regresyon Yöntemine Göre Birlikte Etkilerinin Ġncelenmesi DeğiĢkenler Relatif Risk %95 Güven Aralığı p Alt Sınır Üst Sınır Lenfovasküler Ġnvazyon 3,657 0,064 0,926 14,447 T4 Lezyon 7,974 0,078 0,792 80,240 Bir Risk Grubu 0,488 0,642 0,024 10,001 Birden Fazla Risk Grubu 0,436 0,614 0,017 10,980 Tümör Boyutu 0,792 0,161 0,572 1,097 Hastaların yaĢ ortalaması 64,8 olup 30 ile 84 arasında değiĢmekteydi. Tümör boyutu ortalama olarak 5cm idi (minimum 2cm; maksimum 17cm) .Bu faktörlerin rekürrens ve genel sağ kalım üzerine etkisi incelendiğinde istatistiksel olarak anlamlı bulunmadı ancak klinik olarak anlamlı olduğu görüldü. Tablo 5.11. Rekürrens ve Genel Sağkalım Üzerinde YaĢ ve Tümör Büyüklüğünün Etkisi DeğiĢkenler Relatif Risk %95 Güven Aralığı p Rekürrens YaĢ 1,020 0.484 0,965-1,078 Tümör Boyutu 0,776 0.092 0,578-1,042 YaĢ 1,086 0.060 0,997-1,185 Tümör Boyutu 0,996 0.974 0,763-1,299 Genel Sağkalım 65 5.5. Kemoterapi Alan ve Almayan Gruplarda Klinikopatolojik Özelliklerin Sağkalım ve Rekürrens Üzerine Etkisi Vakaların 43‘ü cerrahi tedavi sonrasında adjuvan kemoterapi almıĢtı. 14 hastaya ise cerrahi tedavi sonrasında sadece takip yapılmıĢtı. Kemoterapi almayan grupta klinikopatolojik özelliklerin sağkalım ve rekürrens üzerine etkisi, hasta sayısının yetersiz olması nedeniyle istatistiksel değerlendirmeye alınmadı. Kemoterapi alan 43 hastada klinik vepatolojik özelliklerin rekürrens ve genel sağkalıma etkisi incelendiğinde ise hiçbir faktörün etkisi istatistiksel olarak anlamlı bulunmadı. Tablo 5.12. Kemoterapi Alan Grup Ġçerisinde Rekürrens ve Genel Sağkalım Üzerinde YaĢ ve Tümör Büyüklüğünün Etkisi DeğiĢkenler Relatif Risk %95 Güven Aralığı p Rekürrens YaĢ 1,056 0.138 0,983- 1,135 Tümör Boyutu 0,787 0.126 0,579- 1,070 YaĢ 1,102 0.089 0,985- 1,232 Tümör Boyutu 0,874 0.485 0,599- 1,275 Genel Sağkalım 66 Tablo 5.13. Kemoterapi Alan Grup Ġçerisinde Genel Sağkalım Üzerinde Etkili Olabilecek Faktörler -1 DeğiĢkenler Sağkalım Beklentisi Ölüm Oranı Ortalama (%95GA) Cinsiyet Kadın 3/21 (%14,3) 95,3 (77,4-1 13,3) Erkek 3/22 (%13,6) 72,6 (65,5- 79,7) YandaĢ Hastalık Yok 5/24 (%20,8) 89,0 (72,1- 105,8) Var 1/19 (%5,3) 73,7 (66,3- 81,0) Kanser Öyküsü Yok 6/41 (%14,6) 93,0 (79,6- 106,3) Var 0/2 (%0) - Patoloji Müsinöz Adenokarsinom 2/11 (%18,2) 81,2 (46,6- 115,8) Adenokarsinom 4/32 (%12,5) 75,8 (68,8- 82,8) Cerrahi Tipi Sağ Hemikolektomi 2/19 (%10,5) 74,4 (67,5- 81,3) Segmental Rezeksiyon 0/4 (%0) - Sigmoid Rezeksiyon 2/14 (%14,3) 89,3 (65,8- 112,8) Sol Hemikolektomi 2/6 (%33,3) 60,9 (37,0- 84,7) Grad Ġyi Diferansiye 1/8 (%12,5) 68,9 (48,2- 89,7) Orta Diferansiye 5/30 (%16,7) 92,6 (77,8- 107,5) Kötü Diferansiye 0/5 (%0) - Lenfovasküler Ġnvazyon Yok 5/34 (%14,7) 93,2 (78,5- 108,0) Var 1/9 (%11,1) 75,3 (68,6- 81,9) Perforasyon Yok 6/40 (%15,0) 92,7 (79,2- 106,2) Var 0/3 (%0) - 67 Log Rank p 0.00 0.962 0.97 0.324 0.05 0.816 1.12 0.290 3.83 0.280 0.66 0.720 0.00 0.972 0.18 0.668 Tablo 5.13. (devamı) Kemoterapi Alan Grup Ġçerisinde Genel Sağkalım Üzerinde Etkili Olabilecek Faktörler -2 DeğiĢkenler Sağkalım Beklentisi Ölüm Oranı Log Rank p Ortalama (%95GA) Tümör Lokalizasyonu Ġnen Kolon 1/5 (%20,0) 69,7 (47,0- 92,4) Çıkan Kolon 1/15 (%6,7) 75,7 (68,0- 83,5) Çekum 1/4 (%25,0) 68,1 (57,7- 78,6) Sigmoid Kolon 3/16 (%18,8) 85,0 (61,7- 108,4) Transvers Kolon 0/3 (%0) - Obstrüksiyon Yok 3/29 (%10,3) 98,4 (83,2- 113,6) Var 3/14 (%21,4) 68,9 (59,6- 78,3) T4 Lezyon Yok 2/20 (%10,0) 74,9 (63,1- 86,7) Var 4/23 (%17,4) 90,5 (73,8- 107,3) Risk Grubu Yok 2/10 (%20,0) 62,1 (46,0- 78,2) Bir Tane 1/11 (%9,1) 73,9 (58,0- 89,9) Birden Fazla 3/22 (%13,6) 92,0 (73,8- 110,1) LN Sayısı ≤7 1/8 (%12,5) 95,6 (67,7- 123,5) >7 5/35 (%14,3) 73,7 (65,9- 81,4) LN Sayısı ≤12 2/13 (%15,4) 86,8 (61,2- 112,5) >12 4/30 (%13,3) 74,8 (66,7- 82,9) Genel 6/43 (%14,0) 93,1 (79,7- 106,4) GA: Güven Aralığı 68 1.96 0.742 0.89 0.345 0.02 0.889 0.32 0.853 0.14 0.705 0.05 0.831 - - Tablo 5.14. Kemoterapi Alan Grup Ġçerisinde Hastalıksız Sağkalım Üzerinde Etkili Olabilecek Faktörler -1 Rekürrenssiz DeğiĢkenler Rekürrens Oranı Sağkalım Log Rank p 0,08 0,774 0,31 0,576 0,43 0,512 1,46 0,227 2,26 0,520 0,55 0,758 0,96 0,326 0,22 0,641 Ortalama (%95GA) Cinsiyet Kadın 6/21 (%28,6) 81,5 (60,7- 102,3) Erkek 5/22 (%22,7) 64,6 (52,8- 76,4) YandaĢ Hastalık Yok 7/24 (%29,2) 81,9 (62,4- 101,3) Var 4/19 (%21,1) 63,3 (51,3- 75,3) Kanser Öyküsü Yok 11/41 (%26,8) 82,6 (67,5- 97,7) Var 0/2 (%0) - Patoloji Müsinöz Adenokarsinom Adenokarsinom 4/11 (%36,4) 68,9 (35,5- 102,2) 7/32 (%21,9) 68,0 (57,8- 78,2) Cerrahi Tipi Sağ Hemikolektomi 4/19 (%21,1) 65,7 (53,3- 78,1) Segmental Rezeksiyon 0/4 (%0) - Sigmoid Rezeksiyon 5/14 (%35,7) 70,5 (43,6- 97,5) Sol Hemikolektomi 2/6 (%33,3) 59,0 (30,8- 87,2) Grad Ġyi Diferansiye 1/8 (%12,5) 75,1 (58,9- 91,3) Orta Diferansiye 9/30 (%30,0) 79,9 (62,4- 97,4) Kötü Diferansiye 1/5 (%20,0) 64,0 (39,3- 88,6) Lenfovasküler Ġnvazyon Yok 8/34 (%23,5) 85,9 (69,9- 101,9) Var 3/9 (%33,3) 57,8 (37,1- 78,5) Perforasyon Yok 10/40 (%25,0) 83,7 (68,2- 99,2) Var 1/3 (%33,3) 37,5 (13,7- 61,3) 69 Tablo 5.14. (devamı) KT Alan Grup Ġçerisinde Hastalıksız Sağkalım Üzerinde Etkili Olabilecek Faktörler -2 Rekürrenssiz DeğiĢkenler Rekürrens Oranı Sağkalım Log Rank p Ortalama (%95GA) Tümör Lokalizasyonu Ġnen Kolon 1/5 (%20,0) 68,9 (42,7- 95,2) Çıkan Kolon 3/15 (%20,0) 66,3 (52,3- 80,3) Çekum 1/4 (%25,0) 61,5 (41,7- 81,2) Sigmoid Kolon 6/16 (%37,5) 67,6 (41,4- 93,9) Transvers Kolon 0/3 (%0) - Obstrüksiyon Yok 6/29 (%20,7) 92,2 (77,3- 107,0) Var 5/14 (%35,7) 59,0 (43,6- 74,3) T4 Lezyon Yok 2/20 (%10,0) 76,6 (66,9- 86,2) Var 9/23 (%39,1) 73,0 (53,3- 92,7) Risk Grubu Yok 1/10 (%10,0) 69,3 (56,9- 81,7) Bir Tane 2/11 (%18,2) 70,9 (54,7- 87,2) Birden Fazla 8/22 (%36,4) 74,0 (53,5- 94,5) LN Sayısı ≤7 3/8 (%37,5) 73,6 (40,2- 107,1) >7 8/35 (%22,9) 65,8 (54,9- 76,6) LN Sayısı ≤12 5/13 (%38,5) 69,5 (41,8- 97,2) >12 6/30 (%20,0) 68,7 (57,8- 79,5) 11/43 (%25,6) 83,4 (68,5- 98,3) Genel GA: Güven Aralığı 70 2,04 0.729 0,59 0.444 2,87 0.090 1,84 0.398 0,25 0.619 1,11 0.292 - - 1,0 ,9 ,8 ,7 ,6 ,5 ,4 ,3 ,2 Sağkalım Fonksiyonu ,1 Rekürrens Yok 0,0 0 24 48 72 96 120 Takip Süresi (ay) ġekil 5.1. Tüm Vakaların Rekürrenssiz (Hastalıksız Sağkalıma) Sağkalım Eğrisi 1,0 ,9 ,8 ,7 ,6 ,5 ,4 ,3 ,2 Sağkalım Fonksiyonu ,1 0,0 Hayatta Kalan 0 24 48 72 96 Takip Süresi (ay) ġekil 5.2. Tüm Vakaların Genel Sağkalım Eğrisi 71 120 6. TARTIġMA Kolon kanseri en sık görülen neoplazilerden biridir. Dünya çapında her yıl en az bir milyon kiĢi kolon kanseri tanısı almaktadır ve kanserden ölümlerin ikinci en sık nedenidir. Tanı anında vakaların % 75-80‘ inde hastalık organ ya da bölgesel lenf nodlarına sınırlıdır ve cerrahi tek küratif tedavidir. Ancak radikal rezeksiyondan sonra bile halen rekürrens ihtimali vardır. Duvar infiltrasyonunun derinliği ve lenf nodu metastazlarının varlığı yaygın olarak kabul gören rekürrens için en iyi prognostik faktörlerdir. AJCC TNM evreleme sistemine göre toplam hasta sayısının ¼ ünü oluĢturan evre II kolon kanserli hastaların (T3-4/N0) küratif cerrahi sonrası prognozları oldukça iyidir. 5 yıllık sağkalım süreleri T4N0 için % 72, T3N0 için % 85 oranında değiĢmektedir. Evre II kolon kanserli hastalarda adjuvan tedavinin yeri halen tartıĢmalıdır. Yüksek risk faktörleri olarak T4 tümör, vasküler veya perinöral invazyon, kötü diferensiye tümörler, cerrahi sınır pozitifliği, tanı anında perforasyon ve obstruksiyon kliniği ya da 12 den az lenf nodu çıkarılması tanımlanmıĢtır. Elde edilen veriler bu özellikleri olan hastaların % 60 olan 5 yıllık sağkalım sürelerinin evre 3 hastalara benzer olduğunu göstermektedir (94). Bu nedenle her nekadar etkinliği prospektif olarak geçerlilik kazanmamıĢ olsa da adjuvan kemoterapi genellikle bu özelliklerden en az birine sahip olan hastalara önerilmektedir. Kolon kanseri görülme sıklığı 40 yaĢından sonra giderek artmaktadır ve 60-75 yaĢ arası tepe yapmaktadır (19). Bazı araĢtırmacılar yaĢlılarda görülen kolon kanserinin yerleĢim, evre ve prognoz açısından gençlerde görülen kolon kanserinden belirgin bir farkı olmadığını belirtmiĢlerdir (111,112). Fietkau ve ark. (113) tarafından 6016 hasta ile yapılan çalıĢmada artan yaĢla beraber kolon kanseri sıklığı artarken sağ kalım oranlarında anlamlı fark olmadığı gösterilmiĢtir. Alici ve ark.(112) tarafından yapılan bir çalıĢmada ise 40 yaĢ öncesi ve sonrası gruplar arasında sağ kalım açısından fark olmadığı saptanmıĢtır. Quah ve ark. yaptığı evre II kolon kanserli hastalarda adjuvan kemoterapi için yüksek risk faktörlerini saptamayı amaçladıkları çalıĢmada da yaĢın prognostik faktör olmadığı gösterilmiĢtir (114). ÇalıĢmamızda yaĢ ortalaması 68 idi. Literatürle benzer Ģekilde evre II kolon kanserli hastalarda yaĢ faktörünün rekürrens ve genel sağkalım üzerine etkisi saptanmamıĢtır. Yine kemoterapi alan grupta da yaĢ faktörünün sağkalım ve rekürrens üzerine etkisi istatistiksel olarak anlamlı bulunmamıĢtır. 72 Kolon kanseri erkeklerde biraz daha sık görülmektedir.(19,20). Han Shiang ve ark. tarafından (115) 2082 hasta ile yapılan çalıĢmada erkek cinsiyetin kötü prognostik faktör olduğu belirtilmiĢtir. Yine Asaad ve arkadaĢları (116) tarafından evre II kolon kanserli hastalarda yapılan bir çalıĢmada erkek cinsiyetinin kötü prognostik faktör olduğu bildirilmiĢtir. Ancak çalıĢmaların çoğunda erkek ve kadın arasında prognoz açısından istatistiksel olarak anlamlı bir fark saptanmadığı görülmüĢtür (117). Bizim çalıĢmamızda da literatürle benzer Ģekilde evre II kolon kanserli erkek hastalarda mortalite oranı % 15,4 iken bu oranın kadın hastalarda %9,7 olduğu saptandı. Ancak cinsiyetin genel sağkalıma etkisi istatistiksel olarak anlamlı bulunmadı (p = 0.63). Yine cinsiyetin rekürrens üzerine de etkisinin olmadığı görüldü.(p = 0.76) ÇeĢitli çalıĢmalar kolon kanserli hastalarda birden fazla ek sistemik hastalığı olmasının sağkalıma etkisinin zayıf olduğunu göstermiĢtir. Sarfati ve ark. yaptığı çalıĢmada 776 kolon kanserli hastada komorbiditenin sağkalıma etkisi araĢtırılmıĢtır. Hastaların % 70‘inde en az bir tane ek sistemik hastalığı olduğu görülmüĢ ve en çok HT (%38) KOAH (%21,9) DM (%16,1) hastalıkları saptanmıĢtır. ÇalıĢma sonunda komorbiditenin sağkalıma etkisi istatistiksel olarak anlamlı bulunmamıĢtır (118). Benzer Ģekilde çalıĢmamızda hastaların çoğunda tanı anında HT mevcuttu (%19,3). Kemoterapi alan 43 hastanın 19 ‗unda bir veya birden fazla ek sistemik hastalık vardı. Yapılan istatistiksel analiz sonucunda genel olarak evre II kolon kanserli hastalarda ve kemoterapi alanlarda yandaĢ hastalık olmasının rekürrens ve sağkalım üzerine etkisi anlamlı bulunmadı. Sadece 2 hastada kanser öyküsü mevcut olduğundan kanser öyküsünün sağkalım ve rekürrens üzerine etkisinin istatistiksel analizi sayı yetersizliği nedeniyle yapılamadı. Müsinöz karsinomlar içinde taĢlı yüzük hücreli türü daha agresif seyreder (44). HanShiang ve ark.(115) tarafından 2082 vaka ile yapılan çalıĢmada müsinöz karsinomların müsinöz olmayanlara göre daha kötü prognozla iliĢkili olduğu belirlenmiĢtir. Quah ve ark. nın yaptığı çalıĢmada (114) evre II kolon kanserli 448 hastada müsinöz karsinom ve taĢlı yüzük hücreli karsinom varlığının sağkalıma etkisi olmadığı saptanmıĢ olup yüksek risk faktörü olarak kabul edilmemiĢtir. ÇalıĢmamızda da müsinöz karsinom ve adenokarsinom histopatolojisi karĢılaĢtırılmıĢtır. Müsinöz karsinomda rekürrens oranı % 22,8 iken, adenokarsinomda bu oranın % 20,5 olduğu görülmüĢtür. Evre II kolon kanserli hastalarda 73 histopatolojik tanının genel sağkalım ve rekürrens üzerine etkisi istatistiksel olarak anlamlı bulunmamıĢtır. Primer tümörün yerleĢim yerinin prognoz üzerine etkisi çeĢitli çalıĢmalarda araĢtırılmıĢtır. Burton ve ark. (119) tarafından yapılan bir çalıĢmada 4 yıllık sağkalım oranlarının sağ (%57) ve sol (% 52,5) taraflı kolon kanserleri arasında anlamlı farklılık göstermediği saptanmıĢtır (p = 0,46). Quah ve arkadaĢlarının yaptığı çalıĢmada da tümör lokalizasyonunun evre II kolon kanserli hastalarda 5 yıllık hastalığa özgü sağkalıma etkisinin olmadığı görülmüĢ ve yüksek risk faktörü olmadığı kabul edilmiĢtir (114). Kolon cerrahisi yönünden deneyimsiz merkezlerde erken nükslerin daha fazla görüldüğünü bildiren çalıĢmalar vardır (120). Bizim çalıĢmamızda inen kolon ve sigmoid kolonda görülen tümörlerde mortalite oranı yüksek bulunmuĢtur (%33,6 ve %14,3). Yine tümör sigmoid kolonda lokalize ise rekürrensin daha fazla görüldüğü saptanmıĢtır.-(%28,6). Genel olarak evre II kolon kanserli hastalarda ve kemoterapi alanlarda tümör lokalizasyonunun ve cerrahi tipinin rekürrens ve genel sağkalıma etkisi istatistiksel olarak anlamlı bulunmamıĢtır. Tümör gradının prognoz üzerine önemli etkisi vardır (111,44). Cohen ve ark. (121) tarafından yapılan bir çalıĢmada histolojik grad anlamlı prognostik faktör olarak bulunmuĢtur. Gill ve ark. (122) tarafından flourourasil bazlı kemoterapi alan 3302 evre II ve 3 kolon kanserli hastada yapılan çalıĢmada histolojik grade lokal rekürrens ve genel sağkalım için anlamlı prognostik faktör olarak bulunmuĢtur. Bizim çalıĢmamızda histolojik gradın genel sağkalım üzerine etkisi olmadığı görülmüĢtür (p = 0.58). Histolojik grada göre yapılan değerlendirmede orta diferansiye ve kötü diferansiye tümörü olan hastalarda rekürrens oranları artmıĢ olmasına rağmen hastalıksız sağkalım üzerine etkisi istatistiksel olarak anlamlı bulunmadı. Yine literatürden farklı olarak bizim çalıĢmamızda kemoterapi alan evre II kolon kanserli hastalarda da histolojik gradın sağkalım ve rekürrens üzerine etkisinin olmadığı görüldü. Bu farklılığın diğer çalıĢmalardan farklı olarak sadece evre II kolon kanserli hasta grubunda analiz yapıldığından hasta sayısının az olmasıyla iliĢkili olduğu düĢünüldü. Vasküler invazyon varlığı önemli bir prognostik faktördür ve patoloji raporunda mutlaka belirtilmelidir. 448 evre II kolon kanserli hastanın katıldığı Quah ve arkadaĢlarının yaptığı çalıĢmada lenfovasküler ve perinöral invazyon varlığının sağkalıma etkisi olduğu gösterilmiĢtir. (p = 0.02) (114). Lenfovasküler veya perinöral invazyon varlığında 5 yıllık 74 hastalığa özgü sağkalım oranı % 80 iken bu faktörlerin yokluğunda bu oran % 92 olarak saptanmıĢtır.(GA:%95) Yine 600 den fazla kolon kanserli hastanın katıldığı bir çalıĢmanın çok değiĢkenli analizinde lenfovasküler invazyonun rekürrens riskini 2,8 kat arttırdığı gösterilmiĢtir. (p < 0.001) (63) Petersen ve ark.(123) tarafından patolojik prognostik faktörlerin araĢtırıldığı Dukes B kolon kanserli hastalarda damar invazyon varlığı bağımsız prognostik faktör olarak bulunmuĢtur. AJCC bu bulguların ıĢığında damar invazyon varlığını kötü prognostik faktör olarak belirtmiĢtir (123). Bizim çalıĢmamızda lenfovasküler invazyon varlığında rekürrens oranı % 33 iken yokluğunda ise bu oranın % 17,8 olduğu saptanmıĢtır. Ġstatistiksel olarak anlamlı bulunmasa da lenfovasküler invazyon varlığının, evre II kolon kanserli hastalarda literatür ile benzer Ģekilde rekürrens oranını 2 kat arttırmaktadır. Yine bu çalıĢmada Quah ve arkadaĢlarının yaptığı çalıĢmadaki sonuçlara benzer sonuçlar elde edilmiĢ; lenfovasküler invazyon varlığında sağkalım oranı % 76,9, yokluğunda ise %90,7 olarak saptanmıĢtır .Ancak istatistiksel olarak sağkalım üzerine etkisi anlamlı bulunmamıĢtır. Kemoterapi alan evre II kolon kanserli hastalarda da lenfovasküler invazyonun sağkalım ve rekürrensi etkilemediği görülmüĢtür. Kolon kanserli hastalarda görülen baĢlıca akut semptom obstruksiyon ve daha az oranda da perforasyondur (124). Literatürde obstruksiyonla baĢvuran kolon kanserli hasta oranının % 10 civarında olduğu bildirilmiĢtir (124,125). Petersen ve ark.(123) tarafından patolojik prognostik faktörlerin araĢtırıldığı çalıĢmada Dukes B kolon kanserli hastalarda perforasyon bağımsız kötü prognostik faktör olarak bulunmuĢtur. Rault ve ark.(126) tarafından yapılan çalıĢmada ise operasyon öncesi obstruksiyon ile baĢvuran hastada prognozun daha kötü olduğu gösterilmiĢtir. Quah ve ark. nın yaptığı çalıĢmada perforasyon ve obstruksiyon varlığının sağkalıma etkisi istatistiksel olarak anlamlı bulunmamıĢtır (114). ÇalıĢmamızda evre II kolon kanserli hastalarda tanı anında obstruksiyon kliniğinin olması durumunda mortalite oranı % 18,8 olarak bulundu ve yine rekürrens oranının daha yüksek olduğu görüldü.(%31,3) Ancak genel sağkalım ve rekürrens üzerine etkisi istatistiksel olarak anlamlı bulunmadı. Kaybedilen 7 hastanın hiçbirinde tanı anında perforasyon kliniği olmadığı için bu faktörün sağkalıma etkisi değerlendirilemedi. Tanı anında perforasyon kliniği olan 3 hastanın birinde nüks saptandığından rekürrens oranının yüksek olduğu görüldü.(%33.3) Hasta sayısının az olmasından dolayı perforasyon varlığının rekürrens üzerine etkisi istatistiksel olarak anlamlı bulunmadı (p = 0.53). Yine 75 kemoterapi alan evre II kolon kanserli hastalarda ayrıca incelendiğinde perforasyon ve obstruksiyon kliniğinin sağkalım ve rekürrens üzerine etkisinin olmadığı görüldü. Cerrahi sınır pozitifliği çalıĢmlarda kötü prognostik faktör olarak gösterilmiĢtir. (111,125) Mekele ve ark.(127) tarafından 50 yaĢ öncesi kolon kanserli hastalarda prognostik faktörlerin araĢtırıldığı bir çalıĢmada cerrahi sınır pozitifliği lokal rekürrens ve genel sağkalımiçin anlamlı prognostik faktör olarak bulunmuĢtur. Petersen ve ark.(123) tarafından yapılan çalıĢmada Dukes B kolon kanserli hastalarda cerrahi sınır pozitifliği bağımsız kötü prognostik faktör olarak belirtilmiĢtir. Bu bulguların ıĢığında AJCC (128) cerrahi sınır pozitifliğini kötü prognostik faktör olarak kabul etmiĢtir. ÇalıĢmamızda bir hastada cerrahi sınır pozitifliği bulunduğundan sağkalım ve rekürrens üzerine etkisi istatistiksel olarak analiz edilemedi. Tümör çapı ile prognoz arasında iliĢki olduğunu belirten araĢtırmacılar varsa da çoğunlukla tümör çapı ile prognoz arasında belirgin bir iliĢki bulunmadığı kabul edilmektedir( 44, 111). Quah ve ark. nın yaptığı çalıĢmada evre II kolon kanserli hastalarda tümör çapının sağkalıma etkisinin olmadığı gösterilmiĢtir (114). Park ve ark.(129) tarafından 2230 hastanın katıldığı çalıĢmada tümör çapı prognozla iliĢkisiz bulunmuĢtur. Bizim çalıĢmamızda tümör çapı ortalaması 5cm idi (aralık, 2-17cm). Evre II kolon kanserli hastalarda ve kemoterapi alan grupta tümör çapının sağkalım ve rekürrens üzerine etkisinin olmadığı saptanmıĢtır. Barsak duvarına invazyon derinliği TNM evreleme sisteminin esasını teĢkil eder ve temel prognostik kaktörlerden biri olarak kabul edilmektedir (44, 111). T4 primer tümörü olan evre II kolon kanserli hastaların 5 yıllık sağkalım oranları % 72 dir. Bu oran T2 primer tümörü ve 4 den daha az lenf nodu tutulumu olan evre 3 kolon kanserli hastaların 5 yıllık sağkalım oranından daha düĢüktür. Burton ve ark. (119) tarafından yapılan çalıĢmada T4 evre kötü prognostik faktör olarak bulunmuĢtur. Gill ve ark. (122) tarafından fluorourasil bazlı kemoterapi alan 3302 evre II ve evre 3 kolon kanserli hastada tümöral invazyon rekürrens ve genel sağkalım ile iliĢkili prognostik faktör olarak bulunmuĢtur. Quah ve ark.(114) tarafından yapılan çalıĢma evre II kolon kanserli hastada yüksek risk faktörlerini belirlemeyi amaçlamıĢtır. Bu çalıĢmaya 448 tane posoperatif kemoterapi almadan sadece cerrahi tedavi yapılan evre II kolon kanserli hasta dahil edilmiĢ. 53 aylık ortalama izlem süresinde T4 tümör bulunması T3 tümör ile karĢılaĢtırıldığında, 5 yıllık hastalığa özgü sağkalım oranı T3 tümörde % 92 (89- 95), T4 tümörde % 69 (61-98) olarak saptanmıĢtır. 76 Bizim çalıĢmamızda T4 evre T3 evre ile karĢılaĢtırıldığında T4 tümör varlığında mortalite oranı % 15,4, T3 evrede ise % 9,7 olarak saptandı. Ancak T4 varlığının genel sağkalıma etkisi istatistiksel olarak anlamlı bulunmadı.(p=0,8) T4 evrede rekürrens oranının %38,5, T3 evrede ise %6,5 olduğu görüldü. T4 evrenin rekürrens üzerine etkisi olduğu saptandı (p = 0,015). Kemoterapi alan evre II kolon kanserli hastalarda ise T4 tümörün rekürrens ve genel sağkalım üzerine etkisi istatistiksel olarak anlamlı bulunmadı. Sonuç olarak T4 evre, bağımsız kötü prognostik faktör olarak kabul edildi. TNM evrleme sisteminin bir parçası olarak lenf nodu analizi prognoz hakkında bilgi sağlamaktadır. Kolon kanserinde çıkarılan lenf nodu sayısının ne olması gerektiği konusunda farklı otörler tarafından farklı öneriler yapılmıĢtır (44,76). 2007 yılında AJCC ve Amerikan Ulusal Kanser Enstitüsü (NCI) sponsorluğunda düzenlenen bir panelde kolon kanseri hastalarında en az 12 adet lenf nodu çıkarılması gerektiği bildirilmiĢtir.(130) Asaad ve ark. (116) tarafından TNM evre II 174 kolon kanserli hastada prognostik faktörlerin araĢtırıldığı çalıĢmada 7 ve daha az sayıda lenf nodu çıkarılan grupta prognozun daha kötü olduğu gösterilmiĢtir. Prandi ve ark.(131) tarafından 3648 kolon kanserli hastada yapılan çalıĢmada aynı evrede çıkarılan lenf nodu sayısı 8-12 arasında olan hastaların; 7 ve daha az sayıda lenf nodu çıkarılan hastalara göre daha uzun bir HSK ve GSK sürelerine sahip olduğu bulunmuĢtur. Yine bu çalıĢmanın sonuç kısmında, yetersiz sayıda lenf nodu çıkarılan evre II hastaların kesin olarak evre II kabul edilmeyecekleri; bu hastalarda daha düĢük sağkalım beklentisi nedeniyle adjuvan kemoterapi almaları gerektiği belirtilmiĢtir. 61371 evre II kolon kanseri hastasının katıldığı 17 çalıĢmanın sonuçlarının yayınlandığı reviewde, artmıĢ lenf nodu incelemesi ile artmıĢ sağkalım oranlarının 17 çalıĢmadan 16‘ sında saptandığı gösterilmiĢtir (63). Her ne kadar düĢük ve yüksek riskli hastaların ayırımında 12 rezeke edilmiĢ lenf nodu cut-off değeri kullanılsa da risk derecesi süreklidir. Örneğin pek çok çalıĢmada 20 lenf nodu çıkarılan hastaların 15 lenf nodu çıkarılanlara göre daha olumlu sonuçların olduğu gösterilmiĢtir. Yine National Cancer Database‘n yaptığı geniĢ populasyonlu bir çalıĢma 35787 hastada rezeke edilen lenf nodu sayısının sağkalım süreleri ile iliĢkisini araĢtırmıĢtır.1-7 lenf nodu rezeksiyonu yapılan hastalar ile karĢılaĢtırıldığında 8-12 yada 13 den fazla lenf nodu eksize edilen hastalarda ölüm riski % 19-32 daha düĢük saptanmıĢtır.(p < 0.01) (63). ÇalıĢmamızda 12 den daha az lenf nodu diseksiyonu yapılan evre II kolon kanserli hastalarda mortalite oranı % 13,3 iken 12 den daha fazla lenf nodu diseksiyonu yapılan hastalarda ise mortalite oranı % 11,9 olarak saptandı. 7‘den daha az lenf nodu rezeksiyonu yapılan hastalarda ise mortalite oranı %11,1 77 iken bu oran 7‘den fazla lenf nodu çıkarılanlarda %12,5 idi. Diseke edilen lenf nodu sayısının genel sağkalıma etkisinin olmadığı görüldü. Literatürden farklı sonuçların elde edilmesinde hasta sayısının yetersiz olmasının payı olduğu düĢünüldü. ÇalıĢmamız sonucunda istatistiksel olarak anlamlı sonuç elde edilmese de rezeke edilen lenf nodu sayısının hastalığın rekürrensi ile iliĢkili olduğu düĢünülmektedir. 12‘den ve 7‘den daha az lenf nodu örneklemesi yapılan hastalarda rekürrens oranları % 33,3 iken 12 ve 7‘den fazla lenf nodu diseksiyonu yapılan hastalarda bu oran sırasıyla %16,7 ile %18,8 olarak saptandı. Kemoterapi alan evre II kolon kanserli hastalarda da çıkarılan lenf nodu sayısının rekürrens ve genel sağkalım üzerine etkisi istatistiksel olarak anlamlı bulunmadı. Evre II kolon kanseri için yüksek riskli özellikleri tanımlamak üzere guidelinelar oluĢturulmuĢtur. Yüksek riskli evre II kolon kanseri hastalığı aĢağıdakilerden en az birinin varlığı ile tanımlanmaktadır; T4 tümör, kötü histolojik grade, lenfovasküler tutulum, baĢvuru esnasında barsak obstruksiyonu, lokalize perforasyon ya da belirlenemeyen pozitif sınırları olan T3 lezyonu ve yetersiz örneklenmiĢ lenf nodlarıdır.(1 den az) (95). Elde edilen veriler bu özellikleri olan hastaların % 60 olan 5 yıllık sağkalım sürelerinin evre 3 hastalara benzer özellikte olduğunu göstermektedir. (94) Bu nedenle her ne kadar etkinliği prospektif olarak geçerlilik kazanmamıĢ olsa da adjuvan kemoterapi genellikle bu özelliklerden en az birine sahip olan evre II kolon kanserli hastalara önerilmektedir. Intergroup 0035 çalıĢması, yüksek riskli 318 evre II kolon kanseri hastanın retrospektif analizi sonucunda bu grupta adjuvan tedavi ile sağkalım süresinde fayda sağlandığını öne sürmüĢtür.(94) Adjuvan kemoterapi alan yüksek riskli hastaların almayan hastalarla retrospektif olarak karĢılaĢtırıldığında sağkalım sürelerinde anlamlı farklılık saptanmamıĢtır.(94) ASCO tarafından geliĢtirilen rehberler nöral invazyonu da yüksek risk özelliği olarak kategorize etmektedir (96). Bu rehberde evre II hastalar için adjuvan kemoterapiden olası mutlak yararlanım 5 yıllık sağkalım oranlarında %2-4 artıĢ olarak tahmin edilmektedir. Bizim çalıĢmamızda da T4 lezyon,12 den daha az lenf nodu örneklemesi yapılması, cerrahi sınır pozitifliği, tanı anında perforasyon ya da obstruksiyon bulgusu olması, lenfovasküler invazyon, kötü diferansiyasyon gibi bulgular yüksek risk faktörleri olarak kabul edildi. Hastalar 1 ve 1‘den fazla risk faktörü taĢımalarına göre gruplandırıldı. Birden fazla risk faktörü olan evre II kolon kanserli hastalarda rekürrens oranının daha yüksek olduğu görüldü (%34,6) ancak rekürrens üzerine etkisi istatistiksel olarak anlamlı bulunmadı (p = 0.14). Birden fazla risk faktörü olanlarda mortalite oranı %11,5 iken risk faktörü olmayanlarda bu oranın %17,7 olduğu görüldü. Bu oransal 78 farklılık hasta sayısının yetersizliğine bağlandı. Kemoterapi alan grupta da birden fazla risk faktörü olanlarda rekürrens oranının daha yüksek olduğu görüldü ancak risk faktörünün olmasının rekürrens ve genel sağkalım üzerine etkisi istatistiksel olarak anlamlı bulunmadı. Kolon kanseri erken evrede yakalanıldığı zaman, minimal morbidite ve mortalitesi olan uygun cerrahi giriĢim ile yüksek oranda küratif tedavi edilebilen bir malignitedir. (132) Tek baĢına cerrahiyle sağlanan % 75‘lik sağ kalıma rağmen, bazı evre II hastalar, nod pozitif hastalarınkine benzer sonuçlarla daha yüksek bir relaps riskine sahiptirler. Adjuvan kemoterapi, % 30‘ lara varan genel sağ kalım avantajı sunmaktadır.(133) Adjuvan kemoterapi genellikle yüksek riskli evre II kolon kanseri hastalarına (T4 lezyon, perforasyon, kötü diferensiye histoloji veya yetersiz lenf nodu örneklemesi gibi ) verilmektedir. Birçok analiz, adjuvan tedavi alan evre II hastalarda çok değiĢken sonuçlar bildirmiĢtir. 1565 evre II hastanın aldığı tedavi protokollerinin, Ulusal Cerrahi Adjuvan Meme ve Barsak Projesi (NSABP) tarafından yapılan derlemesi, mortalitede % 32‘ lik bir relatif azalma bildirmiĢtir. Mortalitedeki bu azalma %5‘ lik bir mutlak sağ kalım avantajına dönüĢmüĢtür.(134) Erlichman ve ark‘ın yaptığı bir meta-analiz (135) , ardıĢık 5 gün 5-FU ve LV ile tedavi edilmiĢ 1020 yüksek riskli T3 ve T4 kanserli hastada % 2‘lik bir anlamlı olmayan kazanç saptamıĢtır.(% 82‘ye %80, p = 0.217) Yine Schrag ve arkadaĢlarının yaptığı bir baĢka çalıĢmada aralarında %31‘inin adjuvan tedavi alığı 3700 rezeke edilmiĢ evre II kolon kanseri hasta belirlenmiĢ.(136) 5 FU ile, tıkanma, perforasyon ve T4 lezyonlardan dolayı yüksek riskli kabul edien hastalarda bile tek baĢına cerrahiyle kıyasla, sağkalım katkısı (%74‘e %72) saptanmamıĢtır. Yakın tarihli MOSAIC çalıĢmasında, FOLFOX-4 kemoterapisi evre II hastalarda istatistiksel olarak anlamlı olmasa da avantaj sağlamıĢtır. BaĢka bir çalıĢmada ise kemoterapi yada tek baĢına cerrahiye randomize edilen evre II hastalarda medyan 4.2 aylık bir takip sonrasında ölüm riski ve nüks oranı 5 FU ve LV kemoterapisi lehine olmuĢtur. Ġngiltere‘de QUASAR çalıĢmasında 3239 hasta (%91 evre II kolon kanseri) 5-FU/FA alan ya da gözlem yapılanlar olmak üzere randomize edilmiĢti. 5,5 yıllık bir gözlem sonrası araĢtırmacılar 5-FU/FA‘nın evre II hastaların sağkalım oranlarında iyileĢtirdiğini gösterdiler. Her ne kadar mutlak fayda az miktarda olsa da kemoterapisiz 5 yıllık mortalite % 20 olarak varsayıldığında relatif ölüm riski sağkalım sürelerinde %3,6‘lık mutlak bir artıĢa dönüĢmektedir.(95% GA,1.0 - 6.0) ÇalıĢmanın düzenlenmesinde pek çok olumsuz nokta bulunması (rektal kanserli hastaların çalıĢmaya dahil edilmesi, merkezi patolojik incelemede kalite kontrolünün bulunmaması,4 değiĢik 5FU/FA rejiminin kullanılması) herhangi bir sonuca varmayı engellemiĢtiri (94). 79 Intergroup 0035 çalıĢmasında yüksek riskli evre II kolon kanserli 318 hastanın retrospektif analizi bu grupta adjuvan kemoterapi ile sağkalım sürelerinde fayda sağlandığını öne sürmüĢtür (94). Adjuvan kemoterapi alan yüksek riskli hastaların almayan hastalarla retrospektif olarak karĢılaĢtırıldığında sağkalım sürelerinde anlamlı farklılık saptanmamıĢtır (94). Pek çok çalıĢmada evre II kolon kanserinde adjuvan kemoterapi ile sağkalım sürelerinde küçük, ancak istatistiksel olarak anlamlı olmayan bir artıĢ(%2-%5) olduğu gösterilmiĢtir. Ancak çalıĢmaların çoğu evre II ve evre III kolon kanserli hastaları içerdiği için sadece evre II hastaların sağkalım sürelerinin analizi anlamlı değildir. Bu nedenle evre II hastalara adjuvan kemoterapi verilmesi kararı, çalıĢmaların alt grup analizlerine, veritabanı çalıĢmalarına ve metaanaliz çalıĢmalarına dayanmaktadır. Buna göre evre II hastaların katıldığı (1016 hasta) 5 Avrupa çalıĢmasının en büyüklerinden biri olan IMPACT analizi adjuvan kemoterapi sonrasında sağkalım sürelerinde istatistiksel olarak anlamlı artıĢ olduğunu gösterememiĢtir (94). Bizim çalıĢmamızda da kemoterapi alan evre II kolon kanserli hastalarda ortalama sağkalım beklentisi %93,1, almayanlarda ise %73,7 olarak saptandı. YaklaĢık % 20 gibi sağkalım avantajı olduğu görülse de literatürle benzer Ģekilde adjuvan kemoterapi verilmesinin evre II kolon kanserli hastalarda genel sağkalıma etkisinin istatistiksel olarak anlamlı olmadığı görülmüĢtür (p = 0,87). Kemoterapi alan hastalarda rekürrens oranının daha yüksek olduğu görüldü.(%25,6) Ancak sadece cerrahi tedavi sonucunda gözlem yapılan hastalarla kemoterapi alan hastalar karĢılaĢtırıldığında rekürrensiz sağkalım oranının adjuvan kemoterapi alanlarda daha yüksek olduğu görüldü.(%83,4 vs.%68,7 GA:%95)Yine kemoterapi verilmesinin hastalıksız sağkalım süresine avantajı olduğu düĢünülse de istatistiksel olarak etkisi anlamlı bulunmadı. (p=0,307) Birden fazla risk faktörü olan ve kemoterapi alan hastalarda ortalama hastalıksız sağkalım süresinin artmıĢ olduğu saptandı. Adjuvan kemoterapi alan evre II kolon kanserli hastalarda T3 ve T4 tümörü karĢılaĢtırıldığında T4 tümörü olanların kemoterapiden daha fazla fayda gördüğü düĢünülmüĢtür (sağkalım beklentisi ortalama % 90,5 ; %95 GA). Ancak bu hasta gruplarında da kemoterapinin rekürrens ve genel sağkalım üzerine etkisi istatistiksel olarak anlamlı bulunmamıĢtır. ÇalıĢmada sadece evre II kolon kanserli hastalar katıldığından hasta sayısındaki yetersizlik ve çoğunluğu MAYO rejimi olsa da kemoterapinin standardize edilmemesi nedeniyle istatistiksel olarak anlamlı sonuç elde edilemediği düĢünülmektedir. 80 Amerikan Klinik Onkoloji Derneği paneli, evre II hastalar için adjuvant kemoterapi kullanımının önerilmemesi kararıyla sonuçlanmıĢtır (133). Otuz yedi randomize kontrollü çalıĢma ve 11 meta-analizin bir derlemesi, postoperatif tedaviyle istatistiksel olarak anlamlı hiçbir sağkalım avantajı bulamamıĢtır. Tedavi, özel hasta alt grupları (T4 lezyon, perforasyon, kötü diferansiye histoloji veya yetersiz lenf nodu örneklemesi, gibi) için düĢünülmelidir ve hastanın klinik ve patolojik özellikleri son derece önemlidir. Kolorektal kanserin tedavisinde patolojik tümör evrelemesi anahtar rol oynar. Buna karĢın belirgin ölçüde evre bağımsız olan ve moleküler heterojeniteyi yansıtan çeĢitlilik gözlenmiĢtir. Bu durum da yeni prognostik ve prediktif belirteçlere ihtiyaç olduğunu göstermektedir. KRK‘lerin çoğunluğu kromozomal insitabilite göstermesine rağmen yaklaĢık %15‘i defektif mismatch repair (MMR) genine sahiptir. Defektif MMR (dMMR) ya mikrosatellit insitabilitesiyle ya da DNA MMR genindeki protein ürünlerinin kaybıyla (MLH1, MSH2, MSH6, PMS2) ölçülmektedir. dMMR geni olan KRK‘ler proksimal kolon predominansı, zayıf farklılaĢma, müsinöz histoloji, intra ve peritümöral lenfatik infiltrasyon, diploid DNA‘yı içeren ayırıcı özellikleri taĢır. Yüksek dereceli MSI ( MSI-H) ve MLH1,MSH2 proteinlerinin ekspresyon kaybı yüksek oranda birliktelik gösteriri. MLH1 ve MSH2, MSI ile benzer prognostik değer içerir. (137,138) 5-FU bazlı adjuvan tedavi verilen ve sadece cerrahi tedavi yapılan kolorektal kanserli hastaların karĢılaĢtırıldığı randomize klinik çalıĢmalardan elde edilen bilgilerle, MMR geninin prediktif rolü olduğu gösterilmiĢtir. Bu çalıĢmalarda tedaviden faydalanım MSI durumuyla değiĢmektedir ve 5-FU tedavisi alan MSI-H olan hastaların cerrahiye oranla daha az fayda gördüğü saptanmıĢtır (139,140). Bununla çeliĢen araĢtırmalar ise genellikle cerrahi ve 5FU tedavisi alanları kapsayan karĢılaĢtırmalı grupların randomize olarak seçilmediği, hasta gruplarında farklılıkların olduğu tarafsız olmayan araĢtırmalardır. Sargent ve ark. dMMR genine sahip kolorektal kanserli hastaların 5-FU‘den fayda görmediği hipotezini test eden uluslar arası çalıĢma yapmıĢlardır (141). 457 evre II ve III kolorektal kanserli hastalarda dMMR ve pMMR genleri belirlenmiĢ, 5-FU bazlı tedavi alan ve sadece cerrahi tedavi yapılan hastalar karĢılaĢtırılmıĢtır. Tek çeĢitli analizde sadece cerrahi ile tedavi edilen hastalarda dMMR geni varlığının hastalıksız sağkalım ve genel sağkalıma etkisinin olduğu görülmüĢ ancak çok çeĢitli analizde istatistiksel olarak anlamlı bulunmamıĢtır. MMR durumu ve 5-FU ile tedavi edilen hastaların sonuçları arasında bağlantı gözlenmemiĢtir.(p = 0,7) Yine dMMR geni olan hastalar için 5-FU ile tedavinin 81 hastalıksız sağkalım üzerine faydası olmadığı saptanmıĢtır (p = 0.5). Ancak pMMR tümörlü hastalarda tedavi faydalı bulunmuĢtur.p = 0,002). Evre III hastalığı olan ve pMMR tümörlü hastalarda tedavinin hastalıksız sağkalıma etkisi olduğu gözlenirken evre II hastalığı olan ve pMMR tümörlü hastalarda tedavinin hastalıksız sağkalıma etkisinin olmadığı saptanmıĢtır. Yeni bilgilere göre MMR durumu özellikle sporadik evre kolon kanserli ve flouroprimidin bazlı kemoterapi düĢünülen hastalarda klinik açıdan yararlı bir belirteçtir. US Intergroup E5202 çalıĢmasında 5-FU ile tedavinin dMMR tümörlü hastalarda faydasının az olması nedeniyle bu hastaların FU bazlı adjuvan kemoterapi almaması gerektiği belirtilmektedir (141). Gözlem önerilmesi hastaları tedavi nedenli toksisitelerden, masraftan, kemoterapi boyunca düĢük hayat kalitesinden kurtarmaktadır. Kromozomal insitabilite ile iliĢkili diğer marker adayları 18q ve 17p delesyonudur. 18q kaybı kolon kanserinde oldukça sık görülmektedir ancak prognotik değeri çeliĢkilidir. Kromozomal 18q allelik kaybı olmayan evre II hastaların klinik gidiĢatı mükemmel olup 5 yıllık hastalıksız sağkalım oranları %96‘dır. (Allelik kaybı olanlarda %54‘tür.) (94). Ancak bu gözlem baĢka bir çalıĢma ile konfirme edilmemiĢtir. (94) 18q‘nun prediktif rolü adjuvan kemoterapi alan hastalarda değerlendirilmiĢtir. MSI-S evre 3 tümörü olan ve 5-FU bazlı kemoterapi ile tedavi edilen hastalarda 5 yıllık sağkalım süresi kr.18q‘da allel kaybı olmayan hastalarda kayıp olan hastalara göre belirgin olarak yüksektir.(%74 v.%50, p = 0.006) (142). Sonuç olarak, adjuvan tedavinin evre II kolon kanserindeki rolü, rutin kullanımı ile ilgili yeterli veri olmaması nedeniyle halen netlik kazanmamıĢtır. Ancak evre II hastaların adjuvan tedaviden fayda göreceği ve adjuvan tedavi kararı verilirken klinik ve patolojik risk faktörlerinin göz önünde bulundurulması gerektiği artan oranlarda kabul görmektedir. Ülkemizde retrospektifde olsa bir çalıĢma yapılmamıĢtır. Bizim çalıĢmamız obstrüksiyon, lenfovasküler invazyon, kötü veye orta derecede diferansiye tümör, perforasyon, 7 veya 12‘den daha az lenf nodu rezeksiyonu yapılması evre II kolon kanserli hastalarda rekürrens oranının arttığını göstermiĢtir. Yine özellikle T4 tümör varlığında evre II kolon kanserli hastalarda nüksün daha sık olduğunu doğrulamaktadır. Evre II kolon kanserli hastalarda kemoterapi avantajlı gibi gözüksede % 25 hastada nüks saptanmıĢtır. Literatürle benzer Ģekilde çalıĢmamız sonucunda evre II kolon kanserli hastalarda kemoterapinin sağkalım ve rekürrens üzerine etkisi olmadığı kanıtlanmıĢtır. 82 ASCO ve NCCN tarafından düzenlenen panelde (64) tedavi ve kontrol grupları arasında % 90 kuvvet ve anlamlılık düzeyi 0,05 olmak üzere sağkalım oranları arasında % 2 fark saptamak için 9680 hastalık bir örnek grubu gerektiğini belirlemiĢtir. Bu çalıĢmanın retrospektif özellikte olması ve kısıtlı hasta sayısı daha ileri sonuçlara varmamızı engellemektedir. Eldeki mevcut verilere dayanarak yüksek riskli evre II kolon kanserinde adjuvan kemoterapinin etkinliği sadece speküle edilebilir ve 5-FU/FA bazlı rejimler yeterli bir opsiyon olabilir. BaĢta duyusal nöropati olmak üzere toksisite, maliyet ve sağkalım sürelerinde artıĢ olmaması MOSĠAC çalıĢmasında oxaliplatin ile kombinasyonu desteklememektedir. DüĢük riskli evre II kolon kanserli hastalar için tedaviden edinilen az miktardaki fayda kemoterapiye bağlı ağır toksisite ve ölüm riski ile dengelenmektedir. Bu nedenle evre II kolon kanserli hastaların tedavi alıp almamasına bireysel özellikler değerlendirilerek karar verilmeli, yüksek riskli hastalarda oxaliplatin veya irinotekan bazlı kemoterapi rejimlerinin etkinliği prospektif çalıĢmalarla değerlendirilmelidir. Genetik ve moleküler markerların belirlenmesi ileri dönemde adjuvan yaklaĢımlardan fayda görecek hastaların belirlenmesinde yardımcı olabilir. 83 7. KAYNAKLAR 1. Jemal A, Siegel R, Ward E, Murray T, Smigal C, Thun MJ, et.al.Cancer statistic,2007. CA Cancer J Clin 2007;57:43-66. 2. O‘Connell JB, Maggard MA, Ko CY. Colon cancer survival rates with the new AJCC sixth edition staging. J Natl Cancer Inst 2004;96: 1420-4. 3. Grene F, Page D, Fleming I, Fritz A. AJCC Cancer Staging Manual. New York: Springer-Verlag; 2002. 4. Compton CC, Grene FL. The staging of colorectal cancer: 2004 and beyond.CA Cancer J Clin. 2004;54:295-308. 5. Sobin LH, Grene FL. TNM classification. Clarification of number of regional lymph nodes for pN0. Cancer.2001;92:452. 6. Nauta R,Stablein DM, Holyoke ED.Survival of patients with stage B2 colon carcinoma. The Gastrointestinal Tumor Study Group experience. Arch Surg 1989;124:180-182. 7. Engstrom PF, Benson AB 3 rd, Saltz L, Colon Cancer Clinical Practice Guidelines in Oncology. JNCCN 2003;1:40-153 8. De Dosso S,Sessa C, Saletti P. Adjuvant therapy for colon cancer: present and perspectives. Cancer Treat Rev. 2009; 35: 160-166. 9. Carrato A. Adjuvant treatment of colorectal cancer. Gastrointest Cancer Res. 2008; 2(4 Suppl): S 42-46. 10. Figueredo A, Coombes ME, Mukherjee S. Adjuvant therapy for completely resected stage II colon cancer. Cochrane Database Syst Rev. 2008; (3):CD005390. 11. Parkin DM, Pisani P, Ferlay J. Global cancer statistics. CA Cancer J Clin 1999; 49: 33-64 12. Landis SH, Murray T, Bolden S, Wingo PA. Cancer statstics. CA Cancer J Clin. 1998; 48: 6- 29 13. Potter, J.D. Food and Cancer Prevention II: summary of the meeting. Cancer Lett 1997;114: 337-8. 14. Thun MJ, Namboodiri MM, . Heath JW. Aspirin use and reduced risk of fatal colon cancer. N Engl J Med, 1991. 325: 1593-1596. 15. Winawer, S.J. et al., Prevention of colorectal cancer by colonoscopic polypectomy. The National Polyp Study Workgroup. N Engl J Med, 1993. 329: 1977-1981. 84 16. Buğra D. Kolon Anatomisi. Alemdaroğlu K, Akçal T, Buğra D (Editörler). Kolon Rektum ve Anal Bölge Hastalıkları Ġstanbul: Türk Kolon ve Rektum Cerrahi Derneği; 2003.s.21-30. 17. Pedro LP, Efrain BC, Isabel A, Antonıo M et al: Prognostic significance of circumferential margin involvement in Rectal Adenocarsinoma Treated With preoperative Chemoradiotherapy and Low Anterior Resection. Journal of Surgical Oncology2005;90: 20-25 18. Crawford JM, Kumar V:Robbins Temel Patoloji. In ÇevikbaĢ U. Ağız BoĢluğu Gastrointestinal Sistem. 7. ed, Ġstanbul: Nobel Tıp Kitabevi,2003: 563-590. 19. KuĢakçıoğlu Ö. Kolorektal Kanser Hastalıkları. Ġstanbul: Nobel Tıp Kitabevleri, 2003:1- 27. 20. Gönen Ö. Kolorektal Kanser Epidemiyolojisi, Kolorektal Özel Sayısı. Türkiye Klinikleri Journal of Surgery 2004;9: 57-65 21. Bozfakıoğlu Y, Müslümanoğlu M: Cerrahi Gastroenteroloji. Edit. :Değerli Ü, Bozfakıoğlu Y. Kolon Hastalıkları. 4. baskı, Ġstanbul: Nobel tıp Kitabevi, 1997:142168. 22. Kodner IJ, Fry RD, Fleshman JW, Birnbaum EH, Read TE. Principles of Surgery (Cerrahinin Ġlkeleri). Türkçe çeviri editörü; Geçim Ġ.Ethem. 7th ed. Antıp. 2004:1283-1394. 23. Cooper HS: Sternberg‘s Diagnostic Surgical Pathology. In: Mills SE. Intestinal Neoplasms. Vol 2, 4 th ed: Lippincott Williams &Wilkins, 2004: 1543- 1601. 24. Hawk ET, Limburg PJ, Viner JL. Epidemiology and prevention of colorectal cancer. Surg Clin North Am, 2002; 82: 905-941. 25. Chao A, et al., Cigarette smoking and colorectal cancer mortality in the cancer prevention study II. J Natl Cancer Inst, 2000. 92: 1888- 1896. 26. J. Ackerman‘s Surgical Pathology. In Rosai J. Gastrointestinal Tract, Large Bowel. 9th ed, Mosby Company; China, 2004:776- 823. 27. Dahl J, Greenson JK. Histology for Pathologist. In: Mills S.E. Colon. 3th ed. Lippincott Williams & Wilkins; Philadelphia, 2007:627- 643. 28. Potter JD, Slattery ML, Bostick RM, et al. Colon cancer: A review of the epidemiology. Epidemiol Rev 1993;15: 499. 29. Ekbom A,et al. Ulcerative colitis and colorectal cancer. A population-based study. N Engl J Med 1990. 323: 1228-33. 85 30. Lynch HT, et al. Genetics, natural history, tumor spectrum, and pathology of hereditary nonpolyposis colorectal cancer: an updated review. Gastroenterology 1993; 104: 1535-1549. 31. Lynch,HT, Smyrk TC. Identifying hereditary nonpolyposis colorectal cancer. N Engl J Med, 1998. 338: 1537- 1538. 32. Stewart M, Macrae FA, Williams CB. Neoplasia and ureterosigmoidostomy: a colonoscopy survey. Br J Surg, 1982. 69: 414-416. 33. Sandler RS, Sandler DP. Radiation-induced cancers of the colon and rectum: assessing the risk. Gastroenterology 1983; 84: 51-57. 34. BetesM, et al. Use of colonoscopy as a primary screening test for colorectal cancer in average risk people. Am J Gastroenterol 2003. 98: 2648-2654. 35. Klein RS. et al., Streptococcus bovis septicemia and carcinoma of the colon.Ann Intern Med, 1979; 91: 560-562. 36. Jenkins PJ, et al. Acromegaly, colonic polyps and carcinoma. Clin Endocrinol (Oxf) 1997; 47: 17-22. 37. Hu FB, et al. Prospective study of adult onset diabetes mellitus (type 2) and risk of colorectal cancer in women. J Natl Cancer Inst 1999; 91: 542-547. 38. Koenuma M, Yamori T, Tsuruo T. Insulin and insulin-like growth factor 1stimulate proliferation of metastatic variants of colon carcinoma 26. Jpn J Cancer Res 1989; 80: 51-58. 39. Heath CW Jr, et al. Nonsteroidal antiinflammatory drugs and human cancer. Report of an interdisciplinary research workshop. Cancer, 1994. 74: 2885-2888. 40. Abraham J, Allegra CJ, GulleyJ . Bethesda Klinik Onkoloji Kitabı Nobel Tıp Kitabevleri Ltd.ġti. 2009 41. SR, Aaltonen LA (eds). Tumours of the colon and rectum. In: Pathology and Genetics of Tumours of the Digestive System-World Healty Organization of Classification of Tumours. Lyon: IARC Press, 2000:104- 19. 42. Chandrosoma P (ed). Colorectal malignant neoplasms. In: Gastrointestinal Pathology. Appletion-Large, Stamferd, 1999: 339-359. 43. Bacon, H.E. and S.W. Eisenberg, Papillary adenoma or villous tumor of the rectum and colon. Ann Surg, 1971; 174: 1002-1008. 44. Küpelioğlu AA. Kolorektal Kanserde Histopatoloji, Kolorektal Özel Sayısı. Türkiye Klinikleri Journal of Surgery 2004; 9: 25- 7. 86 45. Kumar V, Robbins S, Cotran R (Çeviri: U. ÇevikbaĢ ). Temel Patoloji. Ġstanbul: Nobel Tıp Kitabevleri; 2000:505-514. 46. Gönen Ömür. Kolon ve ince barsak tümörleri. Temel Ġç Hastalıkları 1999; 1: 102333. 47. Özbal AN, Karahasanoğlu T. Kolon Kanserinde Klinik. Alemdaroğlu K, Akçal T, Buğra D (Editörler). Kolon Rektum ve Anal Bölge Hastalıkları. Ġstanbul: Türk Kolon ve Rektum Cerrahi Derneği; 2003.s.421- 5. 48. Rosai J. Rosai and Ackerman‘s Surgical Pathology. In: Rosai J. Gastrointestinal Tract, Large Bowel. Mosby, 2004:1(9):776- 855. 49. Redston M. Surgical Pathology of the GI tract, Liver, Biliary tract, and Pancreas. 1 st ed: Saunders, 2004;1: 441- 472. 50. Mandel JS, et al. Reducing mortality from colorectal cancer by screening for fecal occult blood. Minnesota Colon Cancer Control Study. N Engl J Med 1993. 328: 1365-71. 51. Imperiale, T.F., et al., Risk of advanced proximal neoplasms in asymptomatic adults according to the distal colorectal findings. N Engl J Med, 2000. 343: 169- 74. 52. Citarda F, et al., Efficacy in standard clinical practice of colonoscopic polypectomy in reducing colorectal cancer incidence. Gut 2001; 48: 812-5. 53. Rex DK, et al., Relative sensitivity of colonoscopy and barium enema for detection of colorectal cancer in clinical practice. Gastroenterology 1997; 112: 17- 23. 54. Yee J, et al., Colorectal neoplasia: performance characteristics of CT colonography for detection in 300 patients. Radiology 2001; 219: 685-92. 55. Powell SM, et al., Molecular diagnosis of familial adenomatous polyposis. N Engl J Med, 1993; 329: 1982- . 56. Dong, S.M., et al., Detecting colorectal cancer in stool with the use of multiple genetic 57. targets. J Natl Cancer Inst, 2001;93: 858- 65. Bond, J.H., Polyp guideline: diagnosis, treatment, and surveillance for patients with nonfamilial colorectal polyps. The Practice Parameters Committee of the American College of Gastroenterology. Ann Intern Med 1993; 119: 836- 43. 58. Rosai J:Rosai and Ackerman‘s Surgical Pathology. In: Rosai J. Gastrointestinal Tract, Large Bowel. Vol 1. 9 th ed: Mosby, 2004: 776-855. 59. Harpaz N, Saxena R: Modern Surgical Pathology. In: Weidner N, Cote RJ, Suster S, Weiss LM. Gastrointestinal Tract, Large Intestine. Vol 1, 1 st ed: Saunders, 2003: 749-852. 87 60. O‘Connell J, Bennett MW, O‘Sullıvan GC, Roche D, Kelly J, Collins JK Shanahan F. Fas ligand expression in primary colon adenocarcinomas: Evidence that the Fas counterattack is prevalent mechanism of immune Evasion in human colon cancer. J Pathol 1998;186: 240-246. 61. Garrity MM, Burgart LJ, Mahoney MR, Windschitl HE, Salim M, Wiesenfeld M, Krook JE et al. Prognostic value of proliferation, Apoptosis, defective DNA mismatch repair, and p53 overexpression In patients with resected Dukes‘B2 or colon cancer: A north central Cancer treatment group study. J Clin Oncol 2004; 22: 15721582. 62. Compton CC, Fielding LP, Burgart LJ, et al. Prognostic factors in colorectal cancer. College of American Pathologists Consensus Statement 1999. Arch Pathol Lab Med 2000; 124: 979. 63. Adjuvant chemotherapy for stage II colon cancer.(AREAS OF CONFUSION IN ONCOLOGY)(Clinical report) Kopetz, Scott, et al. "Adjuvant chemotherapy for stage II colon cancer." Oncology 22. 3 (2008): 260. Health Reference Center Academic. Web. 25 Nov. 2009. 64. Reviews ın basic and clinical gastroenterology Systemic Treatment of Colorectal Cancer Brıan M. WOLPIN and Robert J. MAYER 2008 65. Libutti SK, Saltz LB, Rustgi AK, Teper JE. Cancer of Colon. Ġn: DeVita VT, Hellman S, Rosenberg SA (eds). Principles and Practice of Oncology. 7th ed. Philadelphia: Lippincott Williams & Wilkins, 2005:1060- 1109. 66. Messerini L, Palomba A, Zampi G. Primary signet-ring cell carsinoma of the colon and rectum. Dis Colon Rectum 1995;38: 1189. 67. de Bruine AP, Wiggers T, Beek C, et al. Endocrine cells in colorectal adenocarcinomas: incidence, hormone profile and prognostic relevance. Int J Cancer 1993;54: 765. 68. Jessurun J, Romero-Guadarrama M, Manivel JC. Medullary adenocarcinoma of the colon: clinicopathologic study of 11 cases. Hum Pathol 1999;30: 843. 69. Boland CR, Thibodeau SN, Hamilton SR, et al. National Cancer Institute Workshop on Microsatellite Instability for cancer detection and familial predisposition: development of international criteria fort he determination of microsatellite instability in colorectal cancer. Cancer Res 1998;58: 5248. 70. Watanabe T, Wu TT, Catalano PJ, et al. Molecular predictors of survival after adjuvant chemotherapy for colon cancer. N Engl J Med 2001;344: 1196. 88 71. Lanza G, Matteuzzi M, Gafa R, et al. Chromosome 18q allelic loss and prognosisi in stage II and III colon cancer. Int Cancer 1998;79: 390. 72. Lıbuttı SK, Saltz LB, Rustgı AK, Tepper JE. Cancer of the colon. ―Cancer Principles and Practice of Oncology‖ (Ed. Vincent T. De Vita, Jr. Samuel Hellman, Steven A. Rosenberg)‘de, 7th edition, Section 8, Lippicott Williams&Wilkins, Philadelphia, 2005, s.1061- 1125. 73. Topuz E, Aykan FN. Kolorektal Kanserler. ―Sindirim Sistemi Kanserleri‖(Ed. Topuz, E)‘nde,Ġstanbul Üniversitesi Onkoloji Enstitüsü Yayınları, Ġstanbul, 1998, s.373- 475 74. Brucner HW, Pitrelli J, Merrick M . Adenocarcinoma of the Colon and Rectum. ―Cancer Medicine‖ (Ed. Holland JF, Frei E)‘da , 5th Edition, 2001, s. 1472-1520. 75. Kuzu MA, Demirkıran A. Kolon Kanserinin Küratif Cerrahi Tedavisi. Alemdaroğlu K, Akçal T, Buğra D (Editörler). Kolon Rektum ve Anal Bölge Hastalıkları. Ġstanbul:Türk Kolon ve Rektum Cerrahi Derneği; 2003.s.427- 50. 76. Terzi C, Ünek T. Kolon Kanserinde Cerrahi Tedavi. Kolorektal Özel Sayısı. Türkiye Klinikleri Journal of Surgery 2004; 9: 71-80. 77. Minsky BD, Mies C, Recht A ve arkadasları. Resectable adenocarcinoma of the rectosigmoid and rectum. Patterns of the failure and survival. Cancer 1988; 61:14081416. 78. Hyams DM, Mamounas EP, Petrelli N ve arkadasları. A clinical trial to evaluate the worth of preoperative multimodality therapy in patients with operable carcinoma of the rectum. A progress report of the National Surgical Adjuvant breast and Bowel Project protocol RO- 3. Dis Colon Rectum 1997;40:131. 79. Swedish Rectal Cancer Trial. Improved survival with preoperative radiotherapy in resectable 80. rectal cancer. N Engl J Med 1997;336:980- 987. Sayek Ġ. Kolorektal karsinomalar. ― Temel cerrahi‖ Cilt 1 (Ed. Sayek Ġ.)‘de, 2. Baskı, Günes Kitabevi, Ankara, 1996, s. 1169- 1179. 81. Frykholm GJ, Glimelius B, Pahlman L. Preoperative or postoperative irradiation in adenocarcinoma of the rectum: final treatment results of a randomized trial and an evaluation of late secondary effects. Dis Colon Rectum 1993;36: 564. 82. O‘Connell M, Martenson JA, Wieand H ve arkadasları. Improving adjuvant therapy for rectal cancer by combining protracted-infusion fluorouracil with radiation therapy after curative surgery. N Eng J Med 1995;331:502- 507. 83. National Comprehensive Cancer Network (NCCN) Clinical Practice Guidelines in Oncology. Colon Cancer V.2. 2007. Rectal Cancer V.1. 2007. 89 84. Aydıner A, Topuz E. ―Onkoloji El Kitabı‖, Turgut Yayıncılık, Ġstanbul, Kasım 2006, s: 217- 234. 85. Fuchs CS, Marshall J, Mitchell E, et al. Randomized, controlled trial of irinotecan plus ınfusional, bolus, or oral fluoropyrimidines in first-line treatment of metastatic colorectal cancer: results from the BICC-C study. J Clin Oncol 2007; 25: 4779-4786. 86. Saltz LB, Niedzwiecki D, Hollis D, et al. Irinotecan fluorouracil plus leucovorin is not superior to fluorouracil plus leucovorin alone as adjuvant treatment for stage III coloncancer: results of CALG 89803. J Clin Oncol 2007; 25: 3456-3461. 87. Giacchetti S, Perpoint B, Zidani R, et al. Phase III multicenter randomized trial of oxaliplatin added to chronomodulated fluorouracil- leucovorin as first-line treatment of metastatic colorectal cancer. J Clin Oncol 2000;18: 136-147. 88. Goldberg RM, Sargent DJ, Morton RF, et al. A randomized controlled trial of fluorouracil plus leucovorin, irinotecan, and oxaliplatin combinations in patients with previously untreated metastatic colorectal cancer. J Clin Oncol 2004; 22: 23-30. 89. Tournigand C, Andre T, Achille E, et al. FOLFIRI followed by FOLFOX6 or the reverse sequence in advanced colorectal cancer: a randomized GERCOR study. J Clin Oncol 2004; 22: 229-237. 90. Colucci G, Gebbia V, Paoletti G, et al. Phase III randomized trial of FOLFIRI versus FOLFOX4 in the treatment of advanced colorectal cancer: a multicenter study of the Gruppo Oncologico Dell‘Italia Meridionale. J Clin Oncol 2005;23: 4866-4875. 91. Mayer A, Takimoto M, Fritz E, et al. The prognostic significance of proliferating cell nuclear antigen, epidermal growth factor receptor, and mdr gene expression in colorectal cancer. Cancer 1993;71: 2454–2460. 92. Messersmith WA, Hidalgo M. Panitumumab, a monoclonal anti epidermal growth factor receptor antibody in colorectal cancer: another one or the one? Clin Cancer Res 2007; 13: 4664-4666. 93. Van Cutsem E, Nowacki M, Lang I, et al. Randomized phase III study of irinotecan and 5-FU/LV with or without cetuximab in the first line treatment of patients with metastatic colorectal cancer (Abstract). J Clin Oncol 2007;25:164s. 94. De Dosso S, Sessa C, Saletti P. Adjuvant therapy for colon cancer: Present and perspectives. Cancer Treatment Reviews 2009; 35: 160-166 95. Engstrom PF, Benson AB 3rd, Chen YJ, et al. National Comprehensive Cancer Network: Colon cancer clinical practice guidelines in oncology. J Natl Compr Canc Netw 2005; 3:468-491. 90 96. Benson AB III, Schrag D, Somerfield MR, et al. American Society of Clinical Oncology recommendations on adjuvant chemotherapy for stage II colon cancer. J Clin Oncol 2004; 22: 3408- 3419. 97. Hickish T, Boni C, Navarro M, et al. FOLFOX4 as adjuvant treatment for stage II colon cancer: Subpopulation data from the MOSAIC trial (Abstract 3619). Proc Am Soc Clin Oncol 2004; 23: 275. 98. Morris EJ, Maughan NJ, Forman D, et al. Who to treat with adjuvant therapy in Dukes B/stage II colorectal cancer? The need for high quality pathology. Gut 2007; 56: 1419-1425. 99. Smith RE, Colangelo L, Wieand HS, et al: Randomized trial of adjuvant therapy in colon carcinoma: 10-year results of NSABP protocol C-01. J Natl Cancer Inst 96:1128-1132, 2004. 100. Wolmark N, Rockette H, Fisher B, et al. The benefit of leucovorin-modulated fluorouracil as postoperative adjuvant therapy for primary colon cancer: Results from National Surgical Adjuvant Breast and Bowel Project protocol C- 03. J Clin Oncol 1993; 11: 1879-1887. 101. Moertel CG, Fleming TR, Macdonald JS, et al. Intergroup study of fluorouracil plus levamisole as adjuvant therapy for stage II/Dukes' B2 colon cancer. J Clin Oncol 1995; 13: 2936-2943. 102. Moertel CG, Fleming TR, Macdonald JS, et al: Levamisole and fluorouracil for adjuvant therapy of resected colon carcinoma. N Engl J Med 1990; 322: 352-358. 103. Haller DG, Catalano P, Macdonald JS: Phase III study of fluorouracil, leucovorin, and levamisole in high-risk stage II and III colon cancer: Final report of Intergroup 0089. J Clin Oncol 2005; 23: 8671-8678. 104. Gray R, Barnwell J, Hills R. QUASAR: A randomized study of adjuvant chemotherapy vs observation including 3238 colorectal cancer patients (Abstract 3501). Proc Am Soc Clin Oncol 2004; 23: 246. 105. Midgley R, Kerr DJ. Adjuvant chemotherapy for stage II colorectal cancer: The time is right! Nat Clin Pract Oncol 2005; 2: 364-369. 106. de Gramont A, Boni C, Navarro M, et al. Oxaliplatin/5FU/LV in adjuvant colon cancer: Updated efficacy results of the MOSAIC trial, including survival, with a median follow-up of six years (Abstract 4007). J Clin Oncol 2007; 25(18S): 165s. 91 107. Kuebler JP, Wieand HS, O'Connell MJ, et al. Oxaliplatin combined with weekly bolus fluorouracil and leucovorin as surgical adjuvant chemotherapy for stage II and III colon cancer: Results from NSABP C-07. J Clin Oncol 2007; 25: 2198-2204. 108. International Multicentre Pooled Analysis of B2 Colon Cancer Trials (IMPACT B2) Investigators: Efficacy of adjuvant fluorouracil and folinic acid in B2 colon cancer. J Clin Oncol 1999; 17: 1356-1363. 109. Chau I, Norman AR, Cunningham D, et al. Longitudinal quality of life and quality adjusted survival in a randomised controlled trial comparing six months of bolus fluorouracil/leucovorin vs. twelve weeks of protracted venous infusion fluorouracil as adjuvant chemotherapy for colorectal cancer. Eur J Cancer 2005; 41: 1551-1559. 110. Land SR, Kopec JA, Cecchini RS, et al. Neurotoxicity from oxaliplatin combined with weekly bolus fluorouracil and leucovorin as surgical adjuvant chemotherapy for stage II and III colon cancer: NSABP C-07. J Clin Oncol 2007; 25:2205-2211. 111. Sökmen S. Kolorektal Kanserde Prognoz, Kolorektal Özel Sayısı. Türkiye Klinikleri Journal of Surgery 2004; 9: 57-65. 112. Alici S, Aykan NF, Sakar B, et al. Colorectal cancer in young patients: characteristics and outcome. Tohoku J Exp Med 2003; 199:8 5-93. 113. Fietkau R, Zettl H Klöcking S, Kundt G. Incidence, therapy and prognosis of colorectal cancer in different age groups. A popülation-based cohort study of the Rostock Cancer Registry. Strahlenter Onkol 2004; 180: 478-487. 114. Quah MH, Chou JF, Gönen M, Jinru Shia. Identification of Patients with High Risk Stage II Colon Cancer for Adjuvant Therapy. Dis Colon Rectum 2008; 51: 503-507. 115. Han-Shiang C. Curative resection of colorectal adenocarcinoma: multivariate analysis of 5-year follow-up. World J Surg 1999; 23: 1301-1306. 116. Asaad SM, Jubelirer SJ, Welch CA. Prognostic indicators for stage II (Dukes‘ stage B) adenocarcinoma of the colon. W V Med J 2005; 101: 210-213. 117. Nelson RL, Dollear T, Freels S, Persky V. The relation of age, race, and gender to the subsite location of colorectal carcinoma. Cancer 1998; 82: 1408-1410. 118. Sarfati D, Hill S, Blakely T, Robson B. The Effect of Comorbidity on the Use of Adjuvant Chemotherapy and Survival from Colon Cancer: A Retrospective Chort Study. BMC Cancer 2009; 9: 116 119. Burton S, Norman AR, Brown G, et al. Predictive poor prognostic factors in colonic carcinoma. Surg Oncol 2006; 5: 71- 8 92 120. Enker WE, Havenga K, Polyak T, et al Abdomino perineal resection via total mesorectal excision and autonomic nerve preservation for low rectal cancer. World J Surg 1997; 21: 215-220. 121. Cohen AM, Tremittera S, Candela F, Thaler JT, Sigurson ER. Prognosis of node – positive colon cancer. Cancer 1991; 67: 1859-1861. 122. Gill S, Loprinzi CL, Sargent DJ, et al. Pooled analysis of fluoroyracil-based adjuvant therapy for stage II and III colon cancer: who benefits and by how much? J Clin Oncol 2004; 22:1773-1775. 123. Petersen VC, Baxter KJ, Love SB, Shepherd NA. Identification of objective pathological prognosis determinants and models of prognosis in Dukes‘ B colon cancer. Gut 2002; 51: 6-7. 124. MenteĢ B, Leventoğlu S. Kolorektal Kanserlerin Klinik Özellikleri, Kolorektal Özel Sayısı. Türkiye Klinikleri Journal of Surgery 2004;9: 36-8. 125. Doğusoy G. Kolon Kanserinin Patolojik Özellikleri. Alemdaroğlu K, Akçal T, Buğra D (Editörler). Kolon Rektum ve Anal Bölge Hastalıkları. Ġstanbul: Türk Kolon ve Rektum Cerrahi Derneği; 2003.s.413-20. 126. Rault A, Collet D, Sa Cunha A, et al. Surgical management of obstructed colonic cancer. Ann Chirr 2005; 130: 331-335. 127. Mekele J, Kiviniemi H, Laitinen S. Prognostic factors after surgery in patient younger than 50 years old with colorectal adenocarcinoma. Hepatogastroenterology 2002; 49: 971-975. 128. Bui L, Rempel E, Reeson D, Simunovic M. Lymph node counts, rates of positive lymph nodes, and patient survival for colon cancer surgery in Ontario, Canada: a population-based study. J Surg Oncol 2006; 93: 439-445. 129. Park YJ, Park KJ, Park JG, et al. Prognostic factors in 2230 Korean colorectal cancer patients: analysis of consecutively operated cases. World J Surg 1999; 23: 721-726. 130. American Cancer Society: Cancer Facts and Figures 2007. Atlanta, GA: American Cancer Society, 2007. Also available online. Last accessed December 20, 2007. 131. Prandi M, Lionetto R, Bini A, et al. Prognostic evalution of stage B colon cancer patients is improved by an adequate lymphadenectomy: results of secondary analysis of a large scale adjuvant trial. Ann Surg 2002; 235: 458-463. 132. Campton CC. Colorectal carcinoma: diagnostic, prognostic, and molecular features. Mod Pathol 2003; 16: 376-388. 93 133. Benson AB, Schrag D, Somerfield MR, et al. American Society of Clinical Oncology reccommendations on adjuvant chemotherapy for stage II colon cancer. J Clin Oncol 2004; 22: 3408-3419 134. Mamounas E, Wieand S, Wolmark N, et al. Comparative efficacy of adjuvant chemotherapy in patients with Dukes‘ B versus Dukes‘ C colon cancer: results from four National Surgical Adjuvant Breast and Bowel Project adjuvant studies( C01, C02, C03 and C04). J Clin Oncol 1999; 17: 1349-1355 135. Erlichman. Efficacy of adjuvant flourouracil and folinic acid in B2 colon cancer. International multicenter pooled analysis of B2 colon cancer trials(IMPACT B2) investigators. J Clin Oncol 1999; 17: 1356-1363. 136. Schrag D, Rifas-Shiman S, Saltz L, et al. Adjuvant chemotherapy use for medicare beneficiaries with stage II colon cancer. J Clin Oncol 2002; 20: 3999-4005. 137. Rodríguez-Moranta F, Castells A, Andreu M, et al: Clinical performance of original and revised Bethesda guidelines for the identification of MSH2/ MLH1 gene carriers in patients with newly diagnosed colorectal cancer: Proposal of a new and simpler set of recommendations. Am J Gastroenterol 101:1104-1111, 2006 138. Lindor NM, Burgart LJ, Leontovich O, et al. Immunohistochemistry versus microsatellite instability testing in phenotyping colorectal tumors. J Clin Oncol 2002; 20: 1043-1048. 139. Ribic CM, Sargent DJ, Moore MJ, et al: Tumor microsatellite-instability status as a predictor of benefit from fluorouracil-based adjuvant chemotherapy for colon cancer. N Engl J Med 2003; 349: 247-257. 140. Kim GP, Colangelo LH, Wieand HS, et al. Prognostic and predictive roles of highdegree microsatellite instability in colon cancer: A National Cancer Institute-National Surgical Adjuvant Breast and Bowel Project Collaborative Study. J Clin Oncol 2007; 25: 767-772. 141. Sargent DJ, Marsoni S, Monges G, et al. Defective Mismatch Repair As a Predictive Marker for Lack of Efficacy of Fluorouracil-Based Adjuvant Therapy in Colon Cancer. J Clin Oncol 2010; 28: 3219-3226. 142. Ogunbiyi OA, Goodfellow PJ, Herfarth K, et al. Confirmation that chromosome 18q allelic loss in colon cancer is a prognostic indicator. J Clin Oncol 1998;16: 427-433. 94