GİRİŞ
Rekombinant DNA teknolojisi ve modern
sentetik kimyanın gelişmesiyle klinik gelişme
sürecindeki ilaçların önemli bir bölümünü peptit
ve proteinler kapsamaktadır. Ancak bu
makromoleküllerin
stabil
olmayışları,
bu
moleküllerin stabil ve etkin formülasyon ve
taşıyıcı sistemlerini geliştirmekle sorumlu bilim
adamları için zorluklar yaratmaktadır.
Peptitler
Peptitler Amino Asit Zincirleridir
Peptitler
• Az sayıda amino asidin bağlanmasıyla oluşan yapıya
oligopeptit,
• çok sayıda amino asidin bağlanmasıyla oluşan yapıya da
polipeptit adı verilir.
• Proteinler ise binlerce amino asit kalıntısı içerebilir.
• Çoğu zaman ‘protein’ ve ‘polipeptit’ terimleri birbirinin
yerine kullanılmakla birlikte polipeptitler genel olarak
moleküler ağırlığı 10,000 Dalton un altında olanlardır.
Peptitler
Bir peptitte serbest α-amino grubunu içeren amino asit
kalıntısı amino-terminal (veya N-terminal) kalıntı, diğer
uçtaki serbest karboksil grubu içeren kalıntı ise
karboksil-terminal (veya C-terminal) kalıntıdır.
Peptitler
Çok sayıda hormon küçük peptitlerdir.
Oksitosin (dokuz amino asit kalıntısı içerir): Arka hipofizden salınan
ve uterus kasılmasını uyaran hormondur.
Bradikinin (dokuz amino asit kalıntısı içerir): Doku inflamasyonunu
inhibe eder.
Tirotropin salgılatıcı hormon (TRH) (üç amino asit kalıntısı):
Hipotalamusta oluşur ve bir başka hormon olan ön hipofiz bezindeki
tirotropinin salımını uyarır.
Amanitin: Oldukça toksik mantar zehiridir ve bazı antibiyotikler de
ufak peptitlerdir.
Aspartam: Yapay tatlandırıcı, dipeptit
L-aspartil-L-fenil alanin metil esteridir
PROTEİNLER
İnsülin: biri 30 diğeri 21 amino asit kalıntısı olan iki
polipeptit zincirinden oluşmuş pankreatik hormondur.
Glukagon: insüline zıt etki gösteren bir diğer pankreatik
hormon olup 29 amino asit kalıntısı içerir.
Kortikotropin: Ön hipofiz bezi hormonudur ve 39 kalıntı
içerir;
Sığır kimotripsinojeni: 245 amino asit kalıntısı içerir.
Titin: Omurgalı kasında bulunur, yaklaşık 27,000 amino
asit kalıntısı içeren 3,000,000 civarında molekül ağırlığına
sahip bir proteindir.
PROTEİNLER
PROTEİNLER
• Pek çok protein, örneğin ribonükleaz enzimi ve
kimotripsinojen, sadece amino asit kalıntıları içerir, diğer
kimyasal grupları yoktur ve basit proteinler olarak
adlandırılırlar.
• Bazı proteinler ise amino asitlere ek kalıcı bir kimyasal
kısım içerir ki, bunlara da konjuge (birleşik) proteinler
denir.
• Konjuge proteinin amino asit olmayan kısmına prostetik
grup denir. Konjuge proteinler prostetik grubun kimyasal
yapısı temel alınarak sınıflandırılırlar. Lipoproteinler lipit,
glikoproteinler şeker grupları, metalproteinler özgül bir
metal içerir.
PROTEİNLER
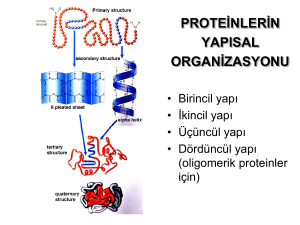
PROTEİN YAPISI
PEPTİT VE PROTEİN STABİLİTESİ
• Kimyasal bozulma:
Hidroliz, Deamidasyon, Oksidasyon,
Rasemizasyon, Izomerizasyon, β-Eliminasyon,
Disülfat oluşumu/değişimi
• Fiziksel bozulma:
Denatürasyon, Adsorpsiyon, Agregasyon,
Çökme
PEPTİT VE PROTEİN STABİLİTESİ
• Kimyasal bozulma, yeni bir kimyasal madde
oluşturarak birleşme (oksidasyon) veya kopma
(deamidasyon) yoluyla protein ve peptitlerin
yapısal değişikliklerinin oluştuğu süreci kapsar.
• Fiziksel
bozulma
ise
proteinin
kovalent
modifikasyonlarına etki etmez. Bunun yerine
genellikle daha yüksek düzenli (ikincil ve üstü)
yapılardaki değişiklikleri içerir. Fiziksel bozulma
yüzeydeki
adsorpsiyona,
agregasyona
ve
çökmeye neden olabilecek bir denatürasyon
sonucunda meydana gelir.
KİMYASAL BOZULMA
Deamidasyon
L-asparajin ve
L-glutamin
Adrenokortikotropik hormon
• Otuz sekiz amino asit kalıntısına sahiptir
• nötral/alkali pH larda yalancı-birinci derece deamidasyona
uğrar.
• pH ve tampon konsantrasyonunu artması ile deamidasyon
hızı artar.
• Asparajin grubu siklik imid’e ve daha sonra aspartik asit ve
izo-aspartik aside döner.
İnsülin
• 2 disülfit bağı ile bağlanmış 2 polipeptit zinciri ve toplam
51 aminoasitten oluşan proteindir.
• Asidik pH da A zincirindeki (21 amino asit kalıntısı içerir)
21 inci konumdaki Asparajin (Asn A-21) deamidasyona
uğrarken,
• Nötral pH da B zincirindeki (30 amino asit kalıntısı içerir) 3
üncü konumdaki Asparajin (Asn B-3) deamidasyona uğrar.
• İnsülinin pH 2 ve 3 de
deamidasyonu
artmaktadır.
Kimyasal Bozulma
İzomerizasyon ve rasemizasyon
Sekretin
HOOC–His-Ser-Asp-Gly-Thr-Phe-Thr-Ser-Glu-Leu-SerArg-Leu-Arg-Asp-Ser-Ala-Arg-Leu-Gln-Arg-Leu-Leu-GlnGly-Leu-Val–NH2
Sekretinin çözelti halinde uzun süre bekletilmesi sonucunda,
aspartoil sekretin (siklik imid) ve β-aspartil sekretin (izomer)
görülmektedir ve bu izomerizasyon siklik imid aracılığıyla
oluşmaktadır.
pH 4 ün üzerinde Asp-hekzapeptidi de siklik imid oluşumu ile
izomerizasyona uğramaktadır. Siklik imid oluşum hızı, aspartik
asit kalıntısının C-terminal yönündeki aminoasidin boyutundan
etkilenmektedir.
pH 5’de, bazik fibroblast büyüme faktörünün majör bozulma
ürünü olarak da siklik imid tespit edilmiştir.
Histrelin
• Gonodotropin salgılayan hormon
(GnRH) analoğudur bir nonapeptit
tir.
• Hormonlara hassas kanserlerin
tedavisinde (Prostat ve uterus
kanserleri) kullanılır.
• Serin ve histidin rasemizasyonu
görülür.
Kimyasal bozulma
Hidroliz
Şekil: Aspartik asit kalıntılarının asidik pH
larda hidrolizi
Sekretin
HOOC–His-Ser-Asp-Gly-Thr-Phe-Thr-Ser-GluLeu-Ser-Arg-Leu-Arg-Asp-Ser-Ala-Arg-Leu-GlnArg-Leu-Leu-Gln-Gly-Leu-Val–NH2
Asit ortamda izomerizasyona uğramasının yanı sıra
SEKRETİN pozisyon-3 ve pozisyon-15 deki
asparajin kalıntıları aracılığıyla hidroliz ile de
bozulmaya uğrar.
Asidik şartlar altında aspartik asit kalıntılarının
hidrolizi Rekombinant insan makrofajı koloni uyarıcı
faktörü ve rekombinant insan interlökin-11 de de
görülmektedir.
Hidroliz yalnızca asparajin değil serin ve histidin
kalıntılarında da oluşabilmektedir.
Kimyasal bozulma
Disülfit bağ oluşumu ile çapraz bağlanma ve
diğer kovalent etkileşimler
Peptid ve protein moleküllerindeki sistein kalıntılarının
oksidasyonu molekül içi ve moleküller arası disülfit
bağlarının oluşmasına neden olarak üçüncül yapıda
değişimlere yol açar.
Şekil: Sistein kalıntılarının oksidasyonu ile disülfit bağının oluşması
Kimyasal bozulma
Disülfit bağ oluşumu ile çapraz bağlanma ve
diğer kovalent etkileşimler
Peptit ve protein moleküllerindeki normal disülfit bağları,
tiyol grupları tarafından katalize edilen molekül içi ve
moleküller arası değişim reaksiyonlarına girebilirler ve bu
da ikincil ve üçüncül yapılarda değişime yol açar.
RS- + RS-SRı
RıS- + RS-SR
Şekil: Disülfit değişim reaksiyonları
RS-SR + RıSRıS-SR + RS-
Kimyasal bozulma
Disülfit bağ oluşumu ile çapraz bağlanma ve
diğer kovalent etkileşimler
Disülfit bağının kendisi de β-eliminasyona
yatkındır. Dehidroalanin kalıntıları ve
persülfatlar oluşturur. Bu ürünler daha
sonra disülfit değişim reaksiyonlarında
yer
alarak
yeni
çapraz-bağların
oluşmasına neden olabilirler.
Şekil: Disülfit bağında β-eliminasyon
Lizozim
Doğal bağışıklık sisteminin bir
parçasıdır.
pH 6 da deamidasyon,
pH 4 de deamidasyon ve hidroliz,
pH 8 de ise disülfit kalıntılarının
ayrılması ve yeni disülfit bağlarının
oluşması görülür.
Kimyasal bozulma
Moleküller arasında yeni disülfit bağlarının oluşması
peptit ve proteinlerin agregasyonuna neden olur.
Örn:
Su içeriği moleküller arası disülfit bağı oluşumu yoluyla
liyofilize sığır serum albumini ve insülin de, agregasyona
neden olur.
Beta galaktozidaz oldukça düşük su içeriğinde dahi disülfit
bağ oluşumu yoluyla agregasyona neden olur.
Kimyasal bozulma
Kovalent bağ oluşumu protein ve peptitlerde moleküller
arası çapraz bağlanmaya neden olur.
Örn.
Rekobinant tümör nekrozan faktör-α (rTNF-α) nın
liyofilize formülasyonları indirgenebilir olmayan dimer ve
oligomerler oluştururlar.
Depolama sonrası, insülin formülasyonları kovalent
dimerler oluşturabilir ve dimerizasyon oranı yüksek
oranda formülasyona bağlıdır. Bir insülin molekülünün
deamine A-21 asparajin kalıntısı ve başka bir insülin
molekülünün B-1 fenilalanin kalıntısı birleşerek dimerik
bir yapı oluşturabilirler.
Kimyasal bozulma
Oksidasyon
Peptit veya protein yapısındaki sistein kalıntıları oksidasyon
sonucunda disülfit bağlarının oluşmasına neden olur.
α-amilaz
Örn.
α-amilaz tükrük ve pankreatik
salgılarda bulunan ve polisakkaritlerin sindirilmesini sağlayan
bir enzimdir.
α-amilazdaki sistein kalıntısı pH
8 de kolayca okside olur.
Oksidasyon
Protein ve peptidlerde bulunan Metiyonin ve histidin
kalıntıları oksidasyona yatkındır.
Metiyonin
kalıntılarının
oksidasyonu
depolanma
sürecinde paratiroid hormon ve relaksin de görülmüştür.
Dondurularak kurutulmuş ribonükleaz A’nın bozulması,
moleküler oksijen nedeniyle oksidasyona uğramasına
bağlıdır.
Küçük peptidlerde metiyonin kalıntısının metiyonin
sülfoksite oksidasyonu Fe3+ tarafından katalize edilmekte
ve askorbik asit varlığında oksidasyon hızı artmaktadır.
Liyofilize domuz pankreatik elastazı 400C ve %75 relatif
nemde depolandığında yapısında bulunan triptofil
gruplarının oksidasyonu sonucu denatüre olur.
Fiziksel Bozulma
Daha büyük peptidler ve proteinler kimyasal bozulmanın
yanı sıra fiziksel değişimlere de yatkındır.
Peptidler ve proteinler de görülen fiziksel bozulmalar;
Denatürasyon
Agregasyon
Adsorbsiyon
Çökme
Fiziksel Bozulma
Üçüncül (ve/veya dördüncül) yapının bozulması
anlamına gelen denatürasyon genelde biyolojik
aktivitenin kaybı ile sonuçlanır.
Ayrıca, denatürasyona bağlı olarak hidrofobik grupların
açığa çıkması, yüzeyler üzerinde adsorbsiyona,
agregasyona ve çökmeye yol açar.
Denatürasyon üçüncül (ve/veya dördüncül) yapılarda
yaygın olarak görülmeyen kimyasal bozulmayı
hızlandırabilir.
Bu
nedenle
protein
ilaçları
formüle
ederken
denatürasyonu önlemek için önemli ölçüde dikkat
gösterilmelidir.
Fiziksel Bozulma
Disülfit bağı oluşumu sonucu meydana gelen çapraz
bağlanma peptit ve proteinlerin agregasyonuna yol açar.
Hidrofobik bağ oluşumu, kovalent yapıda bir değişim
olmaksızın agregasyona neden olur.
Liyofilize insan büyüme hormonu bekletme süresince
metiyonin oksidasyonu ve asparajin kalıntılarının
deamidasyonu gibi kimyasal bozulmaların yanı sıra
kovalent olmayan agregasyon da göstermektedir.
Az neme sahip liyofilize β-galaktozidaz, disülfit bağı
oluşumu ile agregasyona neden olurken, sulu çözeltisi
kovalent olmayan agregasyona da neden olmaktadır.
Teflon gibi hidrofobik yüzeylerle temas eden insülin
çözeltisi çalkalandığında kovalent olmayan agregat
oluşumuna neden olmaktadır.
Protein ve peptitlerin parçalanmasının
saptanmasında kullanılan analitik yöntemler
• Jel elektroforez
• Jel permeasyon kromatografisi
Peptit ve protein ilaçların
parçalanmasını etkileyen faktörler
Kimyasal degradasyonu etkileyen faktörler;
pH
Tampon içeriği ve konsantrasyonu
Yardımcı maddeler
Fiziksel degradasyonu etkileyen faktörler;
Karıştırma, süzme, seyreltme, basınç uygulama,
dondurma, kurutma gibi formülasyon parametreleri
Nem içeriği ve moleküler mobilite
Katı haldeki peptid ve proteinlerin kimyasal ve fiziksel
stabilitesi içeriğindeki nem tarafından önemli ölçüde
etkilenir.
Şekil. Su içeriğinin 450C de liyofilize
ribonükleaz A agregasyonu üzerinde
etkisi. Nem içeriği: her mol enzim için
yaklaşık 125 mol (a) ve 700 mol (b) su .
Su bileşiminin protein stabilitesine olumsuz
etkisi liyofilize insan büyüme hormonu ve
liyofilize monoklonal antikor-vinka konjugatı
nda da görülmektedir.
Nem içeriği ve moleküler mobilite
Nem içeriği liyofilize proteinlerin depolama esnasında
stabilitesini genel olarak azaltmaktadır.
Ancak, aşırı derece düşük nem içeriği de bazı protein ve
peptitlerin depolama stabilitesini azaltabilmektedir.
Örn:
Liyofilize doku-tipi plazminojen aktivatörü, protein
moleküllerindeki güçlü polar grupları koruyabilmek için
belli miktarda neme ihtiyaç duyar. Liyofilize bilirubin
oksidaz da benzer şekilde protein stabilitesini korumak için
belli miktarda su içeriğine ihtiyaç duymaktadır.
Nem içeriği ve moleküler mobilite
Şekil. 500C’de 24 saat bekletilmiş liyofilize insülin için nem absorbsiyonu (a) ve
agregasyon (b) arasındaki ilişki.
Nem içeriği ve moleküler mobilite
Nem absorpsiyonu, suyun plastikleştirici etkisine bağlı
olarak liyofilize ürünün ve proteinin kendi moleküllerinin
mobilitesini artırır.
Örn. Liyofilize sığır serum γ-globulin in moleküler
mobilitesi su içeriğinin artışına bağlı olarak yükselmiş ve
buna bağlı olarak protein aggregasyonu da artış
göstermiştir.
Yardımcı maddelerin etkisi
• Peptid ve protein formülasyonlarında kullanılan yardımcı
maddelerin, depolanma sırasında, denatürasyon ve
agregasyon üzerinde majör etkileri vardır.
• Camsı geçiş sıcaklığı (Tg) amorf materyallerin moleküler
mobilitelerini hesaplamada kritik bir değişkendir ve
yüksek Tg e sahip yardımcı maddelerin eklenmesinin
liyofilize formülasyonların depolama stabilitesini arttırdığı
görülmüştür. Yüksek Tg değerlerine sahip yardımcı
maddeler liyofilize sığır somatotropini, lizozim ve liyofilize
interlökin-2 nin uzun süreli stabilitesini arttırmıştır.
Yardımcı maddelerin etkisi
• Dekstran içeren liyofilize bovin serum γ-globulin
formülasyonunun kritik mobilite sıcaklığı (Tmc)
dekstranın moleküler ağırlığının artması ile yükselerek
depolama stabilitesinin artmasını sağlamıştır.
• Buna karşın, daha yüksek mobiliteye sahip polivinil
alkolün eklenmesi liyofilize sığır serum γ-globulin
formülasyonunun Tmc değerini düşürerek depolama
stabilitesinin azalmasına neden olmuştur.
Yardımcı maddelerin etkisi
• Şekerler sulu çözeltilerde proteinlerin (örn. Fibroblast
büyüme faktörü) stabilitesini arttırır.
• HP-β-CD ilavesi domuz büyüme hormonunun
stabilitesini arttırır.
• Poloksamerler (non-iyonik surfaktan), üreaz ve
interlökin-2 nin depolanma esnasında denatürasyonunu
engeller. Polimerik yardımcı maddeler, düşük molekül
ağırlıklı ürokinaz ın, insan immünoglobülin M monoklonal
antikoru nun ve insan keratinosit büyüme faktörü nün
stabilitesini arttırır.