MOTOR PROTEİNLER
Doç. Dr. Çiğdem KEKİK ÇINAR
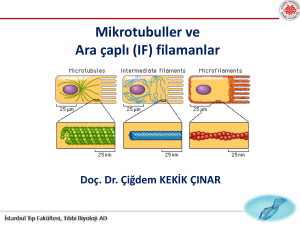
Hücre iskeleti,
Hücre şeklini ve sitoplazmanın organizasyonunu belirleyen bir
yapı iskelesi görevi yapar.
Hücre hareketlerinin gerçekleşmesinden sorumludur.
Dinamik bir yapıdır.
Hücre iskeleti, aktin filamanları, ara filamanlar, mikrotübül gibi üç
temel proteinden oluşur. Bunlar bir arada bulunur ve çok sayıda
aksesuar proteinler aracılığı ile hücre içi organeller ve plazma
zarı ile bağlantılıdır.
***Bakterilerde gözlenmez.
Hücrede 3 çeşit sitoiskelet elemanı bulunmaktadır
Bütün bu sitoiskelet elemanları aksesuar proteinlerle etkileşim
halindedirler.
Bu proteinler; filamentleri birbirine, organellere yada plazma
membranına bağlar.
Hücreyi destekleyici özellikleri önemlidir.
Hücre içindeki hareketlerden sorumludur.
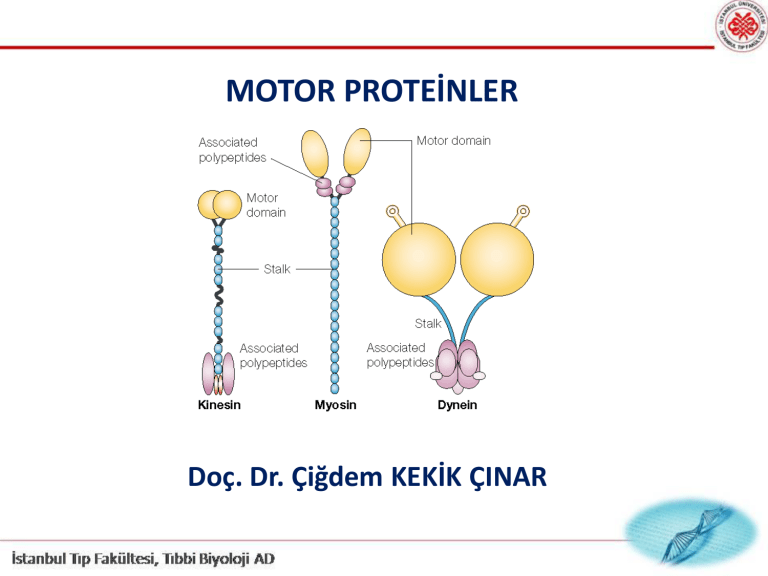
MOTOR PROTEİNLER
Ökaryotik hücrelerde görülen tüm hareketler
aktin yada mikrotubullere bağlı ve
birbirinden farklı
motor proteinlerden kaynaklanır.
Mikrofilamanlara bağlı motor
proteinler
MİYOSİN
Miyosinler, bugüne kadar 17 sınıfı tanımlanmış
muhtemelen tüm ökaryotik hücrelerde bulunan
moleküler motor proteinlerdir.
İnsan genomunda 40 kadar miyosin geni tanımlanmıştır.
ATP hidrolizi ile aktin filamentleri üzerinde hareket eder. ATP ile
oluşan enerjiyi mekanik enerjiye dönüştürürler.
ATP yokluğunda miyosin baş kısmı aktine sıkıca bağlanır. Normal
şartlarda bu çok kısa devam eder. Ama ölüm ile birlikte ölüm
katılığından bu olay sorumludur.
Miyosin baş kısmının ATPaz
aktivitesi vardır.
Baş ve boyun kısmı hareketten
sorumlu, kuyruk kısmı ise kargo
seçiminden sorumludur.
Miyosin aktinin + ucuna hareket
eder.
Miyosin I
Keşfedilen ilk geleneksel olmayan miyosindir (1973).
Tek başlıdır (110 kD).
Zar bağlantısı ve endositozda görev alır. Vezikül ve organel taşır.
Hafif zinciri Kalmodulin’dir.
Adım boyu 10-14 nm’dir.
+ uca hareket eder
Miyosin II
Dimerik, 170-240 kDa ağırlığında 2 ağır zinciri, 16-23 kDa ağırlığında
temel hafif zincirleri (Essential light chains-ELC) ve düzenleyici hafif
zincirleri (Regulatory light chains-RLC) olmak üzere 2 çift hafif zinciri
vardır. Hafif zincirler boyun bölgesindeki kaldıraç kolunu stabilize
ederler.
Kas kasılmasından sorumludur.
Adım boyu 5-10 nm’dir.
İskelet Kası –Miyosin II
Sarkomer kasılma ile %70 kısalır.
Sarkomer, aktin ve miyozin filementlerden oluşur.
Miyosinler, kasta birleşerek bipolar filament oluşturur.
Kas lifi
Uçları sabitler
Kas hücrelerine sinir hücresi ile uyarı gelince sarkoplazmik
retikulumdaki voltaj kapılı Ca kanalları açılır. Sitozole Ca salınır. Ca,
aktine bağlı tropomiyozin üzerindeki troponin’e bağlanır ve
tropomiyozin değişimine neden olur. Böylece miyosin aktine
bağlanır.
Tropomiyozine
bağlıdır. TN-T, TN-I ve
TN-C alt birimleri
vardır. TN-C, Ca bağlar.
7 aktin monomerine
bağlanır. Ca
yokluğunda, aktinmiyozin bağlantısını
bloklar.
Miyosin II, bipolar filamentleri ve aktin filamentleri karşıt yönlere
kaydırarak kasılma hareketini yaparlar.
Kas dışı kasılabilir yapılar, adherens bağlantılar, stres lifleri,
sitokinez halka ve düz kasta bulunur.
Miyosin V
Bitkiler hariç tüm ökaryotik hücrelerde bulunur.
Dimerik bir moleküldür.
Kuyruk bölgesi hücresel lokalizasyonda önemlidir.
36 nm’ye kadar ulaşan adım atma mesafesi vardır.
Membran trafiğinde, özel transport yollarında görevlidir.
İnsan gibi yürüyen protein; Miyosin V
Sınıfı
Adım boyutu
Fonksiyonu
Zara
bağlı,
Endositoz
10-14 nm
I
(-)
(+)
(+)
(-) (-)
(+)
5-10 nm
II
Kontraksiyon
(+)
(-) (-)
(+)
Vezikül
V
36 nm
Organel
transportu
(-)
(+)
Miyosinler, aktinin (+) ucuna doğru hareket ederler.
Miyosin VI, farklı olarak (-) uca doğru hareketi sağlar.
Mikrotubullere bağlı motor
proteinler
KİNESİN, DİNEİN
Mikrotubul üzerindeki hareket iki yönlüdür
1. Mikrotubulun (+) ucuna doğru (sentrozomdan uzağa)
KİNESİN’ler
2. Mikrotubulun (-) ucuna doğru (sentrozoma doğru)
DİNEİN’ler
Mikrotubul polimerizasyonu ve depolimerizasyonu GTP hidrolizi,
Motor proteinlerin hareketi ise ATP hidrolizinden elde edilen
enerji olur.
Kinesin
2 ağır zincir (baş kısmı) ve onu birleştiren hafif zincirden (kuyruk
kısmı) oluşur.
Baş kısmı, ATP ve mikrotubul bağlar, kuyruk kısmı ise vezikül
zarındaki reseptöre bağlanır.
Baş kısım ATPaz aktivitesine sahiptir.
Kinesin’in artı uca hareketiyle veziküller ve organeller taşınır.
İnsan genomunda 45 genin kodladığı 100 farklı kinesin vardır.
Kinesin2 Organel taşınması
Kinesin5 Paralel mikrotubullere bağlanır ve hareketini sağlar.
Kinesin14 - uca taşımada rol alır. Mitozda görevlidir.
Kinesin13 Motor aktivitesi yoktur. Depolimerizasyonu arttırıp,
ATP hidrolize eden proteindir.
Kinesin ailesinin bu farklı üyelerinin
karboksi ucundaki kuyruklarının
dizilimleri değişkendir.
Veziküller,
organeller
ve
kromozomlar gibi farklı tipteki
kargoların mikrotübüller boyunca
hareketinden sorumludurlar.
Baş kısım ATPaz aktivitesine sahiptir. ATP varlığında mikrotubule
bağlanır.
Kuyruk kısım ise spesifik bir organele, membranla sınırlı bir
veziküle bağlanır.
Anafaz
Kinetokor mikrotubul, Kinezin 13 ile yıkılır.
Polar mikrotubul, Kinezin 5 ile uzar.
Dinein motor proteini
Sitozolik ve aksonemal olmak üzere iki gruba ayrılırlar.
Sitozolik dineinler
• organel hareketi
Aksonemal dineinler
• Sil/flagella yapısı
Hafif-İntermediate-2,3 ağır zincir’den meydana gelir.
İki baş kısmı vardır.
İki baş kısmı
aktivitesine sahiptir.
ATPaz
Motor kısmı mikrotubule
bağlanır
Kuyruk kısmı ise veziküle
tutunur.
Sitoplazmik dinein
Nöronlarda iki yönlü taşıma vardır
Sinir hücrelerinde taşıma
Taşınan materyal
Taşınan hücresel yapı
Hızlı anterograte
Glikoproteinler
Glikolipidler
asetilkolinesteraz
Veziküller, SER
Küçük granüller
Retrograte
Sinir büyüme faktörü (NGF)
Lizozomal enzimler
Prelizozomal yapılar
Multiveziküler yapılar
İntermediate
F1-ATPasa
Mitokondri
Yavaş
Aktin, Klatrin, kalmudilin
Mikrofilamanlar
Nörofilaman proteinleri,
tubulin. MAP
Mikrotubul-ara çaplı filaman
ağı
Aksonemal dinein
kargo
Zar glikoproteini
ankirin
spektrin
Dinaktin
kompleks
Arp 1 filaman
dinein
mikrotubul
Kinesin
Dinein
(+) uç
(-) uç
Ağır
zincir
Hafif zincir
10nm
kinesin
dinein
25nm
Kinesin hareketi
Dinein hareketi
Kinesin hareketi
Teşekkürler...
Düden Şelalesi,
ANTALYA

![(Microsoft PowerPoint - M\335YOKARDIN YAPISI [Uyumluluk Modu])](http://s1.studylibtr.com/store/data/000940173_1-fe572bf26229e6f02435f270a825d565-300x300.png)