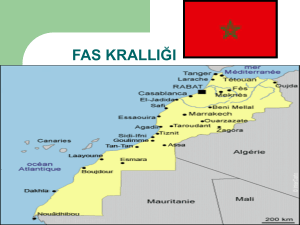
T.C. SAĞLIK BAKANLIĞI Dr.LÜTFİ KIRDAR KARTAL EĞİTİM VE
advertisement

T.C. SAĞLIK BAKANLIĞI Dr.LÜTFİ KIRDAR KARTAL EĞİTİM VE ARAŞTIRMA HASTANESİ PATOLOJİ BÖLÜMÜ ŞEF: Dr. NİMET KARADAYI LARİNKS SKUAMÖZ HÜCRELİ KARSİNOMLARINDA FAS, FAS LİGAND VE P53 EKSPRESYONUNUN KLİNİKOPATOLOJİK PARAMETRELER İLE KARŞILAŞTIRILMASI (Uzmanlık Tezi) Dr.Murat Hakan KARABULUT İstanbul 2007 Bu çalışmanın her aşamasında çok değerli bilgi, deneyim ve emeklerini esirgemeyen klinik şefimiz Dr.Nimet Karadayı, klinik şef yardımcımız Dr.Dilek Yavuzer, kıdemli ihtisas arkadaşım Dr.Medine Murtazaoğlu, patoloji teknikeri Ayşegül Çokel ve eşim Dr.Sezer Karabulut’a; ayrıca ihtisasım süresince desteklerini gördüğüm tüm başasistan, uzman, asistan, tekniker, hemşire, bilgi işlem personeli ve personel arkadaşlarıma sonsuz teşekkürlerimle... Dr.M.Hakan KARABULUT 2 İÇİNDEKİLER GİRİŞ VE AMAÇ……………………………………………….4 GENEL BİLGİLER……………………………………………..5 MATERYAL VE METOD……………………………………...34 BULGULAR………………………………………………..........38 TARTIŞMA………………………………………………………50 SONUÇLAR……………………………………………………...59 RESİMLER……………………………………………………….62 KAYNAKLAR……………………………………………………67 3 GİRİŞ VE AMAÇ Erişkinlerde görülen tüm kanserlerin %2’sini oluşturan larinks kanserlerinin %96’sı skuamöz hücreli karsinomlardır (SHK). Baş-boyun bölgesindeki SHK’ların %26’sı larinksten kaynaklanmaktadır. kanserlerinde prognozu belirleyen en önemli faktörler Larinks TNM sınıflaması ve histopatolojik özelliklerdir. Bununla birlikte sağ kalımı belirleyen ve etkileyen farklı faktörlerin de varlığı son yıllarda öne sürülmektedir. Bunlar arasında apoptozu (programlı hücre ölümü) düzenleyen moleküller ve onkojenik genler ilk sıraları almaktadır. FAS (CD95-Apo1) ve bunun ligandı FasL apoptozun düzenlenmesinde önemli bir moleküler marker’dır. p53’ün (tümör supresör gen) birçok tümörün gelişiminde rol aldığı bilinmektedir. Bu çalışmada larinks SHK’larında FAS, FAS-ligand ve p53 ekspresyonlarının birbirleri, klinik ve histopatolojik parametreler ile ilişkileri ve bunların prognoz üzerindeki etkileri araştırılmıştır. 4 GENEL BİLGİLER LARİNKS KANSERİ İnsidans ve Epidemiyoloji Larinks kanseri erişkinlerde tüm kanserlerin %2’sini oluşturur.8 Erkeklerde bu oran %2.2 , kadınlarda ise %0.4’tür.1 ABD’de yeni kanser tanısı alan vakaların yaklaşık %1’ini kapsamakla beraber, kansere bağlı ölümlerin %12’den azını oluşturmaktadır.3 Larinks kanseri görülme sıklığı ülkelere göre değişiklik göstermek üzere 3-10/ 100000 aralığında insidanslar bildirilmiştir.4,10,11 Erkeklerde daha sık görülen larinks kanserlerinde erkek:kadın görülme oranları 4:1 ile 20:1 arasında değişmektedir.1,7 Yaşa göre görülme sıklığı, 5.-7. dekadlar arasında yoğunlaşmaktadır.1,7 Larinks malignitelerinin %96’sı skuamöz hücreli karsinom (SHK) olup, baş-boyun bölgesindeki SHK’ların yaklaşık almaktadır.1,3,4,6 5 %26’sı larinks’ten köken Tanı sırasında, larinks karsinomu olgularının yaklaşık %60’ında tümör larinks’te lokalize olup, %25 olguda bölgesel lenf nodu metastazı, %15’inde ise uzak metastaz saptanmıştır.1,3,5,9 Larinks kanseri bulunan bir hastada aynı anda 1’den fazla primer karsinom görülme oranı yaklaşık %1’dir.1,9 Üst solunum ve sindirim yollarında metakron SHK görülme oranı, larinksi de içine alacak şekilde %5 ile %35 arasındadır. Özofagus en sık görülen sekonder primer tümör odağıdır.3,10 Larinks kanserleri ile ilgili ülkemizde yeterli istatistiksel bilgi bulunmamakla beraber her yıl yaklaşık 2000 kadar yeni larinks kanseri olgusu saptandığı, bunların çoğunluğunun (yaklaşık % 96) erkeklerde görüldüğü ve daha çok supraglottik yerleşimli tümörler olduğu sanılmaktadır.10 Karakök ve arkadaşları larinks kanserinin, ülkemizde 3. sıklıkta görülen malign tümör olduğunu bildirmişlerdir.10 Elçi ve arkadaşlarının çalışmasında ise larinks kanserinin erkeklerdeki en sık 2. kanser olduğu ve yine erkeklerde tüm ölümlerin %7’sinden sorumlu olduğu bildirilmiştir.23 Risk faktörleri: Sigara: Sigara kullanımı larinks kanseri gelişiminde en önemli risk faktörüdür.11,13 Sigara ile ilgili yapılan araştırmalarda, primer kanserojen maddelerin katran, polisiklik aromatik hidrokarbonlar, benzopren ve nitrozamin olduğu saptanmıştır.8,11 Larinks kanseri olgularının yaklaşık %90’ı, en azından hayatlarının bir döneminde sigara kullanan kişilerden oluşur.15 Ayrıca başlama yaşı, sigaranın cinsi, günlük tüketim miktarı bu faktörü etkileyen diğer parametrelerdir.3 6 Sigaraya 15 yaşından önce başlayanlarda larinks kanseri gelişme riskinin 2 kat daha fazla olduğu bildirilmiştir.3,11,13 Koyu (dark) tütün kullananlarda, hafif (light) tütün kullananlara göre 2.5, sigara kullanmayanlara göre ise 35 kat daha fazla risk saptanmıştır.3,15 Koyu tütün, alkalinitesi nedeniyle orofaringeal ve laringeal bölgede daha uzun süre temas halinde olduğu için daha karsinojen olup, özellikle supraglottik tümörlerle ilişkili bulunmuştur.3,22 Sigara hiç kullanmayanlara oranla günde 1 paketten az kullananlarda 13.8 kat, günde 2 paketten fazla tüketen kullanıcılarda ise 34.4 kat fazla larinks kanseri gelişme riski bulunmaktadır3 . Ayrıca pasif olarak sigara dumanına maruz kalanlarda da risk mevcuttur.8,12 Sigara kullanımının bırakılması ile larinks kanseri gelişme riskinin yıllar içinde azaldığı bildirilmiş olup genel olarak sigara kullanımının azaldığı kuzey Avrupa ülkelerinde bununla orantılı olarak larinks kanseri görülme sıklığının da azaldığı belirlenmiştir.3 Alkol (etanol) : Alkol kulanımının larinks kanseri gelişme riskini 2.2 kat arttırdığı gösterilmiş olup bunda etken olarak alkolde bulunan fenol veya diğer çözücü maddelerin rol oynayabileceği ileri sürülmüştür.3,10,11 Alkolün sigara ile birlikte kullanımı özellikle supraglottik tümörlerin gelişimi ile ilişkili bulunmuş ve yalnız sigara kullanımına ek olarak kanser gelişme riskinin 6 kat daha fazla olduğu bildirilmiştir.3,12 Ağız yıkama solusyonları da içeriklerindeki alkol nedeniyle üst solunum yolu ve üst sindirim yolu kanserlerinde risk faktörü olarak gösterilmişlerdir. 200 7 hastadan oluşan baş-boyun kanseri serisinde sadece 11 hastanın sigara ve alkol kullanım öyküsü olmadığı ancak bu 11 hastadan 10’unun yıllarca günlük düzenli ağız yıkama solusyonları kullandıkları saptanmıştır.3 Çevresel faktörler: Çiftçiler, ağaç ve odun işçileri, hardal gazı işçileri, nikel işçileri, kömür işçileri, lastik sanayi çalışanları, deri ve tekstil işçileri, krom maden işçileri, boya sanayi çalışanları ve asbest’e maruz kalanlar larinks kanseri için risk içeren meslek gruplarıdır.3,21,22,23 Elçi ve arkadaşları,23 ülkemizde çeşitli meslek gruplarını incelemiş ve tekstil çalışanları, inşaat işçileri ve şoförlerde, özellikle supraglottik tümörlerin görülme riskinin daha yüksek olduğunu bildirmişlerdir. Ayrıca silika ve pamuk tozları, egzos gazları ile uzun süre polisiklik aromatik hidrokarbonlara maruz kalma sonucunda da larinks kanseri gelişme riski artmaktadır. Ancak bu grubun araştırmasında asbest, formaldehit ve solventler ile larinks kanseri gelişimi arasında anlamlı ilişki bulunamamıştır.23,24 Diyet: Yetersiz beslenme sonucunda larinks kanseri insidansının arttığı çeşitli araştırmalarda gösterilmiştir.3 Sebze ve meyveden zengin, lifli gıda tüketimi yüksek bireylerde A ve C gibi antioksidan vitaminlere bağlı olarak larinks kanserinin daha az görüldüğü düşünülmektedir. Ayrıca işlenmemiş doğal haldeki tahıl ürünlerinin tüketiminin larinks kanseri ile ters ilişkili olduğu ancak rafine tahıl ürünlerinin tüketimi ile larinks kanseri gelişiminin doğru orantılı olduğu bildirilmiştir.3,4,7,14 Radyasyon: İyonize radyasyon ile larinks kanseri arasındaki ilişki ilk olarak 1930’da Von Ericken tarafından bildirilmiştir.10 Günümüzde primer tedavi olarak radyoterapi uygulanan baş-boyun tümörlerinde yıllar sonra görülen 8 tümörlerin nüksten daha çok radyoterapiye bağlı olarak gelişen sekonder primer tümörler oldukları ileri sürülmektedir.4 Viral risk faktörleri: Herpes simplex enfeksiyonlarının bu hastalarda görülen immün sistem supresyonuna bağlı olarak larinks kanseri oluşma riskini arttırdığı bildirilmiştir.5,8,9 Human papilloma virüs (HPV) enfeksiyonları da larinks karsinomlarında risk faktörü olarak ileri sürülmektedir. Larinksin lezyonlarında HPV varlığı çeşitli yöntemlerle benign ve malign gösterilmiştir. Larinks kanserlerinde HPV pozitifliği %22 ile %83 arasında değişirken, normal larinks mukozasında bu oran %7 ile %64 arasında değerler bildirilmiştir.20 HPV’nin onkojenik potansiyelinin, iki erken viral gen ürünü olan E6 ve E7 ile ilişkili olabileceği düşünülmektedir. E6 proteini p53, E7 proteini ise retinoblastom tümör supresör proteinlerine bağlanarak, bunları inaktive eder. Bu etkileşimin affinitesi, HPV’nin onkojenik potansiyelinde değişiklikler oluşturur. Örneğin yüksek riskli HPV alt gruplarından (16,18,31,33) E6 ve E7 proteinleri Rb ve p53 supresör proteinlerine daha yüksek affinite ile bağlanır. Bununla birlikte, HPV enfeksiyonunun tek başına karsinogenez için yeterli olmadığı, bunların çevresel faktörler ile ortak hareket ederek karsinojenik etki oluşturdukları düşünülmektedir.1,3,5,20 Laringeal papillomlar genellikle benign olmakla birlikte, %2 olguda malign transformasyon olabileceği öngörülmektedir3. Laringeal papillomatozis sıklıkla HPV 6 ve 11 ile ilişkili iken, Larinks kanserlerinde en sık görülen tipler ise HPV 16, 18, 31 ve 33’ tür. Erken evre tümörler (evre 1-2), glottik tümörler ve iyi diferansiye karsinomlar ile HPV DNA pozitifliği arasında istatistiksel olarak anlamlı korelasyon bulunduğu bildirilmiştir.20 9 Gastroözofageal (GÖR) ve laringofaringeal reflü (LFR) : pH monitörizasyonu ile özofageal probda pH’ın 4’ün altına düşmesi GÖR, bunu takip eden faringeal probda asit pH saptanması ise LFR olarak kabul edilmektedir.18,19 Larinks karsinomu etyolojisinin multifaktöryel olduğu gözönüne alındığında, bu faktörlerden sigara ve alkolün karsinojenik etki mekanizmaları arasında reflüyü arttırıyor olmaları da sayılabilir.17 Sigara ve alkol kullanım öyküsü bulunmayan hasta gruplarında larinks kanseri ve gastroözofageal reflü hastalığı arasında pozitif korelasyon olduğu bildirilmiştir. Sigara içmeyen ya da uzun süre önce sigara kullanımını bırakmış glottik karsinomlu hastalarda çeşitli serilere göre %16 ile %48 arasında değişen reflü oranları saptanmıştır.3,16 LFR ses kısıklığı, globus faringeus, disfaji, kronik öksürük ile karakterizedir.17 Heredite: Larinks kanserleri için herediter predispozisyon bu hastalarda saptanan yüksek Arilhidrokarbon hidroksilaz enzim seviyelerine bağlanmıştır. Polisiklik aromatik hidrokarbonların epoksitlere dönüşümüne neden olan bu enzim, özellikle sigara kullanımı söz konusu olduğunda kanser gelişme riskini arttırmaktadır.8,11,13 Larinks kanseri olgularının yakın aile bireylerinde %7-15 oranında yüksek enzim seviyelerine rastlanmıştır.9,10,12 10 Larinks’in prekanseröz lezyonları Larinksin prekanseröz epitelyal lezyonları 2005 WHO sınıflamasına göre 5 grupta değerlendirilmektedir; 1- Skuamöz hücre hiperplazisi 2- Hafif derecede displazi 3- Orta derecede displazi 4- Ağır displazi 5- Karsinoma in situ Bu lezyonlardaki malign transformasyon oranları basit hiperplazi ve hafif displazi için %0.09, orta ve ağır displazi için ise %11 olarak bildirilmiştir.9 LARİNKS KANSERİ TİPLERİ Tümörün larinksteki yerleşim yeri, semptomlar, histoloji ve klinik davranış üzerine etkilidir.6 Laringoskopik inceleme, bilgisayarlı tomografi ve manyetik rezonans görüntüleme ile yapılan değerlendirmeler sonucunda larinks kanserleri lokalizasyonuna göre 4 grupta incelenir. Bunlar supraglottik, glottik, subglottik ve transglottik olarak sıralanır.1,2 11 1-Supraglottik tümörler Supraglottik tümörler, Avrupa ülkelerinde larinks kanserlerinin en sık görüldüğü bölgedir.9,12,23 ABD’de ise tüm olguların %30-35’ini oluşturur.1 Dört alandan gelişebilir; epiglottis, ventriküler bant, ariepiglottik alan, aritenoid bölge.6 Supraglottik tümörlerin 1/3’ü epiglotun laringeal ya da lingual yüzünden kaynaklanır ve en sık preepiglottik alana yayılırlar.4,7 Lenf nodu metastazı ortalama %40 oranında görülür. Olguların %2035’inde klinik olarak lenf nodu metastazı olmamasına rağmen, patolojik incelemede okült metastazlara rastlanmıştır.1 Supraglottik kanserler semptomları belirgin olmadığı için geç tanı alabilirler. Bu hastalarda boğazda irritasyon bulguları ve takılma hissi, kulağa vuran ağrı ve disfaji tümörün çeşitli evrelerinde görülebilir. Ses kısıklığı tümörün glottik bölgeye yayılarak transglottik hale geldiğini ve biyolojik olarak daha agresif davranış aldığını gösterir.6 Supraglottik tümörlerde tümörün evresine göre radyoterapi, parsiyel veya total larinjektomi tedavi seçenekleri arasında yer alır.4,7 2- Glottik tümörler ABD’deki larinks kanserlerinin %60-65’i bu gruba dahildir. Bu tümörler, gerçek vokal korddan kaynaklanırlar. Vokal kordların 1/3 ön kısımları en sık görülen lokalizasyondur. Etrafındaki kıkırdak duvar ve lenfatik drenajın az 12 olması nedeniyle uzun süre lokalize kalabilirler. İleri evrelerde subglottik veya supraglottik yayılım gösterirler.1,6 Medikal tedaviye dirençli ses kısıklığı glottik tutulumu gösterir ve bu sayede glottik tümörler erken semptom vererek daha erken tanı alırlar.6 T1 glottik lezyonlar, vokal kordun serbest kenarına sınırlı olup kord hareketleri etkilenmemiştir. T2 glottik tümörler supra veya subglottik yapılara uzanım göstererek vokal kord hareketlerinde bozulma oluşturabilirler. T3 glottik tümörlerde vokal kord hareketsizdir. Tiroaritenoid kas invazedir ve sıklıkla submukozal subglottik ya da supraglottik yayılım mevcuttur.7 T4 olgularda ise tümör tiroid kartilaj, boyun yumuşak dokuları, dil kökü gibi larinks dışı yapıları invaze etmiştir.4,5,7,9 Tanı sırasında pozitif lenf nodu oranları T1 olgularda <%1, T2 olgularda %1-2, T3-T4 olgularda ise %20-30’dur. 3. Subglottik (İnfraglottik) tümörler Subglottik tümörler tüm larinks kanserlerinin %5’inden azını oluşturur. Bu gruba gerçek kordu tutan ve subglottik bölgeye 1cm’den fazla yayılım gösteren tümörler ve bütünüyle subglottik alana sınırlı tümörler dahildir.1 Genelde krikotiroid membranı perfore ederek erken dönemde ekstralaringeal 13 yayılım gösterirler. Bu tümörler genelde ekzofitik büyümeleri sebebiyle hava yolu obstrüksiyonu oluşturabilirler.6 Servikal lenf nodu metastazı %15-20, paratrakeal lenf nodu metastazı %50 oranında görülür. 4. Transglottik tümörler Transglottik tümörler tüm olguların %5’inden azını oluştururlar.1 Tümör ventrikülü dikey olarak geçer ve vokal kord fiksasyonu mevcuttur. Servikal lenf nodu metastazı en sık bu grupta görülür (%52). Metastazlar sıklıkla büyük tümör çapı ve larinks iskeletine invazyonla ilişkilidir.6 Genel olarak larinks kanserlerinin en sık metastaz yaptığı yerler; bölgesel lenf nodları ve akciğerlerdir. Direkt yayılımla en sık tiroid gland ve juguler ven tutulur.1,4 PATOLOJİK GÖRÜNÜM Makroskopik olarak larinks tümörlerinin çoğunluğu 1-4cm boyutlarındadır. Genellikle ülsere, yüzeyden kabarık, pembe-gri renkli kitle oluşturan lezyonlardır. Vokal kord lezyonları ise keratotik olma eğilimindedir.1,2 Mikroskopik olarak %90’ından fazlasını skuamöz hücreli karsinomlar (SHK) oluşturur.1,9 (tablo 1) 14 Tablo 1: Histolojik tip ( WHO sınıflaması) 1- Skuamöz hücreli karsinom a- Konvansiyonel skuamöz hücreli karsinom b- Verrüköz karsinom c- Bazaloid skuamöz hücreli karsinom d- Papiller skuamöz hücreli karsinom e- İğsi hücreli skuamöz hücreli karsinom f- Akantolitik skuamöz hücreli karsinom g- Adenoskuamöz karsinom 2- Lenfoepitelyal karsinom 3- Dev hücreli karsinom 4- Malign tükrük bezi kökenli tümörler; Adenoid kistik karsinom Mukoepidermoid karsinom 5- Nöroendokrin karsinom Tipik karsinoid tümör Atipik karsinoid tümör Küçük hücreli karsinom, nöroendokrin karsinom Kombine küçük hücreli karsinom, nöroendokrin kökenli 6- Yumuşak doku tümörleri 7- Lenfo-hematoid tümörler 8- Kemik ve kartilaj tümörleri 9- Mukozal malign melanoma 10- Sekonder tümörler 15 Konvansiyonel skuamöz hücreli karsinom: Keratinizasyon, pearl yapıları, tümör karakterizedir. hücreleri Larinks arasında tümörlerinin interselüler % 90’ını köprülerin oluşturur. varlığı ile Tümörler diferansiyasyon derecesi, hücresel pleomorfizm ve mitotik aktiviteye göre iyi diferansiye (grade 1), orta derecede diferansiye (grade 2) ve az diferansiye (grade 3) olarak derecelendirilir.6 Sonuçta subjektif olan bu derecelendirme prognostik olarak önemli bir parametre olduğu için çok sayıda tümör örneklemesi yapılarak olabildiğince objektif bir değerlendirmeye ulaşılabilir.1,5,9 Mikroinvaziv SHK: Tümör invazyonu dağınık veya farklı odaklar şeklinde olabilir ancak bu invazyon bazal membranın hemen altında sınırlanmıştır. Süperfisyel yayılan SHK: İnvazyon lamina propriada sınırlı olup mikroinvaziv ve derin invaziv formlar arasında bir yer tutar. Derin invaziv SHK: Lamina propria’nın ötesinde kas ve kıkırdak yapılara invazyon mevcuttur. Klinik olarak tanı alan tümörlerin çoğunluğu bu grupta yer alır. Verrüköz skuamöz hücreli karsinomlar: Larinks kanserlerinin %3-5’ini oluşturur. Keratinize epitelin ekzofitik büyümesi ile karakterli, lokal infiltratif, iyi diferansiye SHK varyantıdır.5,9 Sıklıkla glottik bölgeye yerleşir. Belirgin polipoid yapıda büyük hacimli kitle oluşturan bu tümörler yavaş büyürler. Genellikle yüzeyeldir ve lokal yapıları komprese ve erode etme eğilimindedir. Kesitinde geniş parakeratotik ya da keratotik tabakalarla ayrılan, epitelyal sivri takke şeklindedir ve bu yapı içinde mikroabseler izlenir. Stromada belirgin kronik inflamatuar hücre infiltrasyonu ve keratine karşı oluşmuş yabancı cisim 16 tipi granülomlar görülür.1,5,6 Verrüköz karsinomlar HPV 16 ile birliktelik gösterebilir.5,9 İyi diferansiye SHK ve papiller SHK’dan minimal atipi, büyüme paterni ve metastazın az görülmesi ile ayrılır. Verrüköz karsinomlarda konvansiyonel SHK odağı ile birliktelik görülebilir, Hibrid Verrüköz SHK olarak adlandırılır ve metastaz potansiyeli vardır. Bu nedenle tümörün tamamı örneklenmelidir.1,6,9 Larinks’te nadir de olsa verruka vulgaris görülebilir. Verruka vulgaris’te granüler tabaka belirgindir, büyük keratohyalin granülleri ve yoğun keratotik tabaka izlenir. Verrüköz karsinomlar; verruka vulgaris, soliter papillom, papillomatozis gibi benign lezyonlardan normal dokuyu yüzeyel olarak invaze etmesi ile ayrılır.1,2 Bazaloid skuamöz hücreli karsinomlar: Bazaloid ve skuamöz hücreli komponentin bir arada görüldüğü bimorfik karsinomdur. Bazaloid komponent daha belirgindir. Hiperkromatik nüveli, soluk sitoplazmalı, küçük hücrelerden oluşur. Periferal palizadlar, kistik veya gland benzeri boşluklar ve fokal skuamöz diferansiyasyon alanları izlenir. Nekroz sıktır. Stroma sıklıkla hyalinizedir. SHK komponentin görülmesi ile adenoid kistik karsinomdan ayrılır.5,6,9 Oldukça agresif seyreden bu tümörler sıklıkla hipofarenks, dil kökü ve supraglottik larinks’te ve genellikle ileri evrelerde saptanabilirler.1,9 Papiller skuamöz hücreli karsinomlar: Ekzofitik papiller komponent içeren SHK’dir. Mikroskopik olarak papiller karsinoma in-situ görünümündedir. İnvaziv komponent sıklıkla farkedilemez, bu yüzden çok sayıda örnekleme ve seri kesit yapılarak incelenmelidir. İnvazyon mikroinvazyon ya da yüzeyel yayılım şeklindedir.1,5,9 17 saptandığında ise ya İğsi hücreli karsinom: Bir komponenti in-situ veya invaziv SHK, diğer komponenti mezenkimal görünümlü ancak epitelyal kökenli malign iğsi hücrelerin oluşturduğu bifazik karsinomdur. Hızlı büyürler ve çoğunlukla polipoid görünümdedirler. Bu tümörlerin çoğu glottik yerleşimlidir. Tümörün büyük kısmını iğsi veya pleomorfik hücrelerin görüldüğü sarkomatoid alanlar oluşturur. Atipik mitozlar ve multinükleer tümör hücreleri görülebilir. Tümörün SHK komponenti in situ veya invaziv olabilir ancak oran olarak az olan bu komponentin gösterilebilmesi için çok sayıda örnekleme yapılması gerekir.1,5,6,9 Akantolitik skuamöz hücreli karsinom: Bu oldukça nadir görülen varyant, tümör hücrelerinin akantolizisi ve böylece yanıltıcı olarak glandüler diferansiyasyon görüntüsü ile karakterizedir. Larinkste genellikle supraglottik bölgede görülen bu tümörlerin daha agresif seyirli oldukları bildirilmiştir.9 Adenoskuamöz karsinom : Adenokarsinom ve SHK alanları bir arada görülür. Yüzey epitelinden kaynaklanan bu tümörlerdeki SHK komponenti insitu ya da invaziv olabilir, adenokarsinom komponenti ise bazaloid, kolumnar veya müsin salgılayan hücrelerle döşeli glandüler yapılardan oluşur. İleri derecede malign tümörler olup sık metastaz yaparlar.5,9 PROGNOSTİK FAKTÖRLER 1- Sosyodemografik faktörler Yaş, cinsiyet, eğitim düzeyi, sosyal durum, sigara kullanımı ve alkol kullanımı vb. faktörlerin etkilerini ayrı ayrı incelemek ve belirleyebilmek oldukça güçtür.3,4,7 18 Hasta yaşının larinks SHK prognozu üzerine etkisi ile ilgili çok sayıda çalışma yapılmış olup farklı sonuçlar elde edilmiştir. Eiband ve arkadaşları26 hastaları 60 yaş’ı sınır alarak 2 grupta incelemiş ancak prognoz açısından istatistiksel anlamlı bir fark bulamamışlardır. Pera ve arkadaşları ise 60 yaş üzeri hastalarda prognozun istatistiksel anlamlı olarak daha kötü gidişli olduğunu bildirmişlerdir.25 Larinks kanserleri cinsiyet açısından incelendiğinde kadın ve erkekler arasında istatistitiksel olarak anlamlı fark olmamakla birlikte kadınlarda daha uzun hastalıksız sağkalım süreleri bulunmuştur.26 Sosyoekonomik durum ile ilgili objektif sonuçlar elde edebilmek oldukça güçtür. Ancak hastaların büyük çoğunluğunun eğitim seviyesi düşük ve kötü ekonomik koşullara sahip olması ayrıca bu grup bireylerde sigara ve alkol kullanımının daha yüksek olması hem etyopatolojik olarak hem de zamanında ve yeterli tedaviye ulaşılamaması nedeniyle prognozu kötü etkilemektedir.3,11,12,13 Sigaranın prognoz üzerine etkisinin değerlendirilmesi larinks SHK’larının sigara içmeyenlerde çok nadir görülmesi sebebiyle zordur. Ancak primer tümörün tedavisi sırasında ve sonrasında sigaraya devam eden hastalarda rekürrens ya da ikinci primer tümörlerin daha sık görüldüğü bildirilmiştir.4,7,10 2- Klinik faktörler Evre: Larinks kanserlerinin evrelenmesi tümör değerlendirilmesi ve tedavi planlanmasında gereklidir.25 Ayrıca prognozu belirleyen en önemli parametredir. 19 Bugün American Joint Comittee on Cancer Staging and End results Reporting’in (AJCC) esaslarını temel alarak modifiye ettiği TNM evreleme sistemi kullanılmaktadır.1,3,9 (tablo 2) Tablo 2. Larinks tümörlerinde TNM evreleme sistemi (AJCC) PRİMER TÜMÖR (T) Tx Primer tümör değerlendirilemiyor T0 Primer tümör bulgusu yok Tis Karsinoma in-situ Supraglottik T1 Normal kord hareketi ile birlikte supraglottisin bir bölgesine sınırlı tümör T2 Normal vokal kord hareketi ile birlikte supraglottisin birden fazla bölgesine invaze tümör T3 Kord fiksasyonu ile birlikte larinkse sınırlı ve/veya postkrikoid alan, preepiglottik bölge, paraglottik boşluğa yayılmış tümör ve / veya minör tiroid kartilaj erozyonu T4a Tiroid kartilajı invaze etmiş ve/veya larinks ötesi diğer dokulara yayılmış tümör (trakea, orofarinks ya da boyun yumuşak dokuları) T4b Prevertebral boşluklara, karotis artere veya mediastinal yapılara invaze tümör Glottik T1 Normal hareketle birlikte kord veya kordlara (ön veya arka komissürü içerebilir) sınırlı tümör T1a Bir korda sınırlı tümör T1b Her iki kordu tutan tümör T2 Supraglottis ve/veya subglottise uzanan ve/veya bozulmuş kord hareketi ile birlikte olan tümör T3 Kord fiksasyonu ile birlikte larinkse sınırlı ve/veya paraglottik boşluğa yayılmış tümör, ve/veya minör tiroid kartilaj invazyonu T4a Tiroid kartilajı invaze etmiş ve/veya larinks ötesi diğer dokulara yayılmış tümör (trakea, orofarinks ya da boyun yumuşak dokuları) T4b Prevertebral boşluklara, karotis artere veya mediastinal yapılara invaze tümör Subglottik T1 Subglottise sınırlı tümör T2 Normal veya bozulmuş kord hareketleri ile birlikte kord veya kordlara uzanan tümör T3 Kord fiksasyonu ile birlikte larinkse sınırlı tümör T4a Tiroid veya krikoid kartilajı invaze etmiş ve/veya larinks ötesi diğer dokulara yayılmış tümör (trakea, orofarinks ya da boyun yumuşak dokuları) T4b Prevertebral boşluklara, karotis artere veya mediastinal yapılara invaze tümör BÖLGESEL LENF NODLARI (N) Nx Bölgesel lenf nodu değerlendirilemiyor N0 Bölgesel lenf nodu metastazı yok N1 En büyük boyutu 3cm veya daha az olan tek, ipsilateral metastatik N2a En büyük boyutu 3cm’den büyük, 6cm’den küçük, tek, ipsilateral lenf nodu metastatik lenf nodu N2b Multipl, ipsilateral, hepsi 6cm’den küçük metastatik lenf nodları 20 N2c Bilateral veya kontralateral hepsi 6cm’den küçük metastatik lenf nodları N3 En büyük boyutu 6cm’den büyük lenf nodu metastazı UZAK METASTAZ (M) Mx Uzak metastaz varlığı değerlendirilemiyor M0 Uzak metastaz yok M1 Uzak metastaz var EVRELEME Evre 0 Tis N0 M0 Evre I T1 N0 M0 Evre II T2 N0 M0 EvreIII T3 N0 M0 T1 N1 M0 T2 N1 M0 T3 N1 M0 T4a N0 M0 T4a N1 M0 T1 N2 M0 T2 N2 M0 T3 N2 M0 T4a N2 M0 T4b N0,1,2,3 M0 Evre IVA Evre IVB T1,2,3,4 N3 Evre IVC M0 T1,2,3,4 N0,1,2,3 M1 Primer tümör (T), larinks kanseri olgularında kliniğin değerlendirilmesi, tedavi planlanması ve prognoz belirlemede önemlidir.4,7,10 T evresi büyüdükçe sağkalım süresi kısalır. Yapılan çalışmalarda T1 ile T2 ve T3 ile T4 olgular arasında sağkalım açısından anlamlı fark bulunamamış ancak T1, T2 olguların T3, T4 olgulara göre daha iyi prognoza sahip oldukları gösterilmiştir.26 Larinks kanserlerinde lenf nodu metastazı en önemli prognostik faktördür.4,7,10,27,28 Sağkalım süresi, nüks, tedavide başarısızlık, pozitif lenf nodu ile ilişkilidir.1,4,7 Lenf nodu metastazı olmayan hastalarda 5 yıllık sağkalım oranı %64-94.5 iken lenf nodu metastazı bulunan hastalarda bu oran %29-54’e düşmektedir. Pozitif ve negatif grup arasında sağkalım sürelerinde belirgin bir fark olmakla beraber bu aynı zamanda tutulan lenf nodlarının lokalizasyonuna 21 da bağlıdır. Üst ve orta juguler bölgelerdeki metastatik lenf nodu olan hastaların prognozlarının diğer bölge tutulumu olanlara göre daha iyi olduğu gösterilmiştir.28 Tutulan lenf nodu sayısının prognoz üzerine belirgin etkisi olmamakla birlikte 3’ten fazla lenf nodu tutulumunun mortaliteyi %65’ten %84’e çıkardığı bildirilmiştir.25,28 Evre 1 ve 2 kanserler “erken”, evre 3 ve 4 kanserler ise “ileri” evre olarak değerlendirilirler. Evre 1-2 (erken) olgular arasında sağkalım açısından belirgin bir fark olmamakla birlikte evre 3-4 (ileri) olgulara göre anlamlı olarak daha uzun yaşam süresine sahiptirler.26 Anatomik lokalizasyon: Primer lezyonun lokalizasyonu, larinks kanserlerinde önemli prognostik faktörlerden biridir.27 Bu farklılıklar anatomik bariyerler, vasküler ve lenfatik zenginlik ve destek dokuların kalınlıklarının değişiklik göstermesi ile açıklanabilir.25,26 Örneğin glottik tümörler zayıf lenfatik dağılım nedeniyle supraglottik veya subglottik tümörlerden daha az sıklıkta metastaz yaparlar. Her bir T kategorisi için 5 yıllık sağkalım, glottik tümörlerle karşılaştırıldığında, supraglottik tümörlerde %10 daha az bulunmuştur. Subglottik tümörler nadir görülmekle birlikte metastaz eğilimi sıktır ve prognozu en kötü tümörlerdir.1,4,9,10 Tümör çapı: Larinks kanseri 416 olgudan oluşan bir seride tümör çapının 0.4cm ile 7cm arasında değiştiği saptanmıştır. Bu olguların %50’sinde tümör çapı 2.5cm’den küçük olup bu hastalarda oldukça iyi prognoz izlenmiştir. Benzeri çalışmalarda da tümör çapı ile lokal rekürrens arasında pozitif korelasyon bulunduğu bildirilmiştir.5,10 Primer tümör ülserasyonu: Primer tümörde ülserasyon, kötü prognostik bir faktör olarak bilinmektedir. Ülsere lezyonlar genellikle büyük 22 invaziv tümörler olup daha küçük ve ülsere olmayan tümörlerle karşılaştırıldıklarında daha kısa hastalıksız sağkalım sürelerine sahiptirler.26 3- Histopatolojik ve immünohistokimyasal faktörler Histolojik grade: Larinks SHK’larında histolojik diferansiyasyon derecesi prognozu etkileyen önemli faktörlerden biridir. Az ya da indiferansiye tümörler yüksek metastaz potansiyeline sahip olup anlamlı olarak kötü prognoz ile ilişkilidir. İyi ve orta derecede diferansiye tümörler arasında prognoz açısından istatistiksel fark bulunmamıştır.2,25 Doku cevabı: S-100 ile pozitif boyanan langerhans hücrelerinin, tümör stromasında fazla miktarda bulunmasının iyi prognostik işaret olduğu öne sürülmüştür.1 DNA ploidisi: Larinks kanserlerinin çoğunda akım sitometrisi ile anöploidi saptanmıştır. Anöploidinin prognoza etkisi ile ilgili çalışmaların sonuçları oldukça çelişkili olup olumlu, olumsuz veya etkisiz olduğu şeklindedir.82 Ploidi ile grade arasındaki ilişki araştırılmış; iyi diferansiye SHK’ların %49’unun, orta derece diferansiye SHK’ların %25’inin, az diferansiye SHK’ların %22’sinin diploid olduğu bildirilmiştir. Bu hastalarda, 4 yıllık sağkalım sonuçları; diploid tümörlerde %82, anöploid tümörlerde %42 şeklindedir.7 Anöploid tümörlerde lokal rekürrens riskinin arttığı gösterilmiştir.1,5,9 Anjiogenez: Anjiogenez, önceden var olan damarlardan tomurcuklanma yoluyla yeni damar oluşumudur ve embriyolojik gelişmede, diferansiyasyonda, üremede yara iyileşmesinde gereklidir.8 Genel olarak anjiogenez 4 basamaktan oluşur; (1) ana damarın bazal membranının proteoliz ile parçalanması sonucu 23 kapiller filizin oluşmasına izin verilmesi, (2) endotel hücrelerinin anjiogenik uyarıya doğru göç etmesi, (3) endotel hücre proliferasyonu, (4) kapiller tüp oluşumu. Bu yeni damarlar interendotel bileşkelerin tam oluşmaması nedeniyle oldukça geçirgendir. Anjiogenez oluşumunda etkisi olan bazı faktörler mevcuttur; EGF, pdEGF, TGF, PG, b-FGF, VEGF vb. Anjiogenik faktörler tümör hücrelerinden, inflamatuar hücrelerden ve stromal hücrelerden salgılanabilir.1,5,8 Solid tümörlerin çaplarını 1-2mm’nin üzerine çıkarmak için damarlanmaya ihtiyaçları vardır. Bu 1-2mm’lik alan büyük olasılıkla O2 ve besin maddelerinin damarlardan difüze olabileceği maksimum mesafedir. Bu alanın ötesinde tümörler vaskülarizasyon olmadan büyüyemezler çünkü hipoksi p53’ü uyararak apoptozu tetikler.8 Anjiogenez malign davranışın önemli bir basamağıdır zira tümör hücreleri damarlara ulaşmaksızın özellikle uzak metastaz yapamazlar. Neovaskülarizasyon ile tümör içerisindeki vasküler alan artar ve bu da tümör hücrelerinin dolaşıma ulaşma ihtimalini artırır. Anjiogenezin tümörlerin çoğalmasındaki etkisi; O2 ve besin maddeleri taşımak ve yeni oluşan endotel hücrelerinin salgıladıkları büyüme faktörleri ile tümör büyümesini uyarmak şeklindedir.1,6,8 İmmünohistokimyasal yöntemler ile çeşitli antikorlar (faktörVIII, CD31, CD34, CD105) kullanarak damar yapıları gösterilebilir. Larinks kanserleri de dahil olmak üzere birçok tümörde anjiogenez ile metastaz arasındaki ilişki araştırılmıştır. Bu çalışmaların bazılarında metastaz, sağkalım süresi ile anjiogenez arasında pozitif korelasyon olduğu bildirilmiştir.1,2,5,6 Hücre proliferasyonu: Hücre proliferasyonu, mitoz sayımı, flow sitometri, timidin etiketleme indeksi veya immünohistokimyasal olarak hücre siklusu içerisinde yapılan proteinlerin (Ki-67, PCNA, siklinler vb.) incelenmesi 24 ile ölçülebilir. Yüksek proliferasyon hızına sahip tümörler daha kötü prognoz gösterirler.1 Ki-67 ilk olarak 1983’te Gerdes ve arkadaşları tarafından tanımlanmış, tonsil germinal merkez hücreleri, epitel bazal hücreleri ve intestinal epitelin kript hücreleri gibi prolifere hücrelerde gösterilmiştir. Ki-67; hücre siklusunun G0 fazı dışında tüm fazlarında bulunan nonhistone nükleer proteindir. 345 ve 395 kd ağırlığında 2 molekülden oluşur ve geni 10. kromozom üzerinde yer alır.5,6 İmmünohistokimya ile Ki-67 için pozitif nükleer boyanma hücre yüzdesi proliferatif fraksiyonu gösterir. Agresif tümörlerde bu oran yüksektir. Birçok sistem tümörlerinde (meme, akciğer, özofagus, böbrek ve prostat kanseri, malign melanom, nonhodgkin lenfoma, glial tümörler) yüksek Ki-67 oranı kötü prognostik faktör olarak gösterilmiştir.1 Larinks kanserlerinde de çok sayıda çalışmada Ki-67’nin histolojik grade, metastaz, rekürrens, radyoterapiye cevap ve sağkalım ile ilişkisi araştırılmış ve farklı sonuçlar elde edilmiştir.81,82,84 P53 p53, 17. kromozomun kısa kolu üzerinde bulunan bir gendir.8 p53 tümör baskılayıcı geni hücre siklusu, indüksiyonu ve apoptozdan sorumlu en az 6 ya da 7 genin transkripsiyonunu aktive eden 5 kilodalton (kd)’luk bir transkripsiyon faktörünü kodlar. Normal hücrelerde p53 proteini konsantrasyonu oldukça düşüktür. Ancak hücre DNA’sı ağır bir fiziksel ya da kimyasal mutajenik bir ajana maruz kaldığında p53 geninin ekspresyonu sonucu p53 protein konsantrasyonu artar. Bu proteinin p21 genini aktive etmesi sonucu p21 protein 25 miktarı artarak, ya siklin D kinaz proteinlerinin oluşumu baskılanır ya da PCNA aktivitesi baskılanarak DNA sentezi inhibe edilir. Böylece hücre bölünmesi G1 fazında durdurularak DNA’nın tamiri için zaman kazanılır. Belli bir süre içinde hasar onarılabilirse hücre siklusu tekrar normal olarak devam eder. Ancak DNA molekülündeki hasar onarılamayacak kadar fazla ise programlı ölüm olarak bilinen apoptoz gerçekleşir.1,8 p53 anomalisi, insanlarda görülen birçok tümörde sık rastlanan bir genetik değişikliktir. Larinks SHK’larında da p53’ün artmış immünekspresyonu %5080 oranında belirlenmiştir.77 p53’ün belirgin olarak kısa yaşam süresiyle ilişkili olduğu, p53 seviyesinde artma ile tümör proliferasyonunda hızlanma, malign davranış potansiyeli, erken tümör rekürrensi ve ikinci primer tümör gelişim riski ile ilişkili olabileceği bildirilmiştir. p53 birikiminin, büyük tümör boyutu ile ilişkili olduğu, yüksek gradeli karsinomlarda daha fazla p53 pozitif neoplastik hücre varlığı gösterilmiştir.80,81,91 Yine yapılan çalışmalarda p53 ile ileri evre (T3,T4;N+) tümörler arasında belirgin ilişki olduğu ileri sürülmüştür.78 Buna karşın p53 aktivasyonunun larinks SHK’ları için erken bir belirleyici olduğunu ancak güvenilir prognostik faktör olarak kullanılmaması gerektiğini ileri süren çalışmalar da mevcuttur.77 APOPTOZ Apoptoz, nekrozdan birçok özelliği ile farklı olan hücre ölüm mekanizmasıdır. Bu olay ilk kez 1842 yılında Vogt tarafından fark edilmiş olmakla beraber, 1950’lerin başlarında tam olarak tanımlanmıştır. Apoptoz terimi ise 1972 yılında İskoç araştırmacılar Kerr, Wyllie ve Currie tarafından kullanılmış ve canlı dokulardaki hücre azalmalarından sorumlu, yapısal olarak özgün bir hücre ölüm tipi şeklinde tanımlanmıştır.29 26 Nekroz patolojik bir ölüm şekli olmasına karşın apoptoz hem patolojik hem de fizyolojik şartlarda meydana gelebilir.29 *Apoptoz öncelikle doğru gelişim için gereklidir; - Fetus el ve ayak parmakları oluşumunda arada bulunan perdelerin yok olması, - Beyinde uygun sinaps bağlantılarının gerçekleşebilmesi için fazla hücrelerin eliminasyonu, - Deride keratinositlerin yüzeye doğru göç edip, epidermisin en üstteki tabakası olan stratum korneum’u oluşturmaları, - Barsak kriptlerindeki epitel hücrelerinin deskuamasyonu, - Menstruasyon sırasında endometriumun deskuamasyonu. *Apoptoz, organizmanın bütünlüğünü tehdit eden hücrelerin yok edilmesi için gereklidir; - Sitotoksik T lenfositler, virüsle enfekte hücrelerde apoptoz’a neden olurlar, - Timusta olgunlaşırken vücut doku ve komponentlerine karşı reaksiyon gösterebilecek olan otoreaktif T lenfositleri apoptoz ile ortadan kaldırılır. Apoptozdaki defektler lupus eritematozus ve romatoid artrit gibi otoimmün hastalıklara neden olur, - Hücre genomundaki hasar uygun embriyonik gelişimin engellenmesine ve doğumsal defektlere veya kanserleşmeye neden olur. Bu nedenle DNA hasarına uğrayan hücreler apoptoz ile ortadan kaldırılır. - Bazı epitelyal lezyonlarda ve kanser tiplerinde ise radyasyon ve kimyasalların kanser hücrelerinde apoptozu da mekanizmalarında rol oynar.29,31,32,47 27 tetikleme özellikleri etki İnsan vücudunda saatte ortalama 300 milyon hücre apoptoz ile yıkıma uğramaktadır. Yapım (mitoz) ve yıkım (apoptoz) arasında kontrollü bir denge vardır. Bu dengenin herhangi bir yönde bozulması birçok önemli hastalığın patogenezine katkıda bulunur. 29,31,44 (Tablo 3) Apoptoz oluşumunda başlıca 4 mekanizma vardır; 1- TNF-TNFR yolu 2- FAS(CD95)-FAS ligand yolu 3- Hücreiçi stres yolu 4- Granzim-perforin yolu FAS aracılı apoptoz FAS; Apo 1 (apoptoz 1) veya CD 95 olarak da adlandırılır. Ana fonksiyonu apoptozu tetiklemesidir. FAS proteini, molekül ağırlığı 45 kd olan tip 1 membran proteinidir ve tümör nekroz faktör (TNF) ailesine aittir. TNF reseptörleri (TNF-R1 ve TNF-R2), sinir büyüme faktörü (NGF) reseptörü ve CD 40 bu ailenin en önemli üyeleridir. TNF reseptör ailesi üyeleri, immün sistemin düzenlenmesinde önemli role sahiptirler.32,38,43 28 Tablo 3. Apoptoz düzenleyicileri ve ilişkili hastalıklar APOPTOZU İNHİBE EDENLER Fizyolojik inhibitörler Viral genler Farmakolojik ajanlar 1- Büyüme faktörleri 1- Adenovirüs E1B 1- Sistein proteaz inhibitörleri 2- Ekstraselüler matriks 2- Baculovirüs p35 2- PMA, Fenobarbitol 3- CD40 Ligand 3- Baculovirüs IAP 4- Nötral aminoasitler 4- Cowpox virüs crmA 5- Çinko 5- Epstein Barr virüs BHRF1 6- Androjenler 6- Afrika domuz ateşi virüsü LMW5HL 7- Östojen 7- Herpes virüs γ1 34.5 α hekzaklorosiklohekzen APOPTOZU AKTİVE EDENLER Fizyolojik aktivatörler Hasarla ilişkili nedenler Terapötik ajanlar Toksinler 1- TNF ailesi 1- Hipertermi 1- Kemoterapötik ilaçlar 1- Etanol FAS ligand 2- Viral enfeksiyon sisplatin, doksarubisin, 2- β amiloid TNF 3- Bakteriyel toksinler bleomisin, vinkristin, 2- TGF-β 4- Onkogenler; myc, rel, E1A sitozinarabinozid, 3- Nörotransmitterler; 5- Tümör süpresör genler; p53 metotreksat glutamat, dopamin, 6- Sitolitik T hücreleri 2- Gamma ışınları N metil D aspartat 7- Oksidanlar 3- UV ışınları 4- Kalsiyum peptidler 8- Serbest radikaller 5- Glukokortikoidler APOPTOZ İNHİBİSYONU APOPTOZ AKTİVASYONU İLE İLGİLİ PATOLOJİLER İLE İLGİLİ PATOLOJİLER 1- Kanser 1- AIDS Foliküler lenfomalar 2- Nörodejeneratif hastalıklar P53 mutasyonu ile ilişkili kanserler Alzheimer, Parkinson, ALS, Hormon ilişkili kanserler; Retinitis pigmentoza, Meme, prostat, over kanserleri Serebellar dejenerasyon 2- Otoimmün hastalıklar 3- Myelodisplastik sendromlar SLE, immün glomerülonefritler Aplastik anemi 3- Viral enfeksiyonlar 4- İskemi; Myokard infarktüsü, 4- Herpes virüs, pox virüs, adenovirüs stroke, reperfüzyon hasarı 5- Toksinlerin neden olduğu karaciğer hasarı; Alkol 29 FAS ve TNF-R1, 70 aminoasitten oluşan apoptoz sinyalini tetikleyebilecek enzimatik aktivitesi bulunan ve bu nedenle “death domain” (DD, ölüm alanı) olarak adlandırılan ortak bir intraselüler alanı paylaşırlar.29 DD benzeri bir diziliş üç proteinde daha bulunmuştur; DR3 (death reseptör 3), TRAIL reseptör (DR4) ve CAR 1.30 FAS, agonistik antikorların ya da doğal ligandının (FASL) bağlanmasıyla apoptotik sinyali iletir. FASL, cDNA’nın kodladığı molekül ağırlığı 40kd olan, TNFR ailesine ait, tip 2 membran proteinidir.32,37,38,39,43 FASL’nin metaloproteinazlar tarafından ayrılmış, aktif solubl formu da bulunmaktadır.34,35 FAS normal dokularda, lenfoid ve epitelyal hücrelerde eksprese olurken, FASL normal koşullarda aktive T-lenfositlerden, göz, testis, beyin gibi nonlenfoid organlardan eksprese olur.34,36,51,40 FAS geni insanlarda 10. kromozomun uzun kolunda, FASL geni ise 1. kromozomda lokalizedir.32 FAS’ın kendisinin enzimatik aktivitesi yoktur. Bu nedenle apoptotik sinyalin sitoplazmik FAS bağlayıcı proteinler ve/veya FAS modifikasyon yolu ile iletildiği düşünülmektedir. Kaspaz ailesi proteinleri, FAS ve TNFR-1’in ana ölüm yolunda bulunurlar. Kaspazların son ürünlerinin ayrılmasının hücrenin apoptotik değişimlerine yol açtığı düşünülmektedir.30 FAS ve TNFR-1, ligandlarıyla bağlandıklarında ölüm uyarısı almış olduklarından bir seri protein aktive olur. Öncelikle kendilerine doğal olarak bağlı bulunan DD (death domain), TRADD (TNFR-1 associated death domain) ve FADD (FAS associated death domain) ile etkileşime girerler. Bu ölüm bölgeleri ise prokaspaz 8’i aktifleştirerek kaspazların kaskad tarzında aktivasyonlarını başlatırlar. Hücre içinde ayrıca bu ölüm bölgelerini inhibe eden proteinler de bulunmaktadır.34,39 FAS aracılı apoptoz kaspaz inhibitörleri tarafından engellenebilir. Anti-apoptotik bir protein olan bcl-2, FAS aracılı apoptozu lenfositlerde değil ama hepatositlerde engeller.30 30 FAS sistemi B-lenfosit ve T-lenfosit gelişimi ve fonksiyonlarının düzenlenmesinde önemli rol oynar ; 30,32,38 1-Antijenle aktivasyondan sonra, T-lenfositleri FAS’a ek olarak FASL da eksprese ederler. Sonuç olarak solubl FASL, aktive T-lenfositlerini intihara sürükleme ya da birbirlerini öldürme yoluyla immün yanıt azaltılır.35,40 2-Aktive sitotoksik T-lenfositleri, FAS duyarlı hedef hücrelerde apoptoza yol açar.37 3-FASL ekspresyonu göz, testis ve beyin gibi dokuların transplant rejeksiyonundan korunmasında rol oynar. Bu bölgelerin aktive sitotoksik T-lenfositleri ve NK hücreleri tarafından zedelenmesini engelleyerek immün ayrıcalık sağlar.40 FAS ligand ekspresyonu ile tümörün korunması FAS aracılı apoptoza karşı hassas dokuların yok olmasını önlemek için, FASL ekspresyonunun sıkı bir şekilde kontrol edilmesi gerekir. Apoptoz reseptörü olan FAS’ın pek çok farklı dokuda niçin eksprese olduğu henüz tam olarak bilinmemektedir. FAS ekspresyon kaybının en ciddi sonuçları, hücrelerin FAS aracılı apoptoz yoluyla kendilerini ortadan kaldırmadan önce FASL eksprese etmesiyle ortaya çıkar. FASL’larıyla, FAS eksprese eden lenfositlere karşı saldırırlar ve normalde tümör hücrelerini öldürmesi beklenen Tlenfositleri, FAS aracılı apoptoz yoluyla ortadan kaldırılırlar. Böylece FASL eksprese eden tümör, immün ayrıcalıklı bir doku gibi davranır.39,58,66 31 Tümör hücreleri tarafından FASL ekspresyonu ve bunu takiben FAS eksprese eden aktive olmuş sitotoksik T-lenfositlerinin ölümü genel bir fenomen gibi görünmektedir. Bu durum, malign melanom gibi birçok solid tümörde izlenebilir.33 Bu olgularda melanom hücrelerinde FAS ekspresyonu olmaksızın, FASL solubl form şeklinde gösterilebilir.30,36 FASL yardımıyla immüniteden kaçış, primer ve metastatik kolon kanserlerindeki hücre dizilerinde de belirlenmiştir. Kolon kanseri hücre dizileri FASL eksprese ederek aktive T-lenfositlerinde apoptozu indükler. SW620 kolon kanser hücre dizisi FAS eksprese eder ama FAS aracılı apoptoza dirençlidir. Bu nedenle lenfositlerde FASL ekspresyonu tümör hücrelerine zarar veremez.36,58 Bu bulgulardan farklı olarak, FASL ekspresyonunun tümörün ortadan kalkmasına yol açtığını gösteren çalışmalar da mevcuttur. FASL cDNA yapıları ile transfekte edilen bazı FAS-negatif tümör hücre dizileri farelere enjekte edilmiştir. Transfekte olmamış kontrol tümör hücreleri ile karşılaştırıldıklarında, FASL eksprese eden tümör hücreleri nötrofil aracılı primer reddi takiben sitotoksik T-lenfositleri yoluyla bağışıklığa yol açarlar. İnfiltre nötrofillerin FAS-pozitif oldukları kanıtlanmış ve FASL eksprese eden tümör hücreleri tarafından neden öldürülmedikleri tam olarak anlaşılamamıştır. Benzer şekilde FASL, pankreatik beta hücrelerine genetik olarak transfer edildiğinde granülositik inflamatuar yanıtı uyardığı görülmüştür.30,39 Bazı lösemi ve lenfoma tiplerinde seruma solubl FASL salınır ve bu potansiyel olarak tüm FAS duyarlı dokular için zararlıdır. FASL pozitif hepatik metastatik tümörler, FAS eksprese eden hepatositlerde apoptozu indükler. Etkilenen hastalarda gözlenen sistemik doku zedelenmesi malign hücreler tarafından üretilen solubl FASL’a bağlı olabilir. Bu nedenle anti-FASL antikorları ya da matrix metaloproteinaz inhibitörleri (ki bunlar solubl FASL 32 oluşumunu engeller) bu tür yan etkilerin engellenmesinde yardımcı olabilir. Lösemi ve lenfomada FASL ekspresyonunun tümör hücrelerini sitotoksik Tlenfositlerine karşı koruyup korumadığı henüz tam olarak aydınlatılamamıştır.30,35 Alternatif tutunma yolu ile üretilen solubl FAS, FASL eksprese eden lökositlerin tümör hücrelerini öldürmesini engelleyebildiği gibi, solubl FAS’ın oluşturduğu sistemik doku hasarını da azaltabilir. Solubl FAS, FASL’a yarışmalı bağlandığından tümör oluşumunda 2 ayrı rol oynayabilir; FASL’ı inaktive ederek FAS duyarlı tümör hücresini apoptozdan korur ve tümör gelişmesine yol açar. Buna rağmen hastalarda dolaşımda solubl FAS azaldığı için sistemik doku zedelenmesi daha az olur.32,39,70 Diğer yandan solubl FAS, FASL’ı inaktive ettiğinden FAS dirençli ve FASL eksprese eden tümör hücreleri FAS duyarlı T-lenfositlerince ortadan kaldırılamaz. Sitotoksik T-lenfositleri hala tümör hücresini öldürme yeteneğine sahip ise Perforin/Granzym B yoluyla öldürebilir. Bu nedenle FASL eksprese eden tümörlerde solubl FAS bulunması yararlı olabilir.30 Tümörlerde p53 ve FAS-FASL aracılı apoptozun prognostik önemini araştırmaya yönelik çalışmaların sayısı giderek artmakta olup farklı tümörlerde değişik sonuçlar elde edilmektedir.49 Bu nedenle mevcut bilgilerin geliştirilebilmesi için daha fazla sayıda araştırmaya ihtiyaç duyulmaktadır. 33 MATERYAL VE METOD Çalışmamızda Şubat 2002- Temmuz 2006 tarihleri arasında Dr.Lütfi Kırdar Kartal Eğitim ve Araştırma Hastanesi 1. ve 2. Kulak-Burun-Boğaz Kliniklerinde larinks karsinomu nedeniyle opere edilerek Patoloji laboratuarımızda incelenen olgular değerlendirildi ve seçilen 53 olgu çalışma kapsamına alındı. Olgulara ait arşiv kayıtları ve tüm preparatlar (hazır lam ve parafin blok) yeniden gözden geçirilerek değerlendirildi. İmmünohistokimyasal inceleme için tümörlere ait en uygun parafin bloklar seçildi. Her olguda aşağıdaki parametreler incelendi; a- Tanı anındaki yaş: İstatistiksel olarak değerlendirildi. b- Tümör boyutu: Primer tümörün en büyük çapı tümör boyutu olarak ölçüldü ve istatistiksel olarak değerlendirildi. c- Histolojik grade: Keratinizasyon derecesi, pearl formasyonu, tümör hücreleri arasındaki interselüler köprülerin varlığı değerlendirilerek iyi, orta ve az diferansiye olarak sınıflandırıldı. d- Tümör lokalizasyonu: Olgular larinks’teki tümör yerleşim yerine göre 4 grupta incelendi; Supraglottik, Glottik, Subglottik ve Transglottik. e- Doku yanıtı: Tümör çevresi iltihabi ve desmoplazik yanıtlar sübjektif olarak zayıf, orta ve şiddetli şeklinde değerlendirildi. f- Vasküler/Lenfatik invazyon: Negatif ve Pozitif olarak değerlendirildi. 34 g- Perinöral invazyon: Negatif ve Pozitif olarak değerlendirildi. h- Tiroid kartilajı invazyonu: Negatif ve Pozitif olarak değerlendirildi. i- TNM sistemine göre : Primer tümör (T), Lenf nodu metastaz durumu (N) ve Patolojik evre değerlendirildi; T : T1 , T2 , T3 ve T4 N : Lenf nodu metastazı yok: Negatif , Lenf nodu metastazı var : Pozitif EVRE: evre 1, evre 2, evre 3 ve evre 4 İMMÜNOHİSTOKİMYASAL İNCELEME Tümörlerin 2-3μm’lik parafin kesitleri özel lamlara (Surgipath, x-tra adhesive) alınarak bir gece etüvde 37oC’de inkübe edildi. Kesitler 15 dakika süre ile xylene’de deparafinize edilip yine 15 dakika alkol’de bekletilerek dehidrate edildi. Antijeni açığa çıkarmak için kesitler 10mM sitratlı tampon (pH:6) çözeltisi içerisinde mikrodalga fırında 750Watt’da 4,5 dakika ve 160 Watt’da 3x4,5 dakika ısıtıldı. Daha sonra oda sıcaklığında 20 dakika soğumaya bırakıldı. Dokulardaki endojen peroksidaz aktivitesini ortadan kaldırmak için kesitlere %3’lük hidrojen peroksit damlatılarak 15 dakika bekletildi. Daha sonra sırasıyla, protein blok solüsyonu (TA-125-UB, Lab Vision Corp. Fremont CA, USA) ile 10 dakika, primer antikor*, sekonder antikor (TA-125-BN, Lab Vision Corp. Fremont CA, USA) ile 15 dakika ve streptavidin-HRP (TA-125HR, Lab Vision Corp. Fremont CA, USA) 35 ile 15 dakika işleme alındı. Kromojen olarak aminoetil karbazol (TA-125-HA, Lab Vision Corp. Fremont CA, USA) damlatılarak 10 dakika beklendi. Kesitler tüm işlemlerden sonra PBS ile yıkandı. Son olarak Mayer Hematoksilen ile kontrast boyama yapılıp su bazlı kapama materyali ile kapatıldı. *Primer antikor olarak ; CD95 (FAS) Ab-4 (Rabbit Polyclonal Antibody, Lab Vision Corp. Neomarkers, Fremont CA, USA. 60 dakika), FAS Ligand (Rabbit Polyclonal Antibody, Lab Vision Corp. Neomarkers, Fremont CA, USA. 60 dakika) ve P53 Ab-5 (Clone DO-7, Mouse monoclonal antibody, Lab Vision Corp. Neomarkers, Fremont CA, USA. 60 dakika) kullanıldı. Pozitif kontroller olarak FAS için tümör kesitlerindeki stromal lenfoplazmositer hücreler internal kontrol olarak, FASL için prostat kesitleri kullanıldı. İmmünohistokimyasal boyanmanın değerlendirilmesi İmmünohistokimyasal incelemede FAS pozitifliği hücre membranında ve intrasitoplazmik granüler, FASL pozitifliği membranöz ve sitoplazmik ve P53 ekspresyonu ise nükleer boyanma şeklinde izlendi. FAS ve FASL için boyanan neoplastik hücrelerin yüzdesi bulunarak gruplara ayrıldı: İmmünreaktivite; yok (1), %1-10 arasında (2), %11-25 arasında (3) ve %25’ten fazla (4). Boyanma şiddeti dikkate alınmadı. P53 için neoplastik hücrelerde boyanma şiddeti dikkate alınmaksızın, hücrelerin %5’inden fazlasında nükleer boyanma pozitif olarak değerlendirildi. 36 Değerlendirmeler Olympus Bx 50 ışık mikroskobunda 400x (40x objektif lens, 10x oküler lens, 0.15mm2 ) büyütme kullanılarak yapıldı. İstatistiksel analiz Çalışmada elde edilen bulguların istatistiksel analizleri için SPSS (Statistical Package for Social Sciences) for Windows 10.0 programı kullanıldı. Veriler değerlendirilirken tanımlayıcı istatistiksel metotların (Ortalama, Standart sapma) yanısıra niceliksel verilerin karşılaştırılmasında, normal dağılım göstermeyen parametrelerin ikiden fazla grup arası karşılaştırılmalarında Kruskal Wallis testi kullanıldı. Parametrelerin ikili grup karşılaştırılmalarında, parametreler normal dağılıma uygunluk gösterdiğinden Student t testi kullanıldı. Niteliksel verilerin karşılaştırmasında ise Ki-kare testi kullanıldı. Parametreler arasındaki ilişkilerin incelenmesinde Spearman’s Rho korelasyon testi kullanıldı. Sonuçlar %95’lik güven aralığında ve anlamlılık p<0.05 düzeyinde değerlendirildi. 37 BULGULAR Cinsiyet: Çalışma kapsamına alınan 53 hastanın 3’ü (%5.7) kadın, 50’si (%94.3) erkek’tir. Yaş: Olgular 35-76 yaşları arasında olup, yaş ortalaması 57.40±10.15’tir. Tümör çapı: 0.2cm ile 5.5cm arasında değişmekte olup ortalama tümör çapı 2.82±1.18cm’ dir. Histolojik grade: Tümörlerin 7’si (%13) iyi, 33’ü (%62) orta ve 13’ü (%25) kötü diferansiye idi. Tümör lokalizasyonu: Olguların 27’si (%51) supraglottik, 20’si (%37) glottik, 2’si (%4) subglottik ve 4’ü (%8) transglottik tümörlerden oluşmaktaydı. Tümör çevresi iltihabi yanıt: 18 (%34) olguda zayıf, 24 (%45) olguda orta ve 11 (%21) olguda şiddetli olarak değerlendirildi. Tümör çevresi desmoplazik yanıt: 27 (%51) olguda zayıf, 16(%30) olguda orta ve 10 (%19) olguda şiddetli olarak değerlendirildi. Vasküler/lenfatik invazyon: 16 (%30) olguda mevcut olup, 37 (%70) olguda saptanmadı. Perinöral invazyon: 29 (%55) olguda mevcut olup, 24 (%45) olguda görülmedi. 38 Kartilaj invazyonu: 13 (%24) olguda mevcut olup, 40 (%76) olguda saptanmadı. Primer tümör (T) kategorisi: 4 (%8) olgu T1, 10 (%19) olgu T2, 26 (%49) olgu T3, 13 (%24) olgu T4 olarak değerlendirildi. Boyun lenf nodları (N): Lenf nodu metastazı 17 (%32) olguda saptanırken, 36 (%68) olguda saptanmadı. 36 (%68) olgu N0, 7 (%13) olgu N1, 10 (%19) olgu N2 olarak değerlendirildi. Evre: Olguların 4 (%8)’ü evre 1, 10 (%19)’u evre 2, 20 (%38)’si evre 3 ve 19 (%35)’u evre 4 olarak değerlendirildi. FAS İmmünohistokimya intrasitoplazmik ile granüler pozitif boyanma FAS reaksiyonu membranöz ve şeklinde görüldü. Boyanma tümör hücrelerinde ve internal pozitif kontrol olarak stromal lenfoplazmositer hücrelerde izlendi. 17 (%33) olguda boyanma olmadı. 19 (%36) olguda %1-10, 11 (%20) olguda %11-25 ve 6 (%11) olguda %25’ten fazla boyanma görüldü. Tablo 4 : FAS ekspresyonu ile yaş ve tümör çapı ilişkisi FAS 1 2 3 4 Test ist.; (n=17) (n=19) (n=11) (n=6) p Ort±SD Medyan Ort±SD Yaş 56,94±9,50 56 Tümör çapı 2,58±1,18 2,5 Medyan Ort±SD Medyan Ort±SD Medyan 54,63±10,04 54 57,54±10,45 57 67,17±7,47 65,5 2,86±1,28 3,09±1,16 2,83±1,08 3 KW: Kruskal Wallis Testi 39 3,5 2,7 KW:6,473 p:0,091 KW:1,922 p:0,589 FAS ekspresyonu ile olguların yaş ortalamaları arasında anlamlılığa yakın olmakla birlikte istatistiksel olarak anlamlı bir farklılık bulunmadı (p>0.05). Anlamlı bir farklılık bulunmamakla birlikte; FAS ekspresyonu 4 olan olguların yaş ortalamalarının; diğer FAS seviyelerindeki olguların yaş ortalamalarından daha yüksek olduğu saptandı. FAS ekspresyonu ile olguların tümör çapı ortalamaları arasında istatistiksel olarak anlamlı bir farklılık bulunmadı (p>0.05). FAS boyanma oranı iyi diferansiye tümörlerde anlamlı olarak yüksek bulunmuştur (p<0.01). FAS (3) olan olgularda histolojik grade’in orta ve iyi olma oranı (% 90,9); diğer FAS seviyelerinde histolojik grade’in orta düzeyde olma oranlarından anlamlı şekilde yüksek bulundu. FAS (4) olan olgularda histolojik grade’in iyi olma oranı (% 83.3); diğer FAS düzeylerinde histolojik grade’in iyi olma oranlarından anlamlı şekilde yüksek idi. Ayrıca FAS (1) olan olguların az diferansiye olma oranı (%88,2) anlamlı şekilde yüksek bulundu. FAS ekspresyonu ile tümör lokalizasyonu, vasküler/lenfatik invazyon, perinöral invazyon, kartilaj invazyonu, iltihabi ve desmoplazik yanıt, tümör evresi, lenf nodu tutulumu ve evre arasında istatistiksel olarak anlamlı bir ilişki bulunamadı (p>0.05). 40 Tablo 5 : FAS ekspresyonu ile grade, lokalizasyon, vasküler/lenfatik inv., perinoral inv., kartilaj inv., iltihabi yanıt, desmoplazik yanıt, tümör evresi, lenf nodu tutulumu, ve evre ilişkisi FAS Test 1 2 3 4 ist.; (n=17) (n=19) (n=11) (n=6) p n % n % N % n % 88,2 8 42,1 1 9,1 Orta 1 5,9 11 57,9 6 54,5 1 16,7 1 5,9 - - 4 36,4 5 83,3 Glottik 4 23,5 10 52,6 2 18,2 4 66,7 Subglottik 1 5,9 - - 1 16,7 Az Histolojik Grade İyi Tümör Lokalizasyonu Vasküler/Lenfatik invazyon Perinoral invazyon Kartilaj invazyonu İltihabi Yanıt Desmoplazik Yanıt Tümör Evresi Lenf Nodu Tutulumu Evre 2 χ : Ki Kare Testi 15 - - - - Supraglottik 11 64,7 7 36,8 8 72,7 1 16,7 Transglottik 1 5,9 2 10,5 1 9,1 - 17,6 8 42,1 4 36,4 1 Pozitif 3 - 16,7 Negatif 14 82,4 11 57,9 7 63,6 5 83,3 Pozitif 11 64,7 12 63,2 5 45,5 1 16,7 Negatif 6 35,3 7 36,8 6 54,5 5 83,3 Pozitif 4 23,5 5 26,3 2 18,2 2 33,3 Negatif 13 76,5 14 73,7 9 81,8 4 66,7 Zayıf 4 23,5 9 47,4 3 27,3 2 33,3 Orta 10 58,8 7 36,8 6 54,5 1 16,7 Şiddetli 3 17,6 3 15,8 2 18,2 3 50,0 Zayıf 7 41,2 9 47,4 7 63,6 4 66,7 Orta 4 23,5 8 42,1 2 18,2 2 33,3 Şiddetli 6 35,3 2 10,5 2 18,2 - - Evre I 2 11,8 1 5,3 1 9,1 - - Evre II 3 17,6 4 21,1 1 9,1 2 33,3 Evre III 8 47,1 9 47,4 7 63,6 2 33,3 Evre IV 4 23,5 5 26,3 2 18,2 2 33,3 Pozitif 4 23,5 6 31,6 5 45,5 2 33,3 Negatif 13 76,5 13 68,4 6 54,5 4 66,7 Evre I 2 11,8 1 5,3 1 9,1 Evre II 3 17,6 4 21,1 1 9,1 2 33,3 Evre III 7 41,2 6 31,6 6 54,5 1 16,7 Evre IV 5 29,4 8 42,1 3 27,3 3 50,0 ** p<0.01 ileri düzeyde anlamlı 41 χ2:36,593 p:0,001** χ2:13,003 p:0,162 χ2:3,269 p:0,352 χ2:5,118 p:0,163 χ2:0,533 p:0,912 χ2:6,789 p:0,341 χ2:6,960 p:0,325 χ2:3,510 p:0,941 χ2:1,480 p:0,687 χ2:5,042 p:0,831 100% 80% 60% 40% 20% 0% 1 2 3 4 FAS Az Histolojik Orta İyi Şekil 1 : FAS ekspresyonuna göre histolojik grade dağılımı FAS Ligand İmmünohistokimya ile pozitif reaksiyon tümör hücrelerinde membranöz ve intrasitoplazmik boyanma şeklinde görüldü. 11 (%20) olguda boyanma izlenmezken, 19 (%36) olguda %1-10, 16 (%32) olguda %11-25 ve 7 (%12) olguda da %25’ten fazla boyanma izlendi. Tablo 6 : FASL ekspresyonu ile yaş ve tümör çapı ilişkisi FASL 1 2 3 4 Test ist.; (n=11) (n=19) (n=16) (n=7) p Ort±SD Medyan Ort±SD Yaş 57,45±12,13 56 Tümör çapı 2,36±1,04 2 Medyan Ort±SD Medyan Ort±SD Medyan 55,31±7,96 55 57,69±10,19 54 62,28±12,47 69 2,55±1,30 3,32±1,02 3,10±1,13 2,5 KW: Kruskal Wallis Testi 42 3,2 3 KW:2,884 p:0,410 KW:4,886 p:0,182 FASL ekspresyonu ile olguların yaş ortalamaları ve tümör boyutları arasında istatistiksel olarak anlamlı bir farklılık gösterilemedi (p>0.05). FASL ekspresyonu ile histolojik grade sınıflaması arasında anlamlılığa yakın olmakla birlikte istatistiksel olarak anlamlı bir ilişki bulunamamıştır (p>0.05). Ancak düşük seviyede FASL ekspresyonu olan olgularda histolojik grade’in az olma oranının (% 42.1); diğer FASL düzeylerinde histolojik grade’in az olma oranlarından daha düşük olduğu ve FASL (4) olan olgularda histolojik grade’in iyi olma oranının (% 42.9) diğer FASL düzeylerinde histolojik grade’in iyi olma oranlarından daha yüksek olduğu saptandı. FASL ile tümör lokalizasyonu, vasküler/lenfatik invazyon, kartilaj invazyonu, desmoplazik yanıt, tümör evresi, lenf nodu tutulumu ve evre arasında istatistiksel olarak anlamlı bir ilişki bulunmadı (p>0.05). FASL ile perinöral invazyon arasında anlamlılığa yakın olmakla birlikte istatistiksel olarak anlamlı bir ilişki saptanmadı (p>0.05). Anlamlı bir ilişki bulunmamakla birlikte FASL (4) olan olgularda perinöral invazyon pozitifliği oranının (% 14.3); diğer FASL düzeylerinde görülen pozitiflik oranlarından daha düşük olduğu saptandı. FASL ile iltihabi yanıt arasında anlamlılığa yakın olmakla birlikte istatistiksel olarak anlamlı bir ilişki bulunamadı (p>0.05). Anlamlı bir ilişki bulunmamakla birlikte FASL (3) olan olgularda orta düzeyde iltihabi yanıt görülme oranının (% 25), diğer FASL seviyelerinde orta düzeyde iltihabi yanıt görülme oranlarından daha düşük olduğu ve FASL (2) olan olgularda da şiddetli düzeyde iltihabi yanıt görülme oranının (% 5.3), diğer FASL sınıflarında şiddetli düzeyde iltihabi yanıt görülme oranlarından daha düşük olduğu saptandı. 43 Tablo 7 : FASL ekspresyonu ile grade, lokalizasyon, vasküler/lenfatik inv., perinoral inv., kartilaj inv., iltihabi yanıt, desmoplazik yanıt, tümör evresi, lenf nodu tutulumu, ve evre ilişkisi FASL 1 2 3 4 (n=17) (n=19) (n=11) (n=6) N % n N n 2 18,2 8 42,1 2 12,5 1 14,3 72,7 11 57,9 11 68,8 3 42,9 1 9,1 - 3 18,8 3 42,9 Glottik 5 45,5 8 42,1 4 25,0 3 42,9 Subglottik - - - 6,3 1 14,3 χ2:6,254 p:0,714 Az Histolojik Grade Orta 8 İyi Tümör Lokalizasyonu - % 1 % Test ist.; p % Supraglottik 5 45,5 10 52,6 10 62,5 2 28,6 Transglottik 1 9,1 5,3 6,3 1 14,3 1 1 χ2:12,282 p:0,056 Vasküler/Lenfatik Pozitif 2 18,2 6 31,6 7 43,8 1 14,3 χ2:3,006 invazyon Negatif 9 81,8 13 68,4 9 56,2 6 85,7 p:0,391 Pozitif 5 45,5 13 68,4 10 62,5 1 14,3 χ2:6,830 Negatif 6 54,5 6 31,6 6 37,5 6 85,7 p:0,078 Pozitif 3 27,3 3 15,8 47 25,0 3 42,9 χ2:2,101 Negatif 8 72,7 16 84,2 12 75,0 4 57,1 p:0,552 Zayıf 3 27,3 9 47,4 6 37,5 - - Orta 6 54,5 9 47,4 4 25,0 5 71,4 Şiddetli 2 18,2 1 5,2 6 37,5 2 28,6 Zayıf 7 63,6 6 31,6 9 56,3 5 71,4 Orta 3 27,3 8 42,1 4 25,0 1 14,3 Şiddetli 1 9,1 5 26,3 3 18,8 1 14,3 Evre I 1 9,1 2 10,5 - - 1 14,3 Evre II 3 27,3 2 10,5 4 25,0 1 14,3 χ2:6,715 Evre III 4 36,4 12 63,2 8 50,0 2 28,6 p:0,667 Evre IV 3 27,3 3 15,8 4 25,0 3 42,9 Pozitif 2 18,2 6 31,6 8 50,0 1 14,3 χ2:4,353 Negatif 9 81,8 13 68,4 8 50,0 6 85,7 p:0,226 Evre I 1 9,1 2 10,5 - - 1 14,3 Evre II 3 27,3 2 10,5 4 25,0 1 14,3 χ2:4,900 Evre III 4 36,4 9 47,4 5 31,3 2 28,6 p:0,843 Evre IV 3 27,3 6 31,6 7 43,7 3 42,8 Perinoral invazyon Kartilaj invazyonu İltihabi Yanıt Desmoplazik Yanıt Tümör Evresi Lenf Nodu Tutulumu Evre 2 χ : Ki Kare Testi 44 χ2:10,924 p:0,091 χ2:5,259 p:0,511 P53 İmmünohistokimyasal inceleme ile tümör hücrelerinde nükleer boyanma şeklinde görüldü. 32 (%60) olguda pozitif boyanma saptanırken, 21 (%40) olguda ise boyanma görülmedi. Tablo 8 : P53 ekspresyonu ile yaş ve tümör çapı ilişkisi P53 Yaş Pozitif Negatif (n=32) (n=21) Ort±SD Ort±SD 57,50±8,72 57,24±12,24 Tümör çapı 3,17±1,21 t: Student t Testi Test ist.; p t:0,085 p:0,933 t:2,875 2,27±0,92 p:0,006** ** p<0.01 ileri düzeyde anlamlı P53 pozitifliğine göre olguların yaş ortalamaları arasında istatistiksel olarak anlamlı bir farklılık bulunmadı (p>0.05). P53 pozitif olan olguların tümör çapı ortalamalarının, P53’ü negatif olan olguların tümör çapı ortalamalarından istatistiksel olarak ileri düzeyde anlamlı olarak yüksek olduğu saptandı (p<0.01). 45 3,5 3 2,5 2 1,5 1 0,5 0 Pozitif Negatif P53 Tümör çapı Şekil 2 : P53 pozitifliğine göre tümör çapı dağılımı P53 ekspresyonu ile histolojik grade, vasküler/lenfatik invazyon, perinöral invazyon, kartilaj invazyonu, iltihabi ve desmoplazik yanıt, tümör evresi, lenf nodu tutulumu ve evre arasında istatistiksel olarak anlamlı bir ilişki saptanmadı (p>0.05). P53 pozitifliği ile tümör lokalizasyonu arasında anlamlılığa yakın olmakla birlikte istatistiksel olarak anlamlı bir ilişki bulunamadı (p>0.05). Bununla birlikte P53 pozitif olan olgularda glottik lokalizasyon görülme oranının (% 25), P53 negatif olan olgulardan daha düşük olduğu ve supraglottik (% 59.4) ve transglottik (% 12.5) lokalizasyon görülme oranlarının P53 negatif olgulardan daha yüksek olduğu saptandı. 46 Tablo 9 : P53 ekspresyonu ile grade, lokalizasyon, vasküler/lenfatik inv., perinoral inv., kartilaj inv., iltihabi yanıt, desmoplazik yanıt, tümör evresi, lenf nodu tutulumu ve evre ilişkisi P53 Lokalizasyonu (n=32) (n=21) Test ist.; p % n % 9 28,1 4 19,0 62,5 13 61,9 3 9,4 4 19,0 Glottik 8 25,0 12 57,1 Subglottik 1 3,1 1 4,8 χ2:7,313 Supraglottik 19 59,4 8 38,1 p:0,063 Transglottik 4 12,5 - - Orta 20 İyi Tümör Negatif N Az Histolojik Grade Pozitif χ2:1,325 p:0,516 Vasküler/Lenfatik Pozitif 11 34,4 5 23,8 χ2:0,672 invazyon Negatif 21 65,6 16 76,2 p:0,412 Pozitif 18 56,3 11 52,4 χ2:0,077 Negatif 14 43,7 10 47,6 p:0,782 Pozitif 9 28,1 4 19,0 χ2:0,564 Negatif 23 71,9 17 81,0 p:0,453 Zayıf 11 34,4 7 33,3 Orta 15 46,9 9 42,9 Şiddetli 6 18,8 5 23,8 Zayıf 18 56,3 9 42,9 Orta 9 28,1 7 33,3 Şiddetli 5 15,6 5 23,8 Evre I 2 6,3 2 9,5 Evre II 4 12,5 6 28,6 χ2:2,614 Evre III 17 53,1 9 42,9 p:0,455 Evre IV 9 28,1 4 19,0 Pozitif 12 37,5 5 23,8 χ2:1,091 Negatif 20 62,5 16 76,2 p:0,296 Evre I 2 6,3 2 9,5 Evre II 4 12,5 6 28,6 χ2:2,608 Evre III 13 40,6 7 33,3 p:0,456 Evre IV 13 40,6 6 28,6 Perinoral invazyon Kartilaj invazyonu İltihabi Yanıt Desmoplazik Yanıt Tümör Evresi Lenf Nodu Tutulumu Evre 2 χ : Ki Kare Testi 47 χ2:0,206 p:0,902 χ2:1,011 p:0,603 FAS, FAS Ligand ve P53 arasındaki ilişki Tablo 10 : FAS-FASL-P53 ilişkisi r p FAS – P53 -1,534 0,131 FASL - P53 -0,087 0,536 FAS – FASL 0,349 0,010* r: Spearman’s rho korelasyon testi * p<0.05 düzeyinde anlamlı FAS ile P53 arasında istatistiksel olarak anlamlı bir korelasyon bulunmadı (p>0.05). FASL ile P53 arasında istatistiksel olarak anlamlı bir ilişki bulunmadı (p>0.05). FAS ile FASL arasında pozitif yönde; % 34.9 düzeyinde ve istatistiksel olarak ileri düzeyde anlamlı bir korelasyon olduğu saptandı (p<0.05). 4,5 4,0 3,5 3,0 2,5 2,0 F A S L 1,5 1,0 ,5 ,5 1,0 1,5 2,0 2,5 3,0 FAS Şekil 3 : FAS ile FASL korelasyonu 48 3,5 4,0 4,5 Tablo 11 : Larinks SHK’larında klinikopatolojik parametreler ve FAS, FASL ve P53 ekspresyonu ÇAP OLGU YAŞ CİNS. (CM) GRADE LOKALİZ. VASK/ LENF.İNV. PN.İNV. KART.İNV İLT.YANIT DESMOPL. T LENF NODU EVRE FAS FASL P53 1 70 E 4.5 İYİ SUBGLOT. POZİTİF NEGATİF POZİTİF ŞİDDETLİ ZAYIF 4 NEGATİF 4 4 4 POZİTİF 2 76 E 2.5 İYİ GLOTTİK NEGATİF POZİTİF ŞİDDETLİ ORTA 4 NEGATİF 4 4 3 NEGATİF 3 56 E 0.3 İYİ GLOTTİK NEGATİF NEGATİF NEGATİF ZAYIF ZAYIF 1 NEGATİF 1 1 1 NEGATİF 4 65 E 2 İYİ GLOTTİK NEGATİF NEGATİF NEGATİF ZAYIF ZAYIF 2 NEGATİF 2 4 3 NEGATİF 5 54 E 1.5 İYİ GLOTTİK NEGATİF NEGATİF NEGATİF ŞİDDETLİ ZAYIF 2 NEGATİF 2 4 4 POZİTİF 6 54 E 4 İYİ SUPRAGL. POZİTİF NEGATİF NEGATİF ZAYIF ZAYIF 3 POZİTİF 3 3 3 POZİTİF 7 71 E 3 İYİ GLOTTİK NEGATİF NEGATİF ORTA ZAYIF 3 POZİTİF 3 4 4 NEGATİF 8 55 E 3.4 AZ SUPRAGL. POZİTİF POZİTİF POZİTİF ORTA 4 POZİTİF 4 2 2 POZİTİF 9 63 E 4 AZ SUPRAGL. NEGATİF POZİTİF NEGATİF ZAYIF ŞİDDETLİ 3 NEGATİF 3 1 2 POZİTİF 10 45 E 1.1 AZ GLOTTİK NEGATİF POZİTİF NEGATİF ZAYIF ŞİDDETLİ 2 NEGATİF 2 2 2 NEGATİF 11 54 E 1.7 AZ GLOTTİK NEGATİF POZİTİF NEGATİF ŞİDDETLİ ORTA 2 NEGATİF 2 2 3 NEGATİF 12 35 E 3 AZ SUPRAGL. POZİTİF POZİTİF NEGATİF ZAYIF ZAYIF 3 NEGATİF 3 2 1 NEGATİF 13 55 E 1.7 AZ SUPRAGL. NEGATİF NEGATİF NEGATİF ZAYIF ORTA 2 NEGATİF 2 2 2 POZİTİF 14 42 E 3.8 AZ SUPRAGL. POZİTİF NEGATİF NEGATİF ORTA ZAYIF 3 POZİTİF 4 3 2 POZİTİF 15 57 E 4 AZ SUPRAGL. NEGATİF POZİTİF ŞİDDETLİ 3 POZİTİF 3 3 2 POZİTİF 16 67 E 2 AZ GLOTTİK NEGATİF POZİTİF ŞİDDETLİ 4 POZİTİF 4 2 1 POZİTİF 17 52 E 2 AZ SUPRAGL. NEGATİF NEGATİF NEGATİF ORTA ORTA 3 NEGATİF 3 3 2 NEGATİF 18 56 E 4 AZ TRANSGL. POZİTİF POZİTİF ZAYIF 3 POZİTİF 4 2 2 POZİTİF 19 72 E 4.5 AZ GLOTTİK NEGATİF NEGATİF POZİTİF ZAYIF 4 NEGATİF 4 2 4 POZİTİF 20 46 E 4 AZ SUPRAGL. NEGATİF POZİTİF NEGATİF ŞİDDETLİ ZAYIF 3 NEGATİF 3 3 3 POZİTİF 21 62 E 2.5 ORTA SUPRAGL. POZİTİF POZİTİF NEGATİF ORTA ZAYIF 3 POZİTİF 3 3 2 POZİTİF 22 61 E 3.5 ORTA SUPRAGL. NEGATİF NEGATİF POZİTİF ŞİDDETLİ ZAYIF 4 POZİTİF 4 3 3 POZİTİF 23 54 E 3 ORTA SUPRAGL. NEGATİF POZİTİF NEGATİF ORTA ŞİDDETLİ 3 NEGATİF 3 1 2 POZİTİF 24 52 E 3 ORTA GLOTTİK NEGATİF POZİTİF NEGATİF ORTA ORTA 3 NEGATİF 3 2 2 POZİTİF 25 38 E 2 ORTA GLOTTİK NEGATİF POZİTİF POZİTİF ŞİDDETLİ ŞİDDETLİ 4 NEGATİF 4 1 2 NEGATİF 26 66 E 3 ORTA SUPRAGL. NEGATİF NEGATİF NEGATİF ORTA 27 48 E 2 ORTA SUPRAGL. NEGATİF 28 69 E 3.2 ORTA TRANSGL. 29 67 E 3.5 ORTA GLOTTİK 30 52 E 5 ORTA 31 47 E 2 ORTA 32 49 E 1.2 33 62 E 1.5 34 50 E 2 ORTA NEGATİF POZİTİF POZİTİF ZAYIF NEGATİF ORTA ORTA NEGATİF ZAYIF ORTA ORTA 2 NEGATİF 2 1 1 POZİTİF NEGATİF POZİTİF ŞİDDETLİ ORTA 4 POZİTİF 4 1 1 POZİTİF NEGATİF POZİTİF ORTA ŞİDDETLİ 4 NEGATİF 4 1 4 POZİTİF NEGATİF NEGATİF NEGATİF ORTA ZAYIF 2 NEGATİF 2 1 1 NEGATİF SUPRAGL. NEGATİF POZİTİF NEGATİF ORTA ZAYIF 3 NEGATİF 3 1 3 POZİTİF SUPRAGL. NEGATİF POZİTİF NEGATİF ORTA ZAYIF 3 NEGATİF 3 1 1 NEGATİF ORTA SUPRAGL. NEGATİF POZİTİF NEGATİF ORTA ZAYIF 3 NEGATİF 3 1 2 POZİTİF ORTA GLOTTİK POZİTİF NEGATİF ORTA ORTA 1 NEGATİF 1 2 2 POZİTİF SUPRAGL. NEGATİF NEGATİF NEGATİF ZAYIF ZAYIF 3 NEGATİF 3 1 1 NEGATİF NEGATİF POZİTİF 35 68 K 1.5 ORTA SUPRAGL. NEGATİF NEGATİF NEGATİF ZAYIF ZAYIF 3 NEGATİF 3 2 2 POZİTİF 36 71 E 1.2 ORTA GLOTTİK POZİTİF NEGATİF ORTA ORTA 2 NEGATİF 2 1 1 NEGATİF 37 62 E 2 ORTA SUPRAGL. NEGATİF NEGATİF NEGATİF ORTA ORTA 1 NEGATİF 1 1 4 NEGATİF 38 38 E 3 ORTA SUPRAGL. NEGATİF NEGATİF NEGATİF ORTA ZAYIF 3 NEGATİF 3 2 4 POZİTİF 39 67 E 4 ORTA SUPRAGL. POZİTİF POZİTİF NEGATİF ORTA ZAYIF 3 POZİTİF 4 1 3 NEGATİF 40 60 E 2.5 ORTA SUBGLOT. POZİTİF POZİTİF POZİTİF ŞİDDETLİ 4 POZİTİF 4 1 3 NEGATİF 41 52 E 3.5 ORTA GLOTTİK POZİTİF NEGATİF ŞİDDETLİ ZAYIF NEGATİF 3 2 1 NEGATİF NEGATİF NEGATİF ZAYIF 3 42 49 E 3 ORTA SUPRAGL. POZİTİF POZİTİF NEGATİF ŞİDDETLİ ŞİDDETLİ 3 POZİTİF 3 1 3 NEGATİF 43 53 E 3 ORTA SUPRAGL. NEGATİF POZİTİF NEGATİF ŞİDDETLİ ZAYIF 2 NEGATİF 2 2 3 POZİTİF 44 73 E 3.5 ORTA TRANSGL. NEGATİF POZİTİF POZİTİF ORTA ZAYIF 4 NEGATİF 4 3 1 POZİTİF 45 51 E 5.5 ORTA TRANSGL. POZİTİF POZİTİF POZİTİF ZAYIF ZAYIF 4 POZİTİF 4 2 3 POZİTİF 46 76 E 3 ORTA GLOTTİK NEGATİF NEGATİF NEGATİF ORTA ŞİDDETLİ 2 NEGATİF 2 3 3 NEGATİF 47 60 K 4 ORTA GLOTTİK POZİTİF POZİTİF NEGATİF ZAYIF ZAYIF 3 POZİTİF 4 2 2 POZİTİF 48 54 E 4.5 ORTA GLOTTİK POZİTİF POZİTİF NEGATİF ORTA ORTA 3 NEGATİF 3 2 2 POZİTİF 49 60 E 0.2 ORTA GLOTTİK NEGATİF NEGATİF NEGATİF ZAYIF ORTA 1 NEGATİF 1 3 2 POZİTİF 50 67 E 1 ORTA GLOTTİK NEGATİF NEGATİF POZİTİF ZAYIF ORTA 4 NEGATİF 4 2 2 NEGATİF 51 67 K 3.5 ORTA SUPRAGL. NEGATİF NEGATİF NEGATİF ZAYIF ORTA 3 POZİTİF 4 4 3 POZİTİF 52 42 E 2.5 ORTA SUPRAGL. POZİTİF NEGATİF NEGATİF ORTA ORTA 3 POZİTİF 4 2 3 NEGATİF 53 50 E 3.5 ORTA SUPRAGL. POZİTİF POZİTİF ZAYIF 3 NEGATİF 3 3 3 POZİTİF NEGATİF ZAYIF 49 TARTIŞMA Larinks kanserleri, baş-boyun bölgesinin en sık görülen, uygun tanı ve tedavi metodları ile uzun yaşam süreleri elde edilebilen kanserlerdir.4,7,9 Bu tümörlerin büyük çoğunluğu skuamöz hücreli karsinomlar (SHK) olup bunun yanında küçük hücreli, indiferansiye, adenoid kistik ve mukoepidermoid gibi diğer histolojik tipler de görülebilir.9,25,26 Glottik tümörler genel olarak en sık görülen lokalizasyon olarak bilinmekle birlikte ülkemizde ve son yıllarda Avrupa ülkelerinde supraglottik tümörlerin daha sık görüldüğü şeklinde bildiriler yapılmaktadır. 9,10,11 Bizim çalışmamızda da supraglottik tümörler (%51) en sık görülen tümör lokalizasyonu şeklinde bulunmuştur. Genel olarak tedavi planlamada ve prognoz belirlemede en güvenilir parametreler TNM sınıflaması ile saptanabilir. Bunlar içinde lenf nodu metastazı kabul edilen en önemli parametredir. Ayrıca tümör evresi, tümör lokalizasyonu, ülserasyon ve histolojik diferansiyasyon derecesi de prognoz belirlemede bilinen diğer önemli faktörlerdir.10,25,26,27,28 Ancak tüm bu parametreler göz önüne alındığında ve aynı tedavi yöntemleri uygulandığında bile hastalar arasında tedaviye cevap, rekürrensler, tümör davranışı ve genel prognoz açısından önemli farklılıklar olduğu gözlenmektedir. Bu durum prognozu etkileyen başka faktörlerin bulunduğu düşüncesini ortaya çıkarmaktadır. Son yıllarda bunlar arasında özellikle hücre siklusu, proliferasyon ve apoptoz’u inceleyen genetik moleküler faktörler çok sayıda araştırmacı tarafından ön planda tutulmaktadır. 50 Apoptoz ve hücre proliferasyonu arasındaki dengenin bozulması, tümörlerin gelişiminde ve ilerlemesinde önemli rol oynamaktadır.32,44,53,90 Apoptozu kontrol eden ve başlatan moleküllerin başında Fas ve Fas-ligand (FasL) reseptör-ligand ikilisi gelir.30,34,35 Fas-FasL ekspresyonlarının otoimmün hastalıklarda, bazı tümörlerde ve transplant rejeksiyonlarının önlenmesinde rol oynayabileceği ve daha gelişmiş tedavi yöntemleri için bir basamak olabileceği düşünülmektedir.30,41,42,59 P53 insanlarda görülen kanserlerde en sık mutasyona uğrayan gendir. Tümör supresör özellikleri olan bu gene ait fonksiyonel bozukluklar baş-boyun kanserlerinin oluşumunda ve klinik seyrinde önemli rol oynar.73,77,80 Literatürde larinks kanserlerinde Fas-FasL ve p53 için ayrı ayrı prognostik faktörler ile ilişkilerini araştıran çalışmalar mevcuttur. Ancak bu çalışmalarda çeşitli değişik sonuçlar elde edilmiş olup tam fikir birliği oluşmamıştır. Ayrıca p53 ve Fas-FasL ekspresyonlarını beraber inceleyen bir çalışma karaciğer tümörlerinde bulunmakla birlikte larinks kanserleri için literatürde benzer türde fazla sayıda çalışma bulunmamaktadır.50 Çalışmamızda Fas ile FasL arasında normal koşullarda beklendiği üzere istatistiksel olarak anlamlı bir ilişki saptandı. Bu reseptör-ligand çifti tümör nekroz faktörü ailesine ait olup kendilerini taşıyan hücrelerde apoptoz indükleyicisi olarak etki gösterirler.30,31,32 Çeşitli hücreler Fas eksprese edebilirken FasL temel olarak aktive T lenfositlerde bulunur. İmmün sistem içinde çeşitli dokulara tolerans oluşturulması amacıyla immün reaksiyonların sınırlandırılması ve T hücre aracılı sitotoksisite Fas-FasL sisteminin rol oynadığı başlıca durumlardır.32,40 Ayrıca literatürde Fas-FasL eksprese eden tümörlerin bunu tümöre karşı gelişmesi beklenen immün yanıttan kaçış için kullandığı, konağın immün yanıt derecesini azaltarak tümör progresyonuna 51 neden olduğu bildirilmiştir.35,36,38 Bu yönüyle çalışmamızda elde ettiğimiz Fas ile FasL arasındaki anlamlı istatistiksel ilişki literatür ile uyumlu bulunmuştur. Jackel ve arkadaşlarının çalışmasında larinks SHK’larında Fas-FasL ekspresyonu, iyi diferansiye tümörlerde yüksek oranda izlenirken az diferansiye tümörlerde izlenmemektedir.45 Bu çalışmada da buna benzer şekilde Fas-FasL ekspresyonu iyi diferansiye tümörlerde anlamlı şekilde yüksek, az diferansiye tümörlerde ise düşük bulunmuştur. Buna karşın Bayazıt ve arkadaşları ve Batur’un çalışmalarında Fas-FasL ile histolojik grade arasında bir ilişki gösterilmemiştir.46,91 Ancak literatürde özofagus, meme, tiroid ve oral mukoza kanserlerinde histolojik grade ile Fas-FasL ilişkisini gösteren çok sayıda çalışma mevcuttur. Buna göre iyi diferansiye tümörlerde belirgin Fas-FasL ekspresyonu izlenirken, az diferansiye tümörlerde Fas-FasL ekspresyonu zayıf olarak izlenmekte ya da hiç izlenmemektedir.52,55,57,63,64,69 Az diferansiye tümörler, iyi diferansiye tümörlere oranla daha hızlı büyürler ve daha agresif seyir gösterirler. Tümör hücrelerinde artmış Fas-FasL ekspresyonu, apoptozun da artması anlamına gelir. İyi diferansiye tümörlerde gözlenen belirgin Fas-FasL ekspresyonu, tümör hücrelerinde apoptozun artmasına yol açarak tümörün progresyonunu yavaşlatmaktadır.48 Renal hücreli karsinomlarda ise farklı olarak nükleer grade arttıkça Fas-FasL ekspresyonunun arttığı saptanmıştır.67 Bu durum, bazı az diferansiye tümörlerde tümör hücrelerinde spontan apoptoz görülebilmesiyle açıklanabilir.44 Literatürde tümör hücrelerinde Fas-FasL ekspresyonu ile hasta yaşı arasında anlamlı ilişki bildiren çalışma bulunmamaktadır.55,62,68,69,71 Bizim çalışmamızda da hasta yaşı ile Fas-FasL ekspresyonu arasında istatistiksel anlamlı bir ilişki bulunamamıştır. Ancak yüksek oranda Fas-FasL eksprese eden olguların ortalama yaşları anlamlılığa yakın olarak Fas-FasL ekspresyonu düşük 52 olan olgulara göre daha yüksek olması bu konuda daha fazla araştırmaya ihtiyaç olduğunu düşündürmektedir. Tümör çapı ile Fas-FasL ekspresyonunu karşılaştıran bazı araştırmacılar iki parametre arasında zıt yönde korelasyon bulunduğunu bildirmişlerdir. Buna göre tümör çapı arttıkça Fas-FasL ekspresyonu azalmaktadır.48,68 Buna karşın Bayazıt ve arkadaşları46 larinks SHK’larında tümör çapı ile Fas-FasL ekspresyonu arasında ilişki bulamamışlardır. Bu çalışmada da bununla uyumlu olarak bu iki parametre arasında anlamlı ilişki saptanmamıştır. Ayrıca diğer bazı organ tümörlerinde de Fas-FasL ekspresyonu ile tümör boyutu arasında ilişki gösterilememiştir.55,67,69,71 Larinks SHK’larında da özofagus ve oral mukoza SHK’larında olduğu gibi Fas-FasL ekspresyonu ile lenf nodu metastazı arasında ilişki gösterilememiştir.54,55,46,48 Bizim çalışmamızda da lenf nodu metastazı ile FasFasL ekspresyonu arasında anlamlı bir ilişki bulunamamıştır. Akciğer ve meme kanserlerinde, lenf nodu metastazı saptanan olgularda primer tümörlerde FasFasL ekspresyonu izlenmemiş ancak metastaz olmayan olgularda belirgin FasFasL ekpresyonu varlığı dikkati çekmektedir.62,68 Tiroidin iyi diferansiye papiller karsinomu ve foliküler karsinomlarında lenf nodu metastazlarında Fas– FasL ekspresyonu artmış olarak izlenirken, az diferansiye tümörlerin lenf nodu metastazlarında Fas-FasL ekspresyonu azalmış olarak bulunmuştur.64,65 Jackel ve arkadaşları45 Fas-FasL ekspresyonu ve stromal iltihabi yanıt arasındaki ilişkiyi inceledikleri çalışmada Fas-FasL ile iltihabi yanıt arasında pozitif korelasyon bulunduğunu bildirmişlerdir. Batur’un çalışmasında da benzer bir ilişki saptanmış olup hücre yüzeyinde Fas-FasL reseptörünün azalmasının iltihabi yanıtı azalttığı bildirilmiştir.91 Deneysel çalışmalarda, deney hayvanlarına enjekte edilen yüzeylerinde Fas reseptörü bulunan hücrelerin, T 53 lenfosit infiltrasyonunu uyardığı Fas içermeyen tümör hücrelerinin ise böyle bir yanıt oluşturmadığı gözlenmiştir. Mekanizma kesin olarak bilinmemekle birlikte Fas-FasL eksprese eden tümör hücrelerinin apoptoz ve fagositoza uğramalarının inflamatuar hücreler için kemotaktik ajanların salınımına yol açtığı ileri sürülmektedir.45 Bizim çalışmamızda ise Fas-FasL ile iltihabi yanıt arasında ve perinöral invazyon arasında istatistiksel olarak anlamlı olmamakla birlikte literatürdeki çalışmalara benzer şekilde pozitif bir korelasyon saptanmıştır. Bu çalışmada Fas-FasL ekspresyonu ile T kategorisi, evre ve lenfatik/vasküler invazyon arasında istatistiksel olarak anlamlı bir ilişki saptanmamıştır. Literatürde de gerek larinks karsinomlarında gerek diğer organ tümörlerinde Fas-FasL ile evre arasında ilişki bulunamamıştır.45,46,67 Oral mukoza ve akciğer SHK’larında da Fas-FasL ekspresyonu ile tümör evresi ve lenfatik/vasküler invazyon arasında ilişki gösterilememiştir.55,61,62,69 Çalışmamızda larinks SHK’larında Fas-FasL ekspresyonu ile tümör lokalizasyonu, tümör boyutu, dezmoplazik yanıt, kartilaj invazyonu arasında anlamlı ilişki saptanmadı. Bu parametreleri inceleyen sınırlı sayıda çalışmada da benzer sonuçlar bildirilmiştir.55,69,91 Tümör hücreleri Fas aracılı apoptozdan kaçmak için çeşitli stratejiler geliştirmişlerdir. Bunlar Fas ekspresyonunu azaltmak, Fas proteininin hücre membranı yerine sitoplazmada birikmesi, hücre içi Fas ileti yollarının inhibisyonu ve FasL ekspresyonu olarak sıralanabilir.33,45,56,57,60 Fas-FasL sisteminde ekspresyon veya fonksiyon kaybı, Fas geninde transkripsiyonel azalma, solubl Fas proteininin artması ile ya da bcl-2, bcl-xl, FAP-1 ve FLIP gibi Fas sinyal kaybına yol açan antiapoptotik proteinlerin ekspresyonu ile olabilir.33,39,44,72 54 Fas ekspresyon kaybı ve FasL ekspresyonu tümör gelişiminde ve ilerlemesinde önemlidir. Bazı araştırmacılar , Fas ekspresyon kaybının tümör progresyonunda sürmüşlerdir. FasL ekspresyonundan Deneysel çalışmalarda, daha Fas önemli ekspresyon olduğunu kaybının ileri tümör metastazını arttırdığı buna karşın yeniden Fas verilmesi ile lokal tümör büyümesinin ve metastazların azaldığı gösterilmiştir.39 Fas ekspresyon kaybı melanomalar, özofagus kanserleri, kolorektal kanserler, meme kanserleri, hepatoselüler karsinomlar, karsinomlar, tiroid karsinomları ve akciğer renal hücreli kanserlerinde gösterilmiştir.33,50,52,56,61,62,66,68,69 Fas pozitifliği özofagus, akciğer ve meme kanserlerinde iyi prognostik faktör olarak kabul edilmiş ve uzun sürvi ile ilişkili bulunmuştur.53,62,68,69 Bu çalışmada Fas-FasL reseptör-ligand çifti iyi diferansiye tümörlerde daha fazla eksprese olarak histolojik grade ile anlamlı şekilde ilişkili bulunmuştur. Ayrıca istatistiksel olarak anlamlılığa yakın bir şekilde stromal iltihabi yanıt ile ilişkili olduğu gösterilmiştir. Bu bulgular literatürdeki bildiriler ile kısmen uyumlu olarak kabul edilebilir.Ancak Fas-FasL çiftinin diğer klinikopatolojik parametrelerle korelasyon göstermemeleri nedeniyle bizim sonuçlarımıza göre güvenilir prognostik faktörler olmaları mümkün görünmemektedir. İnsanlarda p53 geni tümör supresör genler grubuna ait DNA hasarları ve diğer hücresel streslere cevap olarak hücre gelişimini durdurma ve apoptozu indükleme gibi görevleri olan nükleer bir fosfoproteindir.74,75,76 Normalde oldukça düşük konsantrasyonlarda bulunan bu protein mutasyona uğradığında stabilitesi artar ve hücre çekirdeğinde birikir ve immünekspresyonu belirgin hale gelir.77,80 55 Genetik materyalin bütünlüğü, hücre siklus proteinleri ve hücre canlılığında önemli yeri olan p53 bazı araştırmacılar tarafından “Genetik gardiyan” olarak adlandırılmıştır. Hücre genetik materyalinde kimyasal, hipoksik, radyoaktif, viral ya da selüler onkojenik kökenli bir hasar oluştuğunda hücre siklusunu G1 fazında durdurur ve onarım için zaman kazanılmasını sağlar. Ancak buna rağmen hasar onarılamaz ise bax ve Fas üzerinden apoptozu indükleyerek hücrenin ortadan kaldırılmasında rol oynar. Böylece genetik hasarlı hücrelerin kontrol ve imhasını gerçekleştirir. Normal hücrelerde p53 seviyesi hücre büyümesi ve canlılığının devamı için sıkı bir şekilde kontrol edilir ve 20 dakika gibi kısa bir yarılanma süresi vardır. Tümöral dokularda ise p53’ün genetik mutasyon (missence nokta mutasyon) ve bu genin aktivitesini kontrol eden mdm2 transkripsiyon faktörünün defektif olması sonucu stabilitesi artar ve birikmeye başlar.77 İnsanlarda görülen epitelyal kanserlerin çoğunda p53 mutasyonu rol oynar.77 Larinks’te kanserlerin dışında hiperplastik lezyonlarda, displazilerde ve erken invaziv lezyonlarda da ekspresyonunun arttığı bildirilmiştir.73,74,75,76 Çeşitli larinks karsinomu vaka serilerinde p53’ün genel ortalama ekspresyonu %51 ile %80 arasında değişen oranlarda verilmektedir. Bu çalışmalarda ayrıca p53’ün malign transformasyonun erken dönemlerinde etkin olduğu ancak tümör progresyonu, rekürrensler ve genel sürvi üzerinde fazla belirleyici rolünün olmadığı da öne sürülmektedir.77 Larinks SHK’larında p53’ün diğer parametreler ve sağkalım ile ilişkisini inceleyen çalışmalarda elde edilen sonuçlarda bir fikir birliği oluşmamıştır.88 Teppo ve arkadaşları79 larinks kanserlerinde p53, proliferasyon ve anjiyogenezi inceledikleri çalışmada p53’ün prognostik değeri olmadığını bildirmişlerdir. Jackel ve arkadaşları81 ‘nın çalışmasında ise p53 kısa sürvi ile ve büyük tümör 56 boyutu ile ilişkili bulunmuştur. Bizim çalışmamızda da p53 ekspresyonu ile tümör boyutu arasında istatistiksel olarak anlamlı ilişki bulunmuştur. P53 pozitif olan olguların tümör boyutları anlamlı şekilde negatif olanlardan daha büyük olarak saptanmıştır. Benzeri şekilde Lazaris ve arkadaşlarının89 klinikopatolojik faktörlerin sürvi ile korelasyonunu araştırdığı çalışmada da p53 ile tümör boyutu arasında pozitif ilişki bulunduğu bildirilmiştir. Bu yönüyle çalışmamız literatürle uyumluluk göstermektedir. Spafford ve arkadaşlarının83 immünohistokimyasal olarak çeşitli tümör markerlarını inceledikleri araştırmada düşük p53 ekspresyonlarının uzun sürvi ile ilişkili olduğunu ve ileri evre tümörlerde ekspresyonunun arttığını saptamışlardır. Başka bir çalışmada ise klinik ve patolojik faktörler ile ilişkisi bulunamamış ancak radyoterapi ve kemoterapiye zayıf yanıt ile ilişkili olabileceği ileri sürülmüştür.85 Ronchetti ve arkadaşları86 p53 mutasyonlarının sigara kullananlarda daha sık görüldüğünü ancak prognostik değeri olmadığını bildirmişlerdir. Büyükbayram ve arkadaşları87 60 vakadan oluşan çalışmasında p53 ile histolojik grade arasında korelasyon bulunduğunu öne sürmüşlerdir. Bu çalışmada p53 ile yaş, histolojik grade, vasküler/lenfatik invazyon, perinöral invazyon, kartilaj invazyonu, stromal iltihabi ve dezmoplazik yanıt, T evresi, lenf nodu metastazı ve klinik evre arasında anlamlı istatistiksel korelasyon gösterilememiştir. Ancak istatistiksel anlamlılığa yakın bir biçimde p53 pozitif tümörlerin daha çok supraglottik ve transglottik tümörler oldukları dikkati çeken bir bulgu olarak ortaya çıkmıştır. Literatürdeki bildirilerde benzeri bir sonuca rastlanamamış olması bu konuda daha geniş seriler içeren araştırmaların yapılabileceğini düşündürmektedir. 57 Çalışmamızda p53 ile sadece tümör boyutu arasında istatistiksel olarak anlamlı bir ilişki olduğu saptanmıştır. Ancak diğer tüm klinik ve patolojik prognostik faktörler ile p53 arasında bir korelasyon varlığı gösterilememiştir. Ayrıca Fas-FasL reseptör ligand çifti ve p53 ile arasında da herhangi bir korelasyon varlığı gösterilememiştir. Bu sonuçlar p53’ün de Fas-FasL çifti gibi bağımsız, güvenilir bir prognostik düşündürmektedir. 58 faktör olarak kullanılamayacağını SONUÇLAR Şubat 2002-Temmuz 2006 tarihleri arasında Dr.Lütfi Kırdar Kartal Eğitim ve Araştırma Hastanesi 1. ve 2. Kulak-Burun-Boğaz kliniklerinde larinks karsinomu nedeniyle opere edilerek Patoloji laboratuarımızda incelenen olgular değerlendirildi ve seçilen 53 olgu çalışma kapsamına alındı. Çalışmamızda immünohistokimyasal inceleme ile larinks skuamöz hücreli karsinomlarında, Fas, Fas-ligand ve p53 ekspresyonları değerlendirildi. Bu parametrelerin birbirleri ile ve hasta yaşı, tümör çapı, histolojik grade, tümör lokalizasyonu, stromal iltihabi ve dezmoplazik yanıt, lenfatik/vasküler invazyon, perinöral invazyon, kartilaj invazyonu, boyun lenf nodu metastazı, T kategorisi ve evre gibi prognostik parametreler ile ilişkisi araştırıldı. Tümör hücrelerinde Fas ekspresyonu ile; - Histolojik grade arasında istatistiksel olarak ileri derecede anlamlı bir ilişki bulundu (p<0.01). - FasL arasında pozitif yönde ileri düzeyde anlamlı bir korelasyon saptandı (p<0.05). - Hasta yaşı arasında istatistiksel anlamlılığa yakın bir ilişki saptandı (p:0.09) - Tümör çapı, histolojik grade, tümör lokalizasyonu, stromal iltihabi ve dezmoplazik yanıt, lenfatik/vasküler invazyon, perinöral invazyon, kartilaj invazyonu, boyun lenf nodu metastazı, T kategorisi, evre ve p53 arasında istatistiksel anlamlı bir ilişki gösterilemedi. 59 Tümör hücrelerinde FasL ekspresyonu ile; - Fas ekspresyonu arasında ileri düzeyde anlamlı pozitif korelasyon saptandı (p<0.05). - Histolojik grade arasında anlamlılığa yakın ilişki saptandı (p:0.056). - Stromal iltihabi yanıt arasında anlamlılığa yakın korelasyon bulundu (p:0.09). - Perinöral invazyon arasında anlamlılığa yakın korelasyon bulundu (p:0.078). - Tümör çapı, hasta yaşı, tümör lokalizasyonu, stromal dezmoplazik yanıt, lenfatik/vasküler invazyon, kartilaj invazyonu, boyun lenf nodu metastazı, T kategorisi, evre ve p53 arasında istatistiksel anlamlı bir ilişki gösterilemedi. Tümör hücrelerinde p53 ekspresyonu ile; - Tümör boyutu arasında istatistiksel olarak ileri düzeyde anlamlı korelasyon bulundu (p<0.01). - Tümör lokalizasyonu arasında ( özellikle supraglottik ve transglottik tümörler) anlamlılığa yakın istatistiksel ilişki saptandı (p:0.06). - Tümör çapı, hasta yaşı, histolojik grade, stromal iltihabi ve dezmoplazik yanıt, lenfatik/vasküler invazyon, perinöral invazyon, kartilaj invazyonu, boyun lenf nodu metastazı, T kategorisi, evre, Fas ve FasL arasında istatistiksel anlamlı bir ilişki gösterilemedi. Fas-FasL reseptör-ligand çifti apoptozda yer alarak ve tümöre karşı iltihabi yanıtı arttırarak malign tümörlerin progresyonun yavaşlatılmasında rol oynarlar. P53 tümör süpresor geni ise genetik hasarlı hücrelerin kontrolünde ve apoptozun tetiklenmesini sağlayarak tümöral süreçlerin sınırlandırılmasında etkili olur. Larinks kanserlerinde günümüze değin yapılan sayısız araştırmalar ile prognoz üzerindeki etkileri her yönüyle bilinen faktörler başta lenf nodu tutulumu olmak üzere TNM sınıflaması ve tümöre ait histopatolojik parametrelerdir. Literatürde prognoz belirlemek ve tedavi yaklaşımlarını daha iyi planlayabilmek amacıyla son yıllarda çok sayıda moleküler ajan ilgi odağı 60 haline gelmiş ve bu çalışmalarda çeşitli ve çelişkili sonuçlar bildirilmiştir. Bizim çalışmamızda da Fas-FasL ve p53 ile sadece sırasıyla histolojik grade ve tümör çapı arasında anlamlı istatistiksel ilişki gösterilebilmiş olması bu konunun halen tartışmaya açık olduğunu ve daha geniş seriler içeren fazla sayıda araştırmaya ihtiyaç olduğunu düşündürmektedir. 61 RESİMLER Resim 1: Fas için internal pozitif kontrol (Fas, x 300) Resim 2: Orta derece diferansiye SHK olgusunda, stromal inflamatuar hücrelerde Fas pozitifliği, internal kontrol (Fas, x300) 62 Resim 3: İyi diferansiye SHK olgusunda tümör hücrelerinde granüler sitoplazmik Fas pozitifliği (Fas, x400) Resim 4: İyi diferansiye SHK olgusunda tümör hücrelerinde Fas pozitifliği (Fas, x200) 63 Resim 5: FasL için pozitif kontrol (prostat, FasL, x 300) Resim 6: İyi diferansiye SHK olgusunda tümör hücrelerinde FasL pozitifliği ( FasL, x200) 64 Resim 7: İyi diferansiye SHK’ da FasL pozitifliği (FasL, x200) Resim 8: Orta diferansiye SHK’da FasL pozitifliği (FasL, x400) 65 Resim 9: Az diferansiye SHK olgusunda p53 pozitifliği (p53, x300) Resim 10: Orta derece diferansiye SHK olgusunda p53 pozitifliği (p53, x200) 66 KAYNAKLAR 1- Arscott PL, Stokes T, Myc A, et al.: Fas (CD95) expression is up-regulated on papillary thyroid carcinoma. J Clin Endocrinol Metab 1999; 84: 4246-52. 2- Assimakopoulos D, Kolettas E, Zagorianakou N, et al.: Prognostic significance of p53 in the cancer of the larynx. Anticancer Res 2000;20: 355564. 3- Bacciu A, Mercante G, Ingegnoli A, et al.: Effects of gastroesophageal reflux disease in laryngeal carcinoma. Clin Otolaryngol 2004; 29: 545-48. 4- Tumours of the hypopharynx, larynx and trachea, in: Barnes L, Eveson JW, Reichart P, Sidransky D, (eds.) World Health Organization Pathology and Genetics of Head and Neck Tumours. IARC Pres: 108-162, Lyon 2005. 5- Basolo F, Fiore L, Baldanzi A, Giannini R, Dell’Omodarme M, Fontanini G, et al.: Suppression of Fas expression and down regulation of Fas ligand in highly aggressive human thyroid carcinoma. Lab invest 2000; 80: 1413-9. 6- Batur Ş : Larinks skuamöz hücreli karsinomlarında FAS, FAS Ligand ve Ki67 ekspresyonunun klinikopatolojik parametrelerle karşılaştırılması (uzmanlık tezi), İstanbul: Sağlık Bakanlığı Haseki Eğitim Hastanesi, Patoloji Bölümü, 2004. 7- Bayazıt Y, Mumbuç S, Uçak R, Kanlıkama M, Bakır K : Significance of Fas protein in squamous cell carcinoma of the larynx. Acta Otolaryngol 2000; 120: 557-61. 67 8- Bennett MW, O’Connel J, O’Sullivan GC, Brady C, Roche D, Collins JK, Shanahan F : The Fas counterattack in vivo: apoptotic depletion of tumor infiltrating lymphocytes associated with Fas ligand expression by human esophageal carcinoma. J Immunol 1998; 160: 5669-75. 9- Bennett MW, O’Connel J, O’Sullivan GC, Roche D, Brady C, Collins JK, Shanahan F : Fas ligand and Fas receptor are coexpressed in normal human esophageal epithelium. Dis esophagus 1999; 12: 90-8. 10- Berrino , Elci OC, Elci MA: Occupational exposures, anatomic location and geographic distribution of laryngeal cancer; letter to the editor. Cancer causes and control 2004; 15: 429-30. 11- Büyükbayram H, Cüreoğlu S, Arslan A, Işıkakdoğan R: Prognostic value of PCNA and mutant p53 expression in laryngeal squamous cell carcinoma. Cancer Investigation 2004; vol22 No: 2: 195-202. 12- Castellanos PF, Spector JG, Kaiser T ; Tumors of the larynx and hypopharynx, in: Ballenger JJ, Snow JB Jr., (eds.): Otorhynolaryngology-Head and Neck Surgery, 15th edition, Illinois, Williams and Wilkins. 2000, 587604. 13- Cattaruzza MS, Maisonneuve P, Boyle P: Epidemiology of laryngeal cancer. Oral Oncol, Eur J Cancer 1996; vol 32B, N0:5: 293-305. 14- Cohen JT, Bach KK, Postma GN, Koufman JA : Clinical manifestations of laryngopharyngeal reflux. Ear Nose Throat J 2002; 81: 19-23. 68 15- Coşkun H, Larinks kanserleri : Ergin K, Erişen L: Baş-Boyun Kanserleri, Bursa, Nobel Kitabevleri, 2003, 345-407. 16- Head and Neck, in: Cotran RS, Kumar V, Collins T, (eds.): Robbins Pathologic Basis of Disease, 7th edition, Philadelphia, WB Saunders Company, 2003, 765-766. 17- Cowles SR: Cancer of the larynx; Occupational and environmental associations. South Med J 1983; vol76, No:7: 894-98. 18- Dosemeci M, Gokmen I, Unsal M, Hayes RB, Blair A: Tobacco, alcohol use and risks of laryngeal and lung cancer by subsite and histologic type in Turkey. Cancer Causes and Control 1997; 8: 729-37. 19- Eiband J, Elias JE, Suter CM, Gray WC, Didolkar MS : Prognostic factors in squamous cell carcinoma of the larynx. Am J Surg 1989; 158: 314-7. 20- Elci OA, Elci MA, Blair A, Dosemeci M: Risk of laryngeal cancer by occupational chemical exposure in Turkey. J Occup Environ Med 2003; 45: 1100-6. 21- Galli J, Cammarota G, Calo L, et al.: The role of acid and alkaline reflux in laryngeal squamous cell carcinoma. Laryngoscope 2002; 112: 1861-65. 22- Gastman BR, Atarashi Y, Reichert TE, Saito T, Balkır L, Rabinowich H, Whiteside TL : Fas ligand is expressed on human squamous cell carcinomas of the head and neck, and it promotes apoptosis of T lymphocytes. Cancer Res 1999; 59: 5356-64. 69 23- Gratas C, Tohma Y, Barnas C, Taniere P, Hainaut P, Ohgaki H : Upregulation of Fas (Apo1/CD95) ligand and down-regulation of Fas expression in human esophageal cancer. Cancer Res 1998; 58: 2057-62. 24- Griffith TS, Brunner T, Fletcher SM, Gren DR, Ferguson TA : Fas ligandinduced apoptosis as a mechanism of immune privilige. Science 1995; 270: 1189-92. 25- Gutierrez MI, Cherney B, Hussain A, et al.: Bax is frequently compromised in Burkitt’s lymphomas with irreversible resistance to Fas-induced apoptosis: Cancer Res 1999; 59: 696-703. 26- Hamann KJ, Dorcheid DR, Ko FD, et al.: Expression of Fas (CD95) and Fas ligand (CD95L) in human airway epithelium. Am J Respir Cell Mol Biol 1998; 19: 537-42. 27- Hellquist HB: Apoptosis in epithelial hyperplastic laryngeal lesions. Acta Otolaryngol 1997; 527: 25-9. 28- Hug H : Fas-mediated apoptosis in tumor formation and defense. Biol Chem 1997; 378: 1405-12. 29- Hughes SJ, Nambu Y, Soldes OS et al.: Fas/Apo1 (CD95) is not translocated to the cell membrane in esophageal adenocarcinoma. Cancer Res 1997; 57: 5571-8. 30- Jackel MC, Dorudian MA, Marx D, Brinck U, Schauer A, Steiner W : Spontaneous apoptosis in laryngeal squamous cell carcinoma is independent of bcl-2 and bax protein expression. Cancer 1999; 85: 591-9. 70 31- Jackel MC, Mitteldorf C, Schwyer S, Fuzesi L : Clinical relevance of Fas (CD95/Apo1) expression in laryngeal squamous cell carcinoma. Head neck 2001; 23: 646-52. 32- Jackel M, Selmann L, Dorudian MA, Youssef S, Fuzesi L : Prognostic significance of p53/bcl-2 coexpression in patients with laryngeal squamous cell carcinoma. Laryngoscope 2000; 110: 1339-45. 33- Kawasai M, Kuwano K, Nakanishi Y, et al.: Analysis of Fas and Fas ligand expression and function in lung cancer cell lines. Eur J Cancer 2000; 36: 656-63. 34- Kerr JFR, Winterford CM, Harmon BV : Apoptosis. Cancer 1994; 73: 2013-26. 35- Kim YS, Kim KH, Choi Ja, Lee JH, Kim HK, Won NH, Kim I : Fas (CD95/Apo1) and Fas ligand expression in renal cell carcinomas: correlation with the prognostic factors. Arch Pathol Lab Med 2000; 124:687-93. 36- Kleist B, Junghans D, Lorenz G, Bankau A: The supplementary diagnostic power of selected immunohistochemical, molecular genetic and infective parameters in epithelial hyperplastic laryngeal lesions. Oncology 2003; 65: 34754. 37- Koomagi R, Volm M : Expression of Fas (CD95/Apo1) and Fas ligand in lung cancer, its prognostic and predictive relevance. Int J Cancer 1999; 84: 23943. 71 38- Koufman JA, Burke AJ: The etiology and pathogenesis of laryngeal carcinoma. Otolaryngol Clin North Am. 1997 Feb; 30 (1) : 1-19. 39- Lazaris AC, Lendari I, Kavantzas N, et al.: Correlation of tumor markers p53, bcl-2 and cathepsin-D with clinicopathologic features and disease free survival in laryngeal squamous cell carcinoma. Pathol Int 2000; 50: 717-24. 40- Liu YC, Chen CM, Hsieh HF, et al.: Apoptosis and Fas ligand expression correlate to the histopathological grade of gastric smooth muscle tumors. J Surg Res 2001; 95: 92-8. 41- Liu M, Lawson G, Delos M, et al.: Prognostic value of cell proliferation markers, tumor supressor proteins and cell adhesion molecules in primary squamous cell carcinoma of the larynx and hypopharynx. Eur Arch Otorhinolaryngol 2003; 260: 28-34. 42- Lowin B, Hahne M, Mattmann C, Tschopp J : T-cell cytotoxicity is mediated through perforin and Fas lytic pathways. Nature 1994; 370: 650-2. 43- Manni JJ, Terhaard CHJ, Boer MF, et al.: Prognostic factors for survival in patients with T3 laryngeal carcinoma. Am J Surg 1992;164:683-7. 44- Mialcarek-Kuchta D, Olofsson J, Golusinski W: p53, Ki67 and cyclin D1 as prognosticators of lymph node metastases in laryngeal carcinoma. Eur Arch Otorhinolaryngol 2003; 260: 549-54. 45- Mitsiades N, Poulaki V, Mastorakas G, et al.: Fas ligand expression in thyroid carcinomas; a potential mechanism of immune evasion. J Clin Endocrinol Metab 1999; 84: 2924-32. 72 46- Mottolese M, Buglioni S, Bracalenti C, et al.: Prognostic relevance altered Fas (CD95) system in human breast cancer. Int J Cancer 2000; 89: 127-32. 47- Muraki Y, Yoshioka C, Tateishi A, Fukuda J, Haneji T, Kobayashi N: Localization of Fas antigen in oral squamous cell carcinoma. Br J Oral Maxillofac Surg 1999; 37: 37-40. 48- Muscat JE, Wynder EL : Tobacco, alcohol, asbestos and occupational risk factors for laryngeal cancer. Cancer 1992; 69: 2244-51. 49- Nadal A, Cardesa A: Molecular biology of laryngeal carcinoma. Virchows Arch 2003; 442: 1-7. 50- Nagata S, Golstein B : The Fas death factor. Science 1995; 267: 1449-55. 51- Narayana A, Vaughan ATM, Gunaratne S, Kathuria S, Walter SA, Reddy SP : Is p53 an independent prognostic factor in patients with laryngeal carcinoma ? Cancer 1998; 82: 286-91. 52- Nayar R, Schindler S, Head and neck in: Haber MH, Gattuso P, Spitz DJ, David O, eds. Differential diagnosis in surgical pathology. Philadelphia, WB Saunders Company, 2002, 363-453. 53- O’Connell J, Bennet MW, O’Sullivan GC, Collins JK, Shanahan F: Resistance to Fas (Apo1/CD95) mediated apoptosis and expression of Fas ligand in esophageal cancer; The Fas counterattack. Dis Esophagus 1999; 12: 83-9. 54- Okada K, Komuta K, Hashimoto S, Matsuzaki S, Kanematsu T, Koji T : Frequency of apoptosis of tumor infiltrating lymphocytes induced by Fas 73 counterattack in human colorectal carcinoma and its correlation with prognosis. Clin Cancer Res 2000; 6: 3560-4. 55- Owen-Schaub L : Solubl Fas and Cancer. Clin Cancer Res 2001; 1108-9. 56- Owen-Schaub L, Chan H, Cusack JC, Roth J, Hill LL : Fas and Fas ligand interactions in malignant disease (Review). Int J Oncol 2000; 17: 5-12. 57- Owen-Schaub L, Radinsky R, Kruzel E, Berry K, Yonehara S : Anti-Fas on nonhematopoietic tumors: levels of Fas/Apo1 and bcl-2 are not predictive of biological responsiveness. Cancer Res 1994; 54: 1580-6. 58- Pera E, Moreno A, Galindo L : Prognostic factors in laryngeal carcinoma. Cancer 1986; 58: 928-34. 59- Pilch BZ, Tumors of the upper respiratory tract, Part B Larynx and trachea in: Fletcher CDM, ed. Diagnostic Histopathology of Tumors, 2nd edition, Vol 1, China, Churchill Livingstone, 2000, 138-169. 60- Rafferty MA, Fenton JA, Jones AS: The history, aetiology and epidemiology of laryngeal carcinoma. Clin Otolaryngol 2001; 26: 442-46. 61- Raitiola HS, Pukander JS: Etiological factors of laryngeal cancer. Acta Otolaryngol 1997; Suppl 529: 215-17. 62- Reimer T, Herrnring C, Koczan D, et al.: FasL: Fas ratio- a prognostic factor in breast carcinomas. Cancer Res 2000; 60: 822-8. 74 63- Rigberg DA, Centeno J, Kim FS, Ke B, Swenson K, Maggard M, McFadden DW : Irradiation-induced up-regulation of esophageal squamous cell carcinoma is not accompanied by Fas ligand mediated apoptosis. J Surg Oncol 1999; 71: 91-6. 64- Ronchetti D, Neglia CB, Cesana BM, et al.: Association between p53 gene mutations and tobacco and alcohol exposure in laryngeal squamous cell carcinoma. Arch Otolaryngol Head Neck Surg 2004; 130: 303-6. 65- Rosai J. Respiratory Tract, in: Rosai and. Ackerman’s Surgical Pathology, 9th edition, Vol 1, China; Mosby, 2004, 305-458. 66- Sadri M, McMahon J, Parker A: Laryngeal dysplasia: aetiology and molecular biology. J Laryngol Otol 2006; 120: 170-77. 67- Sasaki CT, Carlson RD; Malignant neoplasms of the larynx, in: Cummings CW, ed. Otolaryngology-Head and Neck Surgery, Vol 3 St. Louis, Mosby, 1986. 68- Seta C, Fujita M, Muraki Y, Fukuda J, Kobayashi S, Hanehi T : Fas expression and Fas monoclonal antibody-induced apoptosis in human squamous cell carcinoma cell line, SCC-25. J Oral Pathol Med 2000; 29: 271-8. 69- Sharma K, Wan RX, Zhang LY, et al.: Death the Fas way: regulation and pathophysiology of CD95 and its ligand. Pharmacol Ther 2000; 88: 333-47. 1987-2017. 75 70- Shibakita M, Tachibana M, Dhar DK, et al.: Prognostic significance of Fas and Fas ligand expressions in human esophageal cancer. Clin Cancer Res 1999; 5: 2464-9. 71- Shibakita M, Tachibana M, Dhar DK, Ohno S, Kubato H, Yoshimura H, et al.: Spontaneus apoptosis in advanced esophageal carcinoma: Its relation to Fas expression. Clin Cancer Res 2000; 6: 4755-9. 72- Shibata H, Matsubara O : Apoptosis as an independent prognostic indicator in squamous cell carcinoma of the esophagus. Pathol Int 2001; 51: 498-503. 73- Sittel C, Eckel HE, Damm M, Pritzbuer E, Kvasnicka HM: Ki-67 (MIB-1), p53 and Lewis-X (LeuM1) as prognostic factors of recurrence in T1 and T2 laryngeal carcinoma. Laryngoscope 2000; 110: 1012-17. 74- Smith EM, Summersgill KF, Allen J, Hofman HT, Mc Culloch T, Turek LP, Haugen TH : Human papillomavirus and risk of laryngeal cancer. Ann Otol Rhinol Laryngol 2000; 109: 1069-76. 75- Spafford MF, Koeppe J, Pan Z, Archer PG, Meyers AD, Franklin WA. Correlation of tumor markers p53, bcl-2, CD34, CD44v6 and Ki-67 with survival and metastasis in laryngeal squamous cell carcinoma. Arch Otolaryngol Head Neck Surg 1996; 122: 627-32. 76- Sternberg SS, Antonioli DA ; Pathology of the larynx, in: Diagnostic Surgical Pathology, 3rd edition, Vol 1, Philadelphia, Lippincott Williams and Wilkins, 1999, 925-947. 76 77- Strand S, Galle PR : Immune evasion by tumors: involvement of Fas (CD95/Apo1) system and its clinical implications. Mol Med Today 1998; 4: 63-8. 78- Şengiz S, Papuççuoğlu U, Sarıoğlu S: Immunohistological comparison of the World Health Organization (WHO) and Ljubljana classifications on the grading of preneoplastic lesions of the larynx. Pathology- Research and Practice 2004; 200: 181-88. 79- Teppo H, Soini Y, Melkko J, Koivunen P, Alho OP: Prognostic factors of laryngeal carcinoma: the role of apoptosis, p53, proliferation (Ki-67) and angiogenesis. APMIS 2003;111: 451-7. 80- Thompson CB : Apoptosis in the pathogenesis and treatment of disease. Science 1995; 267: 1456-62. 81- Ugurel S, Seiter S, Rapl G, Stark A, Tilgen W, Reinhold U : Heterogenous susceptibility to CD95-induced apoptosis in melanoma cells correlates with bcl2 and bcl-x expression and is sensitive to modulation by interferon-γ. Int J Cancer 1999; 82: 727-36. 82- Vielba R, Bilbao J, Eng C, et al.: p53 and cyclin D1 as prognostic factors in squamous cell carcinoma of the larynx. Laryngoscope 2003; 113: 167-72. 83- Vlachtsis K, Nikolaou A, Markou K, et al.: Clinical and molecular prognostic factors in operabl laryngeal cancer. Eur Arch Otorhinolaryngol 2005; 262: 890-98. 77 84- Volavsek M, Bracko M, Gale N: Distribution and prognostic significance of cell cycle proteins in squamous carcinoma of the larynx, hypopharynx and adjacent epithelial hyperplastic lesions. J Laryngol Otol 2003; 117: 286-93. 85- Walker PR, Saas P, Dietrich PY : Tumor expression of Fas ligand (CD95L) and the consequences. Cancer 1998; 10: 564-72. 86- Webb SD, Sheratt JA, Fish RG : Cells behaving badly: a theoretical model for the Fas/FasL system in tumor immunology. Math Biosci 2002; 179: 113-29. 87- Whiteside TL, Rabinowich H : The role of Fas/FasL in immunosuppression induced by human tumors. Cancer Immunol Immunother 1998; 46: 175-84. 88- Wight R, Paleri V, Arullendran P: Current theories for the development of nonsmoking and nondrinking laryngeal carcinoma. Current opinion in Otolaryngol Head neck surg 2003; 11: 73-7. 89- Yıldırım S, Çermik H, Işıtmangil T, et al.: Significance of p53 and bcl-2 immunoexpression in the prognosis of laryngeal squamous cell carcinoma. J Int Med Res 2002; 30: 597-600. 90- Younes M, Lechago J, Ertan A, Finnie D, Younes A : Decreased expression of Fas (CD95/Apo1) associated with goblet cell metaplasia in Barrett’s esophagus. Human Pathol 2000; 31: 434-8. 91- Younes M, Schwartz MR, Ertan A, Finnie D, Younes A : Fas ligand expression in esophageal carcinomas and their lymph node metastases. Cancer 2000; 88: 524-8. 78