KIMYASAL BAG II: BAG KURAMLARI
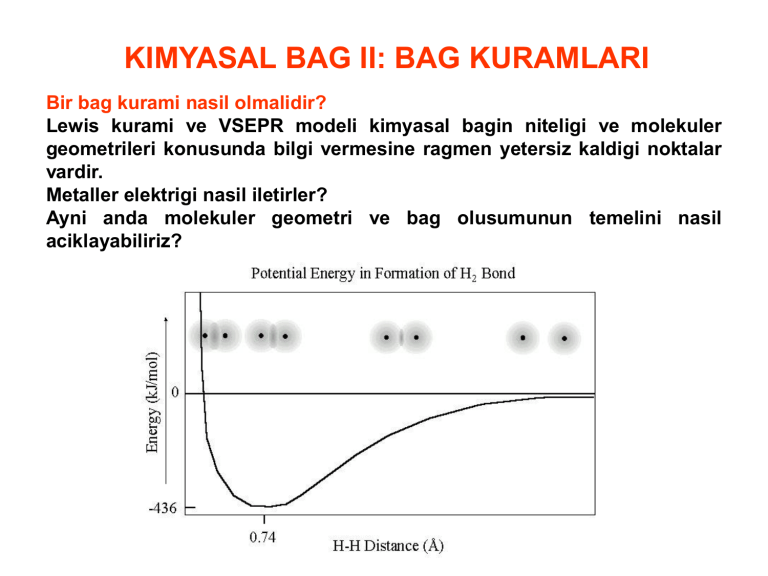
Bir bag kurami nasil olmalidir?
Lewis kurami ve VSEPR modeli kimyasal bagin niteligi ve molekuler
geometrileri konusunda bilgi vermesine ragmen yetersiz kaldigi noktalar
vardir.
Metaller elektrigi nasil iletirler?
Ayni anda molekuler geometri ve bag olusumunun temelini nasil
aciklayabiliriz?
Degerlik Bag Kurami
Kovalent bag; iki atom arasinda, atom orbitallerinin ortusmesinden
olusan yuksek elektron yogunluguna sahip bir bolgedir (Degerlik Bag
Kurami). Atom orbitallerinin yari dolmus olmasi gerekir. Bununla birlikte
dolu ile bosun ortusdugu de gorulur.
Icteki elektronlar ve ortaklanmamis degerlik elektron ciftleri kendi
atomlarinin orbitallerinde kalirlar ve bag yapan elektronlarin yuk
yogunlugu orbital ortusmesi bolgesinde artar.
Kitapta Sekil 12-2 ye bakiniz
Atom Orbitallerinin Melezlesmesi
sp melez orbitali
F
1s22s22p5
1s22s2
Be
(temel hal)
Be
(uyarilmis hal)
2 s orbitalindeki elektronlardan biri enerji sogurarak bos 2p orbitaline atlar.
Bu durumda Be ve iki F atomu kovalent bag yapabilir.
Beklenen F’a ait eslenmemis 2p orbitali ile Be’un 2s ve 2p orbitallerinin
girisimi ile iki kovalent bag olusumudur !!!!
Halbuki BeF2 molekulu duzlemsel yapidadir ve bag uzunluklari esittir!!!!!
Iki farkli orbital ile girisim soz konusu oldugundan molekulun duzlemsel
olusu ve bag acilarinin ayni olmasi beklenemez???
Deneysel gozlemler bunun tersini soylemektedir.
sp melez orbitali (Sekil 12-9)
Farkli enerji duzeylerinde atom orbitallerinin karisarak, ayni enerji duzeyinde orbitallere
donusmesine melezlesme (hibritlesme), bu yeni orbitallere de melez orbitaller denir.
Melezlesme sonunda olusan melez orbitallerin sayisi, melezlesmeye katilan atom
orbitallerinin sayisina esittir. Melezlesmenin turu, melezlesmeye katilan orbitallerin cinsi
ve sayisi ile belirtilir.
sp2 melez orbitali
BF3
B
Sekil 12-8’e bak
sp3 melez orbitali
CH4
C
Sekil 12-5’e bak
sp3 melez orbitali
H2O
O
sp3d melez orbitali
PF5
P
Ucgen bipiramit
sp3d ve sp3d2 (SF6) icin sekil 12-11’e bak.
Uygun bir melezlesme secebilmek icin asagidaki kurallar uygulanabilir:
-Ilgilendiginiz tur icin uygun bir Lewis yapisi yaziniz
-VSEPR kuramini kullanarak, merkez atomunun olasi elektron-grup geometrisinin
ongorulmesi
-Elektron grup geometrisine karsilik gelen melezlesme semasinin secilmesi
Geometrik yonlenme
Orbitallerin sayisi
Melez orbital
Ornek
Lineer
2
sp
BeCl2
Ucgen duzlem
3
sp2
BF3
Dort yuzlu
4
sp3
CH4
Ucgen bipiramit
5
sp3d
PCl5
Sekiz yuzlu
6
sp3d2
SF6
Ornek 12-2’ye bak
Coklu Kovalent Baglar
Internuclear axis’e gore elektron yogunlugu simetrik olan
baglar sigma (σ) bagi olarak tanimlanir.
Internuclear axis’e dik olan iki p orbitalinin ortusmesi ile
olusan baglara pi bagi “π” denir. π baginda ortusen
kesimler cekirdekler arasi eksenin altinda ve ustunde kalir.
Sigma baginda ortusen bolge pi bagindan daha fazla
oldugundan, sigma bagi pi bagindan daha kuvvetlidir.
Genel olarak konusursak:
Tekli bag bir sigma bagi,
ikili bag bir sigma bir pi
bagi ve uclu bag bir sigma
iki pi bagi icermektedir.
Coklu Kovalent Baglar
C2H4 = Etilen
Etilen duzlemsel bir molekuldur. VSEPR kuramina ters dusmektedir bu bulgu.
Cunku VSEPR kuramina gore CH2 gruplari ayni duzlemde bulunmamalidir. Etilen
molekulunde her bir karbon cevresindeki geometrik duzenlenme ucgen
duzlemseldir. Ucgen duzlemsel yapi sp2 tipi melezlesme gerektirmektedir.
Karbonun elektron konfigurasyonu asagidaki sekilde duzenlenmelidir o halde:
Bu durumda bir tane bag yapmak icin uygun eslesmemis p orbitali olusmaktadir.
Bu eslesmemis p orbitali 3 sp2 orbitaline dik yonlenmistir.
Melezlesmemis p orbitallerinin ortusmesinden de pi bagi olusur. Bu bagda
karbon ve hidrojen atomlarinin olusturdugu duzlemin altinda ve ustunde yuksek
elektron yogunluguna sahip bir bolge vardir. (Sekil 12-12 ye bak).
C2H2 (asetilen)
Duzlemsel bir molekul oldugu
icin melezlesme sekli sp’dir.
Melezlesmemis p orbitallerinin ortusmesinden de iki adet pi bagi olusur. (Sekil
12-14 e bak).
Molekul Orbital Kurami
Molekul orbital kurami, molekullerinde tipki
atomlar gibi orbitalleri
oldugunu
ve
molekuldeki
elektronlarin
bu
orb.
bulunduklarini kabul eder.
-Olusan molekul orbitallerinin (MO) sayisi
birlesen atom orbitallerinin sayisina esittir.
-Iki atom orbitali birlestiginde (karisip
kaynastiginda)
olusan
iki
molekul
orbitalinden
biri,
baslangictaki
atom
orbitallerinden daha dusuk enerjili baglayici
(bonding) MO’dir. Digeri ise daha yuksek
enerjili bir karsit baglayici (antibonding)
molekul orbitalidir.
-Temel halde elektronlar normal olarak en dusuk enerjili MO lere girerler.
-Bir MO deki max. elektron sayisi ikidir (Pauli dislama ilkesi).
-Temel halde elektronlar, aynienerjili MO lere eslesmeden, once tek tek girer (Hund
kurali).
Eger bir molekul kararli ise, baglayici orbitallerindeki elektron sayisi karsit baglayici
orbitallerdekinden coktur. Ornegin baglayici elektronlarin sayisi, karsit baglayici
elektronlardan iki fazla ise, bu Lewis kuraminda bir tek kovalent baga karsilik gelir.
Molekul orbital kuraminda ise bag derecesi 1 dir denir.
Baglayici MO e- sayisi – karsit baglayici MO e- sayisi
Bag derecesi =
2
