Şant Enfeksiyonları - Mersin Üniversitesi
advertisement

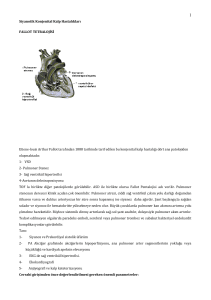
DERLEME Şant Enfeksiyonları Celal BAĞDATOĞLU,a Emel AVCI,a Ahmet DAĞTEKİN,a M. Ali KARATAŞ,a Mustafa AKCAN,a Tolga AKBIYIKa a Beyin ve Sinir Cerrahisi AD, Mersin Üniversitesi Tıp Fakültesi, Mersin Yazışma Adresi/Correspondence: Celal BAĞDATOĞLU Mersin Üniversitesi Tıp Fakültesi, Beyin ve Sinir Cerrahisi AD, Mersin, TÜRKİYE cbagd@yahoo.com ÖZET Hidrosefali tedavisinde kullanılan silikon içerikli şantların uygulama sonrası ortaya çıkan en önemli komplikasyonlarından biri kuşkusuz enfeksiyonlardır. Sıklığı ortalama girişim başına %4,5-14 olup etken çoğunlukla normal cilt florası kaynaklıdır. Klinik bulgular kullanılan şant tipine ve lokalizasyona bağlı değişiklikler gösterebilmektedir. Şant enfeksiyonunda düşünülen hastalarda beyin omurilik sıvısının (BOS) özellikle mikrobiyolojik incelemesi önemlidir. Tanı konulan hastalarda antibiyotik tedavisi yanında şantın çıkarılması, external ventriküler yol ile BOS drenajına geçilmesi ve daha sonra yeni şant uygulaması sık kullanılan, en güvenli ve en başarılı uygulama olarak bildirilmektedir. Şant enfeksiyonlarının engellenmesinde cerrahi alan enfeksiyonlarının önlenmesine yönelik gerekli uygulamalar oldukça önem taşımaktadır. Anahtar Kelimeler: Antibiyoterapi; merkezi sinir sistemi enfeksiyonları; beyin omurilik sıvısı şantları; antibakteriyel ajanlar; enfeksiyon ABSTRACT Infection is one the most important complication of silicon shunts that are used for hydrocephalus management. The incidence is about 4.5-14% and the etiologic agents are usually from the normal skin flora. The clinical findings may differ according to the type of shunt material. Microbiological evaluation of cerebrospinal fluid (CSF) is to be considered for the patients suffering from shunt infections. Besides antibiotherapy; shunt removal, CSF drainage via external ventricular way and new shunt application are the most frequently performed ,safe and successful management modalities. Prevention of surgical field infections is of utmost importance for avoiding shunt infections. Key Words: Antibiotherapy; central nervous system infections; cerebrospinal fluid shunts; anti-bacterial agents; infection Turkiye Klinikleri J Neurosurg-Special Topics 2015;5(1):70-7 Copyright © 2015 by Türkiye Klinikleri idrosefalide kullanılan şantlar, aşırı biriken BOS’un dışarı veya vücut boşluklarından herhangi birine (periton, plevra, atrium) boşaltan ve silikon içeren malzemelerdir. Şant uygulama sonrasında görülen enfeksiyonlar erişkin ve çocuk hidrosefali hastalarının major morbidite kaynağıdır. Şant enfeksiyonları santral sinir sistemi (SSS) enfeksiyonlarının en sık görülen ve en ciddi komplikasyonlarından biridir.1 Ayrıca %30-40 mortalite oranı ve bu yüksek mortalite oranı yanında entellektüel yıkım ve ciddi nörolojik defisitlere neden olabilir.2-5 Turkiye Klinikleri J Neurosurg-Special Topics 2015;5(1) 70 Celal BAĞDATOĞLU ve ark. ŞANT ENFEKSİYONLARI taya çıkan bu biyotabakanın pek çok bilinen antikor, beyaz kan hücreleri, sürfaktan, antibiyotik gibi antibakteryel ajanlara karşı önemli miktarda koruma sağladığı gösterilmiştir.27-32 Sonuçta bu biyotabakanın koruyucu etkileri şant enfeksiyonuna karşı aşırı kullanılan sistemik ve/veya intraventriküler antibiyotik tedavisinin göreceli olarak yetersiz kalmasını açıklayabilmektedir.33-36 Agresif antimikrobiyal tedavisi akut inflamasyonu temizlemekte fakat biyotabakanın içindeki çok sayıda organizma kalmakta, nadiren eradike olmaktadır. Bundan dolayı bakteri kaynağı kalmakta, biyotabaka bakterileri çevreye dökebildiği içinde antibiyotiğin kesilmesinden sonra akut enfeksiyon tekrar başlamaktadır.31,32 Biyotabakadaki büyüme tarzı farklı enfeksiyon ajanları ile sık rastlanan farklı klinik tablolar açıklanabilmektedir.22 Staf. aureusun şant yüzeyine bağlanma yeteneği düşüktür, bunun yanında stafilokok epidermitis gibi extrasellüler sümüksü sıvı üreten organizmalarda şant materyaline bağlanma yeteneği güçlü olup gerçek bir şant kolonizasyonu gösterirler. EPİDEMİYOLOJİ Kaufman ve McLone girişim başına düşen enfeksiyon oranının %4,5-14 ve hasta başına düşen enfeksiyon oranının da %8-40 arasında değiştiğini saptamışlardır. Şant enfeksiyonları hemen her zaman mekanik olarak şant disfonksiyonuna neden olur. Yapılan çalışmalarda şant enfeksiyon riskinin en yüksek olduğu hasta grubunun periventriküler kanamaya bağlı hidrosefali nedeniyle şant uygulanan olgular olduğu bildirilmiştir.6,7 Ayrıca ventriküloatrial ve ventriküloperitoneal şantlar arasında enfeksiyon oranları açısından fark olmadığı belirtilmektedir.8 Literatürdeki bazı seriler incelendiğinde meningomyeloseli olan hidrosefalik olgularda daha yüksek enfeksiyon oranı olduğu bildirilmiştir.9-11 Ancak bazı çalışmalarda ise hidrosefali etyolojisi ile şant enfeksiyonu gelişimi arasında bir ilişki olmadığı belirtilmiştir.10,12,13 Şant enfeksiyonlarında en sık kabul edilen enfeksiyon şekli kolonizasyondur. En sık izole edilen mikroorganizma ise enfeksiyonların yaklaşık %40’ını oluşturan Stafilokok epidermidis olup ikinci sırada %20 ile Stafilokok aureustur.14-20 Bu mikroorganizmalar sıklıkla normal cilt florasının bir parçasıdır ve çoğu şant enfeksiyonu şantın takılmasını takip eden ilk 2 ay içinde ortaya çıkar.14-17,21 Hastadan ya da cerrahi personelden (cerrahi eldiven ya da cerrahi aletlerin hasta florası ile kontaminasyonu) endojen yayılım mevcuttur. Diğer izole edilen mikroorganizmalar ise Coryneforms, Streptokok, Enterekok, aerobik gram negatif çomaklar ve mayalardır.22 Yapılan başka çalışmalarda ise şant enfeksiyonlarının büyük bir kısmının tipik cilt mikroorganizmalarından kaynaklandığını diğer kontaminasyon odaklarının ise oldukça az öneme sahip olduklarını saptamışlardır.19,20,23 ŞANT ENFEKSİYONLARININ SINIFLANDIRILMASI Şant enfeksiyonlari erken yada geç; internal yada external olarak sınıflandırılabilir. Şant enfeksiyonlarının iki ayrı semptomatolojiye neden olması sebebiyle internal ve eksternal diye ikiye ayırmanın yararlı olacağını savunanlar vardır.37,38 İnternal şant enfeksiyonunda ventrikülit, kolonizasyona bağlı ventriküloatrial (VA) şanta bağlı bakteriyemi ya da ventriküloperitoneal şanta (VP) bağlı peritonit vardır ve cilt enfeksiyonu yoktur. Eksternal şant enfeksiyonu ise şant cihazının dış kısmı ya da onu çevreleyen cilt dokusunun enfeksiyonu olup yara enfeksiyonu, şantın bir kısmı ya da şant trasesi boyunca selülit, ciltte ülserasyon ya da ciltte açılmayı kapsar. Şant enfeksiyonu şant uygulanmasının takiben ilk 2 ayda sık olarak gözlenirken, bir yıldan sonra görülmesi nadirdir.39 Şant enfeksiyonunun %69’u şant takılmasını takip eden ilk ayda %86’sı ise ilk 6 ayda görülür.39,40 Erken şant enfeksiyonu; sıklıkla , BAKTERİYEL VIRÜLANS FAKTÖRLERİ Şant enfeksiyonlarında en sık görülen mikroorganizma stafilokoklardır ve şant yerleşimi sırasında kazanılmaktadırlar. Bu mikroorganizma, prostetik materyale direkt olarak yapışmakta ve ürettiği substratlar sayesinde antimikrobiyal ajanlardan ve fagositozdan korunmaktadır.24 Yapışma yabancı materyal enfeksiyonlarında en önemli basamaktır. Bir diğer mekanizma; bakterinin slime faktör üretimidir. Slime, suda eriyen %40 şeker ve %27 proteinden oluşan (bu oranlar her mikroorganizma için farklı olabilir) bir üründür. Slime faktör, daha çok koagülaz negatif stafilokoklarda çalışılmıştır.25 Ancak pseudomonas aeruginosa ve corynbacterium spp. gibi bakterilerin de slime faktör ürettiği bilinmektedir.26 Or- 1. Stafilokok epidermitis (koagülaz negatif) enfeksiyonların %60-75’i (en sık). 2. Stafilokok aureus 3. Gram negatif basil; %6-20 gram negatif basil kaynaklı bir şant enfeksiyonunda primer bir sebep mutlaka düşünülmeli ve araştırılmalıdır. Yenidoğanlarda E.coli ve Streptokokus hemoliticus sık görülür. Geç şant enfeksiyonu (operasyondan 6 ay sonra gelişebilir); sıklıkla, Turkiye Klinikleri J Neurosurg-Special Topics 2015;5(1) 71 Celal BAĞDATOĞLU ve ark. dur. ŞANT ENFEKSİYONLARI 1. Genellikle S.epidermise bağlı yavaş enfeksiyon- 10. Operasyon odasında fazla kişi, operasyon sırası ve süresi; Kontny ve ark., cerrahi süre ile enfeksiyon sıklığı arasında kesin bir ilişki olduğunu göstermişlerdir. Buna göre 90 dakikadan uzun süren operasyonlarda enfeksiyon oranı %3,6 iken, 30 dakikanın altındaki operasyonlarda bu oran yalnızca %5,2’dir.44 Cinsiyet farklılığı şant enfeksiyonu riskini arttırmamaktadır.45 Artmış beyin omurilik sıvısı (BOS) proteinin SSS enfeksiyonu riskini artırdığı düşünülmekteydi. Brydon ve ark., bu görüşe zıt olarak, toplam 116 şant operasyonu yapılan hastadan, artmış BOS proteini olan 95 hastada, BOS proteini normal olan 21 hastaya göre enfeksiyon oranlarının artmadığını göstermişlerdir.46 2. Septisemi sırasında vasküler kaynaklı olduğu düşünülür. 3. Menenjit sırasında kolonizasyona bağlı olarak gelişebilir. PATOGENEZ Serebrospinal şant enfeksiyonlari 4 mekanizma ile oluşmaktadır.26 1. Retrograd enfeksiyonlar: Şantın distal ucundan gelişen enfeksiyonlardır. SEMPTOM VE BULGULAR 2. Hematojen yayılım: Vasküler sistemde yabancı materyal olan venöz şantlı kişiler bakteriyemi açısından daha yüksek riske sahiptir. Semptom ve bulgular, şant tipine, etken mikroorganizma ve patogeneze bağlı olarak değişkenlik gösterir. şant takılan hastalarda BOS dolaşımının bozuk olması nedeniyle, gelişen enfeksiyonlarda meningeal irritasyon bulgularının (ense sertliği vb.) görülmemesi tanıyı dışlamamalıdır. Şant enfeksiyonlarının bu şeklinin eksternal şant kullanan hastalarda ortaya çıkması daha yaygındır. Eksternal şant kullanımında lokal şant enfeksiyonuna daha sık rastlanılmaktadır. şantın distaline ulaşan ya da distal alanda başlayan enfeksiyonların klinik belirtileri farklılıklar göstermektedir. Vasküler alanda sonlanan VA şantlarda bulgular çoğunlukla nonspesifiktir. Ateş dışında halsizlik, iştahsızlık, eklem ağrıları gibi şikâyetlere sık rastlanır. Nonspesifik bulgular nedeniyle tanının geciktiği durumlarda, immünokompleks oluşumuna bağlı olarak, nefrit ve vaskülit gelişebilmektedir. Buna bağlı olarak nefritik (hipertansiyon, hematüri, ödem vb.) ve vaskülitik (döküntü vb.) bulgulara rastlanabilmektedir.47 Kompleman düzeyi düşüklüğü şant nefriti tanısında önemlidir. Şant çıkarmak renal sonuçlar ve prognoz üzerinde olumlu etkide bulunur. Renal yetmezlik,endokardit bu tip şantın enfeksiyonunda rastlanabilecek komplikasyonlardır. Seröz boşluklarda sonlanan şantların enfeksiyonunda serözit (peritonit, plörit vb.) bulguları görülür. VP şantlarda ateş, karın ağrısı, bulantı, kusma, iştahsızlık gibi peritonit bulgularının görülmesi şant enfeksiyonunu düşündürmelidir. Bulguların bazı vakalarda distansiyon ve dispepsi gibi nonspesifik bulgularla sınırlı olması tanıyı geciktirebilir. Olgular şant disfonksiyonu şeklinde prezente olabilirler ancak şant disfonksiyonu ile başvuran olguların %29’unda kültürlerde üreme (kültür pozitif) saptanmıştır. Yenidoğanlarda apne epizotları, anemi, hepatosplenomegali ve boyunda sertlik ile ortaya çıkar. Stafilokok epidermitis enfeksiyonları daha yavaş gelişir. Gram negatif basil enfeksiyonları genellikle daha şiddetlidir; batın bulguları 3. Şant sistemindeki cildin ayrışması sonucu şant sistemine mikroorganizmanın yerleşmesi: Enfeksiyon cerrahi olarak kazanılabilir veya sıklıkla infant veya çocuklarda görüldüğü gibi açık yaranın kalınması sonucu gelişebilir. Hareketsiz (inmobil veya debil) kişilerde şant sistemi üzerinde dekübit yaraları gelişebilir. 4. şantın cerrahi sırasında kolonizasyonu: en sık görülen mekanizmadır. ŞANT ENFEKSIYON RISKINI ARTTIRAN FAKTÖRLER 1. Yaş; pek çok çalışmada küçük yaş yüksek risk olarak sunulmuştur.14,21,41,42 Düşük doğum ağırlıklı infantlarda immünoloji, nutrisyonel ve özellikle bakteryel faktörlerle ilgili olarak risk yüksektir. Preterm infantlarda şant enfeksiyonu riski %33, term bebeklerde ise %25’ler civarındadır. Ayrıca preterm bebekler termlere oranla daha uzun süre hastanede yattıklarından, spesifik hastane mikroorganizmalarıyla kolonizasyon riskleri daha fazladır.43 2. Hidrosefalinin etiyolojisi 3. Cildin durumu 4. Şant revizyonu 5. Şant tipi; VA şantlar daha fazla riskli 6. Sistemik enfeksiyonun eşlik etmesi 7. Uzamış cerrahi prosedür 8. Deneyim ve cerrahi prosedür 9. Deri bütünlüğünün bozulması, flora veya enfeksiyon varlığı Turkiye Klinikleri J Neurosurg-Special Topics 2015;5(1) 72 Celal BAĞDATOĞLU ve ark. ŞANT ENFEKSİYONLARI mantar ve anaeroblara yönelik ilgili kültürler uygulanmalıdır. Kültür için örnek alınmadan önce antiyotik tedavisinin başlanmaması pozitif kültür için önemlidir. Şant enfeksiyonunu şüphesi varsa iyi bir anamnez (otitis media özellikle meningomyeloselli hastalar ve üriner enfeksiyonlu hastalar tabloyu taklit eder) ve fizik muayene gereklidir. Abdominal pseudokistin açıklanmayan abdominal bulguları varlığında BBT, MRI ya da ultrasonografi (USG) ile ankistik ve/veya enfekte distal katater ucu ortaya konabilir. belirgindir; temel klinik bulgu ateş olup intermittan ve düşük seyreder. Dökümente edilen şant enfeksiyonu olan hastaların %48’de ateşin %69’unda baş ağrısının ve %76’da cilt enfeksiyonu bulgusunun olmadığı gösterilmiştir.48 Bu nedenle ateşin olmaması şant enfeksiyonu tanısını dışlatmaz. Yenidoğanlar irritabilite ve beslenmede azalma ile klinik verebilirler. Büyük çocuklar ise özgül olmayan abdominal yakınmalar, duygusal değişiklikler, yiyecek, oyuna ve okula ilgide azal- ma ile klinik bulgu verebilirler. Wang ve ark., ateş ve şuur bulanıklığının daha çok erişkinlerde, şuur bulanıklığı ve abdominal semptomların ise daha çok pediatrik yaş grubunda izlendiğini belirtmişlerdir.49 Abdominal pseudokist VP şantın bir komplikasyonu olup şant obstruksiyonuna ait bulgulara, abdominal kitlelere veya nadiren akut batın tablosuna neden olabilirler. Menenjit yada ventriküliti olan hastalarda genellikle ateşli bir tablo, başağrısı yada irritabilite ve sıklıkla bir miktar ense sertliği vardır. Yara yeri enfeksiyonuna bağlı olarak genellikle ateş, insizyon alanında yada şant trasesi boyunca kızarıklık, artan ve insizyondan çıkan pürülan akıntı ile karakteristiktir. Mantar enfeksiyonlarının nadirdir ve kliniği sinsi seyir izleyebilir. Geniş spektrumlu antibiyotik kullanımının kandida menenjit riskini arttırdığı düşünülmekte olup inatçı Fenerli dalgalanmalar durumunda fungal enfeksiyon akla gelmelidir.50 DİYAGNOSTİK TESTLER WBC şant enfeksiyonlarının 1/4’ünde 10.000’nin altındadır. 1/3’ünde ise 20.000’nin üzerindedir. BOS’un mikrobiyolojik incelemesi oldukça değerlidir. Klinik ve diğer laboratuar bulguları destekliyorsa BOS’da üreyen miktoorganizma etkendir ancak diğer bulgular desteklemiyorsa kontaminasyon düşünülmeli ve BOS kültürü yeniden yapılmalıdır. Eğer aynı etken tekrarlanan kültürde yeniden ürüyorsa enfeksiyon olarak değerlendirilir. Ayrıca BOS kültürü ile birlikte gram boyama mutlaka yapılmalı ve kültürde üreyen mikroorganizma gram incelemede de saptanıyorsa kontaminasyon ihtimali oldukça az demektir. Gram boyama olguların yaklaşık %50’sinde pozitif olabilir. BOS’ta beyaz küre genellikle 100 hücrenine altındadır. BOS’ta protein çoğunlukla yüksek değildir, glukoz düşük veya normal olabilir. Şant enfeksiyonunda BOS’da hafif-orta derecede polimorfonükleer lökosit artışı izlenir. BOS kültürleri olguların %40’ında negatiftir (eğer WBC 20.000’nin üzerinde ise daha yüksek oranda kültür pozitifliği görülebilir). BOS’ta eozinofilinin toplam beyaz hücre sayısının %7’sinden fazla olması yine şant enfeksiyonunun önemli bir göstergesidir.52 Şant aspirasyonu şant enfeksiyonunda %95 gibi yüksek bir tanı değerine sahiptir ve oldukça emniyetlidir.15,53 Aspirasyon ciddi bir aseptik teknikle yapılmalı ve şant sistemi kontamine edilmemelidir. Lumboperitoneal (LP) ya da Ventriküler ponksiyon daha az tanı değerine sahiptir (%7 ile 26 arası). LP yapılması genelde önerilmez çünkü obstrüktif hidrosefali ile birlikte çalışmayan bir şant varsa zararlı sonuçlar doğabilir. ASO ve CRP (1200 üniteye kadar çıkabilir) artışı şant enfeksiyonuna özgü olmayıp destekleyici bir testtir. Şant yerleştirilmesini takiben yüksek kalan serum CRP seviyesi şant enfeksiyonu varlığı ile güçlü bir korelasyon göstermektedir.22 ŞANT ENFEKSİYONUNUN TANISI Enfeksiyon bulguları belirgin olmadan da şant enfeksiyonu varolabilir. Bir kısım hastada şant malfonksiyonu tablosu ile karşımıza gelmektedir. Ateş, lökositoz gibi enfeksiyon belirtilerini açıklayacak bir odak saptanmamışsa şant rezervuarı ponksiyone edilerek alınan BOS rutin biyokimyasal incelemeler yanında mutlaka kültürede gönderilmelidir. Malfonksiyon ile başvuran hastada bilgisayarlı beyin tomografisi (BBT) (enfeksiyon düşünülüyorsa kontrastı BBT) ve batın yakınmaları olanlarda batın ultrasonografisi yapılmalıdır. Bebeklerde yakınmalarını dile getiremedikleri için batın ultrasonografisi batın ile ilgili yakınma olsun olmasın rutin olarak yapılmalıdır. Batında lokalize sıvı yada pseudokist aksi kanıtlanana kadar şant enfeksiyonu gibi tedavi edilmelidir. Tüm şant uygulamalarında BOS örneği alınmalı ve çıkarılan şantın proximal ve distal uçları ayrı ayrı kültüre gönderilmelidir (örnek alınma sırasında BOS basıncıda değerlendirilmelidir). Ayrıca biyokimyasal inceleme ve kültür içinde BOS ÖRNEĞİ gönderilmelidir. Younger ve ark.na göre şant enfeksiyonu; BOS ve şant materyal kültür sonuçlarının pozitif olması veya bir pozitif kültürle birlikte gram boyamasınında pozitifliğidir.51 Rutin kültürlerde üreme olmadığında eğer şüphe kuvvetli ise ŞANT ENFEKSİYONUNU DEĞERLENDİRME Şant enfeksiyonunu düşündürecek semptom ve bulguların varlığında; başka bir odak olabileceği düşünülmeli. Turkiye Klinikleri J Neurosurg-Special Topics 2015;5(1) 73 Celal BAĞDATOĞLU ve ark. ŞANT ENFEKSİYONLARI niyle rifampisin tedaviye eklenmelidir.60 Gram-pozitif mikroorganizmalara karşı etkinliği olan kloramfenikol, klindamisin, ko-trimaksazol, linezolid ve kinupristin/dalfopristin ile tedavi edilmiş vakalar bildirilse de ilk seçenek antibiyotik olarak ele alınmamalıdırlar.55,61-63 Gram-negatif bakterilerin etken olduğu şant enfeksiyonlarında, pürülan menenjitlerde olduğu üzere seftriakson, sefotaksim, seftazidim, sefepim, meropenem gibi BOS geçişi iyi düzeyde olan antibiyotiklerden biri seçilmelidir.55,64,65 Çoğunlukla mikrobiyolojik verilere göre düzenlenen tedaviler dışında, ampirik tedavinin gerektiği durumlarda vankomisin ile Gram-negatif etkinliği olan antibiyotik birlikte başlanmalıdır. Antibiyotiğin BOS’a geçiş oranını belirleyen en önemli etkenlerden biri meninkslerdeki inflamasyon şiddetidir. şant enfeksiyonlarında meninks inflamasyon şiddeti bakteriyel menenjitlere kıyasla düşük düzeylerdedir. Bu nedenle, antibiyotiklerin BOS’taki düzeyleri yetersiz kalabilmektedir. Bu yetersizliği aşmak için antibiyotiğin parenteral kullanımına ek olarak intraventriküler uygulanması da söz konusu olabilmektedir.54,55,59,66 Ancak intratekal yolun rutin kullanımı tartışmalıdır. Bu endikasyon için intratekal uygulanan antibiyotiklerin Amerikan Gıda ve İlaç Kurumu (FDA) onayı yoktur. İntraventriküler yolla uygulanacak antibiyotiğin (vankomisin gibi) sterilizasyonu sağlamak için BOS’taki düzeyinin, etken mikroorganizmanın minimal inhibitör konsantrasyonunun (MiK) en az 10-20 katı olması gereklidir. Kinupristin/dalfopristin, teikoplanin, polimiksin B, kolistin, amfoterisin B intraventriküler yolla tedavide başarı ile kullanılabildiği bildirilen diğer antibiyotiklerdir.67 Nörotoksik etkiler (konvülziyon, ateş, koma, myoklonus ve BOS pleositozu) nedeniyle penisilin ve sefalosporinler bu yolla uygulanmamalıdır. Antibiyotik tedavi süresini BOS profili, etken mikroorganizma ve şantın çıkarılma durumu belirlemektedir. Etkenin koagülaz negatif stafilokok (KNS) olarak saptandığı enfeksiyonlarda, şant çıkarıldıktan sonra ortalama 7 günlük tedavi süresi yeterlidir. BOS bulgularının başından itibaren normal olduğu şartlarda bu süre daha kısa (3-5 gün) tutulabilir. Daha virülan mikroorganizmaların yol açtığı enfeksiyonlarda ve şantın çıkarılamadığı durumlarda tedavi süreleri daha uzun tutulmalıdır. Bu şartlarda tedavi BOS steril olduktan sonra 10-14 gün kadar sürdürülmelidir.66,68,69 1. Hasta ailesini içeren viral sendromların mevcudiyeti araştırılmalı, 2. Gastrointestinal kaynaklı belirtiler (örn; akut gastroenterit); sıklıkla diare ile birliktedirler. Diare sıklıkla şant enfeksiyonunu ekarte eder. 3. Orta kulak iltihabı 4. Tonsilit/farenjit 5. Apandisit (peritoneal inflamasyonu BOS boşalımını engelleyebilir) 6. ÜSYE (üst solunum yolu enfeksiyonu) 7. İYE (idrar yolları enfeksiyonu) 8. Pnömoni, açısından hasta değerlendirilmeli, iyi bir öykü, fizik muayene (meningeal irritasyon bulgusu, batında hassasiyet, rezervuarı yerinde ve şant trasesi boyunca kızarıklık-şişlik) ve kan kültürü, idrar kültürü, akciğer grafisi, rutin biyokimyasal ve hemoraji tetkikleri gibi laboratuar ve radyolojik incelemeler yapılmalıdır. KOMPLİKASYONLAR VP şanta bağlı; ventrikülit, pseudokist akut batın gibi abdominal komplikasyonlar, VA şanta bağlı; bakteriyemi nedeniyle gelişen şant nefriti, endokardit, cor pulmonale, ventriküloplevral şanta bağlı; ampiyem ve geç kalınmış ya da etkin tedavi edilmemiş olgularda serebral abse. ŞANT ENFEKSİYONLARININ TEDAVİSİ Şant enfeksiyonlarının tedavisinde altın standard antibiyotik tedavisi ile birlikte şantın revizyonudur.54-56 Sadece antibiyotik ile sınırlanan tedavilerde başarısızlık ve nüks olasılığı daha yüksektir. şant revizyonunun iki aşamada gerçekleştirilmesi tedavi başarısını artırmaktadır. infekte şantın çıkarılmasının ardından BOS steril olana kadar antibiyotik tedavisi ve sonrasında yeni şant takılması önerilen yaklaşımdır.57-59 Yeni şant takılana kadar geçen sürede hastaya eksternal drenaj uygulanmalıdır.54 Bu enfeksiyonların tedavisindeki antibiyoterapi yaklaşımı bakteriyel menenjitlere benzemektedir ve başlangıç tedavide gram pozitif mikroorganizmalar hedeflenmelidir. Antibiyotik seçimini Gram-giemsa boyama, kültür ve duyarlılık sonuçları belirlemelidir. Seçilecek antibiyotiğin BOS’a ulaşan düzeylerinin yeterli olması gerekmektedir. En sık saptanan etken olan stafilokokların tedavisindeki ilk seçenek antibiyotikler, metisilin duyarlılığına göre, vankomisin ya da nafsilin olmalıdır. Tıbbi nedenlerle şantın çıkarılamadığı veya dirençli stafilokokların etken olduğu durumlarda, BOS geçişinin her şartta iyi olması, biyofilm ve içindeki mikroorganizmalara etki edebilmesi nede- Şant enfeksiyonlarının tedavisinde uygulanan yöntemler; 1. Tıbbi tedavi 2. Tıbbi ve cerrahi tedavi a- Yeni şant takılması; aynı operasyonda şantın çıkarılıp hemen yeni bir şant takılması Turkiye Klinikleri J Neurosurg-Special Topics 2015;5(1) 74 Celal BAĞDATOĞLU ve ark. ŞANT ENFEKSİYONLARI mak amacıyla antibiyotik (rifampisin-klindamisin (R-K) veya rifampin-minosiklin) emdirilmiş şantlar (AES) geliştirilmiştir. R-K emdirilmiş şantlar, %15 klindamisin ve %0,54 rifampisin içermekte olup her iki antibiyotikte tüm kataterlerin yüzeyinde bulunmaktadır. AES’ın hem iç yüzeylerinde hem de dış katater duvarında bakteri kolonizasyonu 28 gün boyunca önleyecek antibiyotik konsantrasyonu olduğu bildirilmektedir.81 AES enfeksiyon azaltıp azaltmadığı ile ilgili olarak çelişkili çalışmalar mevcuttur.82-84 b- Gecikmiş şant replasmanı; şantın çıkarılıp bir süre bekledikten sonra yeni bir şantın takılması c- Ekstraventriküler drenaj (EVD) ya da şant eksternalizasyonu; şantın çıkarılmasıyla birlikte EVD takılması ya da şant eksternalizasyonu uygulanması ve antibiyotik tedavisinden sonra yeniden şant takılması. Sadece antibiyotik ile sınırlanan tedavilerde başarısızlık ve nüx olasılığı daha yüksektir. Şant enfeksiyonu tedavisinde antibiyotik tedavisi ile birlikte altın standart olan şantın revizyonunun 2 aşamada gerçekleştirilmesi tedavi başarısını arttırmaktadır.39,70,71 İnfekte şantın çıkarılmasının ardından BOS steril olana kadar antibiyotik tedavisi ve sonrasında yeni şant takılması önerilen yaklaşımdır.57,59 Bir EVD süresinden sonra şantın yeniden yerleştirilmesi sırasında EVD genellikle 8-12 saat arasında klemplenir (eğer hasta bunu tolere edebiliyorsa). Böylece ventriküllerin genişlemesine izin verilerek ventrikül içine katater konulması kolaylaşır. CERRAHİ ASEPSİ Yapışkan dreypler postoperatif yara enfeksiyon oranınını azaltmamaktadır.85-87 Traş bıçakları elektron mikroskopisi ile görülen değişen miktarlarda cilt kesileri yaptığından cildin cerrahiden birkaç saat içinde jiletle traşlanması enfeksiyonun artmış insidansıyla belirgin biçimde ilişkilidir.85 Preoperatif iyot içeren ajanlarla cildin hazırlanması, geçici cilt florasını azaltmakta fakat tamamen elimine etmemektedir. Ter ve yağ glandları çıkış kanallarında ve kıl foliküllerinin kenarında kalıcı flora yeniden ortaya çıkmaktadır.23,77 YALNIZCA ANTIBIYOTİK TEDAVİSİNİN İSTİSNALARI Genel popülasyonda menenjite neden olan ve hidrosefalik ya da şantlı hastayı etkileyen ve şant yerleştirilmesi sırasında teşhis edilen organizmalar yalnızca antibiyotik uygulaması ile tedavi edilebilirler. Hemafilus influenza enfeksiyonunda, meningokoksik menenjit ve gonokoksik menenjitte şant varlığında, literatürde çok iyi belgelenmiş olmamakla birlikte hidrosefalisi olan ve pnömokoksik menenjiti olan hastalar yalnızca antibiyotik ile başarılı bir şekilde tedavi edilebilmiştir.72-77 ANTİMİKROBİYAL PROFİLAKSİ Profilaktik antibiyotiklerin belirli cerrahi işlemlerde cerrahi inplantlar dahil, belirgin faydası gösterilmişken, şant cerrahisinde etkinliğini gösteren inandırıcı bir klinik çalışma mevcut değildir.88 Lanfley ve ark. 12 çalışmada toplam 1359 hastanın metaanalizini yaparak profilaktik antibiyotiklerle tedavi edilen hastalarda %50 oranında belirgin bir risk azalması bulmuşlardır.89 Haines, 9 kontrollü çalışmanın sonuçlarını kombine etmiş ve antibiyotik profilaksisinin enfeksiyon oranlarında belirgin bir azalma yaptığının sonucuna varmıştır. Cerrahi profilaksilerin çoğunda ilk tercih sefazolin olmaktadır. Metisilin direncinin yüksek olduğu merkezlerde profilaktik ajan olarak vankomisin seçilmelidir. Herhangi bir etki için antibiyotik dokuda, kontaminasyondan önce belirli bir düzeyde bulunmalıdır.23 Bu nedenle ilaç operasyonun başlayacağı süreye mümkün olduğu kadar yakın zamanda ve yeterli doku düzeyine ulaşacak şekilde verilmelidir. ŞANT ENFEKSİYONUNDAN KORUNMA Cerrahi alan enfeksiyonlarını önlemek için gerekli prensiplere maksimum düzeyde uyulması şant enfeksiyonlarından korunmanın en etkin yoludur. Şant cerrahisi temiz bir girişim olmasına karşın antibiyotik profilaksisi bircok otorite tarafından önerilmektedir.78 Bu konuda kontrollü çalışmalar olmamasına karşın gözleme dayalı çalışmaların metaanalizi profilaksiyi desteklemektedir.79,80 Cerrahi profilaksilerin büyük çoğunluğunda olduğu üzere sefazolin ilk tercih antibiyotiktir. Metisilin direncinin yüksek olduğu merkezlerde vankomisin profilaktik ajan olarak tercih edilmelidir. Son yıllarda ciltten kazanılan mikroorganizmaların eradikasyonunu sağla- Turkiye Klinikleri J Neurosurg-Special Topics 2015;5(1) 75 Celal BAĞDATOĞLU ve ark. 1. 2. 3. 4. 5. 6. 7. 8. 9. Choux M, Gentori L, Lang D, Lena G. Shunt implantation: reducing the incidence of shunt infection. J Neurosurg 1992;77(6):875-80. Chapman PH. Shunt infections:prevention and treatment. Clin Neurosurg 1985;32:625-64. Walters BC. Cerebrospinal fluid shunt İnfections. Neurosurg Clin N Am 1992;3(2):387401. McLane DG, Cyszevski D, Raimondi AJ, Sommers RC. Central nervous system infections as a limiting factor in the intelligence of children with myelomeningocele. Pediatrics 1982;70(3):338-42. Shurtleff DB, Christie D, Foltz EL. Ventriculoaurolostomy-associated infections a 12 year study. J Neurosurg 1971;35(6):686-94. Pople IK, Bayston R, Hayward RD. Infection of cerebrospinal fluid shunts in infants: a study of etiological factors. J Neurosurg 1992;77(1):29-36. Renier D, Lacombe J, Pierre-Kahn A, SainteRose C, Hirsch JF. Factors causing acute shunt infection. Computer analysis of 1174 operations. J Neurosurg 1984;61(6):1072-8. Bayston R. Infections in Hydrocephalus Shunts. In: Cohen J, Powderly WG, eds. Infectious Diseases. Mosby; 2004. p.317-20. Hoffman HJ, Hendrick EB, Humphreys RP. Management of hydrocephalus. Monogry Neurol Sci Basel: Karger 1973;8:21-25. 10. Keucher TR, Mealey J Jr. Long term results after ventriculoatrial and ventriculoperitoneal shunting for infantile hydrocephalus. J Neurosurg 1979;50(2):179-86. 11. Shurtleff DB, Christie D, Foltz EL. Ventriculoaurolostomy-associated infection a 12 year study. J Neurosurg 1979;50(2):179-86. 12. Schoenbaum SC, Gardner P, Shillito J. Infections of cerebrospinal fluid shunts: epidemiology, clinical manifestations, and therapy. J Infect Dis 1975;131(5):543-52. 13. Walters BC. Cerebrospinal fluid shunt infections. Neurosurg Clin N Am 1992;3(2):387401. 14. Renier D, Lacombe J, Pierre-Kahn A, SainteRose C, Hirsch JF. Factors causing acute shunt infection. J Neurosurg. 1984;61(6): 1072-8. 15. Schoenbaum SC, Gardner P, Shillito J. Infections of cerebrospinal fluid shunts: epidemiology, clinical manifestations, and therapy. J Infect Dis 1975;131(5):543-52. 16. Walters BC, Hoffman HJ, Hendrick EB, Humphreys RP. Cerebrospinal fluid shunt infection. İnfluences on initial management and subsequent outcome. J Neurosurg 1984;60 (5):1014-21. ŞANT ENFEKSİYONLARI KAYNAKLAR 17. Bayston R. A prospective randomised controlled trial of antimicrobial prophylaxis in hydrocephalus shunt surgery. Z Kinderchir 1990;45(Suppl I):5-7. 18. Bloomstedt GC. Results of trimethoprim-sulfamethoxazole prophylaxis in ventriculostomy and shunting procedures. A double-blind randomized trial. J Neurosurg 1985;62(5):694-7. 19. Pople IK, Bayston R, Hayward RD. Infection of cerebrospinal fluid shunts in infants: a study of etiological factors. J Neurosurg 1992;77(1): 29-36. 20. Shapiro S, Boaz J, Kleiman M, Kalsbeck J, Mealey J. Origin of organisms infecting ventricular shunts. Neurosurgery 1988;22(5):86872. 21. George R, Librock L, Epstein M. Long-term analysis of cerebrospinal fluid shunt infections. A 25-year experience. J Neurosurg 1979;51 (6):804-11. 22. Bayston R. Hydrocephalus shunt infections. London: Chapman&Hall; 1989. p.12-57. aeruginosa growing as a biofilm on urinary catheter material. Antimicrob Agents Chemother 1985;27(4):619-24. 32. Nickel JC, Ruseska I, Whitfield C, Marrie TJ, Costerton JW. Antibiotic resistance of pseudomonas aeruginosa colonizing a urinary catheter in vivo. Eur J Clin Microbiol 1985;4(2): 213-8. 33. Luthardt TH. Bacterial infections in ventriculoauricular shunt systems. Dev Med Child Neurol 1970;22(Suppl)105-7. 34. Diaz-Mitoma F, Harding GK, Hoban DJ, Roberts RS, Low DE. Clinical significance of a test for slime production in venriculoperitoneal shunt İnfections caused by coagulase-negative staphylococci. J Infect Dis 1987;156(4): 555-60. 35. James HE, Walsh JW, Wilson HD, Connor JD, Bean JR, Tibbs PA. Prospective randomised study of therapy in cerebrospinal fluid shunt infection. Neurosurgery 1980;7(5):459-63. 23. Bayston R, Lari J. A study of the sources of infection in colonized shunts. Dev Med Child Neuro 1974;16(Suppl):17-22. 36. Shurtleff DB, Foltz EL, Weeks RD, Loesser J. Therapy of staphylococcus epidermidis: infections associated with cerebrospinal fluid shunts. Pediatrics 1974;53(1):55-62. 25. Christensen GD, Simpson WA, Bisno AL, Beachey EH. Adherence of slime-producing strains of Staphylococcus epidermidis to smooth surfaces. Infect Immun 1982;;37(1): 318-26. 38. O'Brein M, Parent A, Davis B. Management of ventricular shunt infections. Childs Brain 1979;5(3):304-9. 24. Quie PG, Belani KK. Coagulase-negative staphylococcal adhe- rence and persistence. J Infect Dis 1987;156(4):543-7. 26. Tunkel A, Kaufman B. Cerebrospinal fluid shunt infections. In: Mandell G, Bennett J, Dolin R, eds. Principles and Practise of Infectious Disease. Churchill Livingstone: Elsevier; 2005. p.1126-30. 27. Baltimore RS, Mitchell M. Immunologic investigations of mucoid strains of Pseudomonas aeruginosa: comparison of susceptibility to opsonic antibody in mucoid and nonmucoid strains. J Infect Dis 1980;141(2):238-47. 28. Peterson PK, Wilkinson BJ, Kim Y, Schmeling D, Quie PG. Influence of encapsulation on staphylococcal opsonization and phagocytosis by human polymorphonuclear leukocytes. Infect Immun 1978;19(3):943-9. 29. Whitnak E, Bisno AL, Beachey EH. Hyaluronate capsule prevents attachment of group A streptococci to mouse peritoneal macrophages. Infect Immun 1981;31(3):985-91. 30. Govan JR. Mucoid strains of pseudomonas aeruginosa: the İnfluence of culture medium on stability of mucus production. J Med Microbiol 1975;8(4):513-22. 31. Nickel JC, Ruseska I, Costerton JW. Tobramycin resistance of cells of Pseudomonas Turkiye Klinikleri J Neurosurg-Special Topics 2015;5(1) 76 37. Blount JP, Campbell JA, Haines SJ. Complications in ventricular cerebrospinal fluid shunting. Neurosurg Clin N Am 1993;4(4):63356. 39. Detwiler PW, Porter RW, Rekate LH. Hydrocephalus-clinical features and management. In: Choux M, Di Rocco C, Hockley AD, eds. Pediatric Neurosurgery. 1st ed. London: Churchill Livingstone; 1999. p.253-71. 40. Hanekom WA, Yogev R. Cerebrospinal fluid snunt infections. Adv Pediatr Infect Dis 1996;11:29-54. 41. Ammirati M, Raimondi AJ. Cerebrospinal fluid shunt infections in children. A study on the relationship between the etiology of hydrocephalus, age at the time of shunt placement, and infection rate. Childs Nerv Syst 1987;3 (2):106-9. 42. Haines SJ, Taylor F. Propylactic methicillin for shunt operations: effects on incidence of shunt malfunction and infection. Childs Brain 1982;9(1):10-22. 43. Pople IK, Bayston R, Hayward RD. Infection of cerebrospinal fluid shunts in infants: a study of etiological factors. J Neurosurg 1992;77(1): 29-36. 44. Kontny U, Hofling B, Gutjahr P, Voth D, Schwarz M, Schmitt HJ. CSF shunt infections in children. Infection 1993;21(2):89-92. Celal BAĞDATOĞLU ve ark. 45. Enger PØ, Svendsen F, Wester K. CSF shunt infections in child- ren: experiences from a population-based study. Acta Neurochir (Wien) 2003;145(4):243-8 46. Brydon HL, Hayward R, Harkness W, Bayston R. Does cerebros- pinal fluid protein increase the risk of shunt complications? Br J Neurosurg 1996;10(3):267-73. 47. Bayston R. The clinical spectrum of shunt nephritis. Nephrol Diaları Transplant 1998;13 (3):810. 48. Odio C, McCracken GH, Nelson JD. CSF shunt infections in pediatrics: a seven year experience. Am J Dis Child 1984;138(12):1103-8. 49. Wang KC, Lee HJ, Sung JN, Cho BK. Cerebrospinal fluid shunt infection in children: efficiency of management protocol, rate of persistent shunt colonization, and significance of 'off-antibiotics' trial. Childs Nerv Syst 1999;15(1):38-43 50. Makhoul IR, Kassis I, Smolkin T, Tamir A, Sujov P. Review of 49 neonates with acquired fungal sepsis: further characterization. Pediatrics 2001;107(1):61-6. 51. Younger JJ, Christensen GD, Bartley DL, Simmons JC, Barrett FF. Coagulase negative staphylococci isolated from cerebrospinal fluid shunts: importance of slime production and shunt removal to clinical outcome. J Infect Dis 1987;156(4):548-54. 52. Tung H, Raffel C, McComb JG. Ventricular cerebrospinal fluid eosinophilia in children with ventriculoperitoneal shunts. J Neurosurg 1991;75(4):541-4. 53. Noetzel MJ, Baker RP. Shunt fluid examination: riske and benefits in the evaluation of shunt malfunction and infection. J Neurosurg 1984;61(2):328-32. 54. Sadigh M, Gardner P, Leipzig T. Central nervous system shunt infections. In: Gorbach S, Bartlett J, Blacklow N, eds. Infectious Diseases. 3rd ed. Philadelphia: Lippincott, Williams&Wilkins, 2004. p.1303-7. 55. Tunkel A, Kaufman B. Cerebrospinal fluid shunt infections. In: Mandell GL, Bennett JE, Dolin R, eds. Mandell, Douglas and Bennet’s Principles and Practice of Infectious Diseases. 7th ed. New York: Elsevier Churchill Livingstone; 2010. p.1126-31. 56. Anderson EJ, Yogev R. A rational approach to the management of ventricular shunt infections. Pediatr Infect Dis J 2005;24(6):557-8. 57. Schreffler RT, Schreffler AJ, Wittler RR. Treatment of cerebrospi- nal fluid shunt infections: a decision analysis. Pediatr Infect Dis J 2002;21(7):632-6. 58. Whitehead WE, Kestle JR. The treatment of cerebrospinal fluid shunt infections. Results from a practice survey of the American Society of Pediatric Neurosurgeons. Pediatr Neurosurg 2001;35(4):205-10. ŞANT ENFEKSİYONLARI 59. Arnell K, Enblad P, Wester T, Sjölin J. Treatment of cerebrospinal fluid shunt infections in children using systemic and intraventricular antibiotic therapy in combination with externalization of the ventricular catheter: efficacy in 34 consecutively treated infections. J Neurosurg 2007;107(Suppl 3):213-9. 60. Bayston R. Rifampin for CSF shunt infection. J Pediatr 1980;96(4):785-6. 61. Castro P, Soriano A, Escrich C, Villalba G, Sarasa M, Mensa J. Linezolid treatment of ventriculoperitoneal shunt infection without implant removal. Eur J Clin Microbiol Infect Dis 2005;24(9):603-6. 62. Gill CJ, Murphy MA, Hamer DH. Treatment of Staphylococcus epidermidis ventriculo-peritoneal shunt infection with linezolid. J Infect 2002;45(2):129-32. 63. Yilmaz A, Dalgic N, Müslüman M, Sancar M, Colak I, Aydin Y. Linezolid treatment of shuntrelated cerebrospinal fluid infections in children. J Neurosurg Pediatr 2010;5(5):443-8. 64. Orvin K, Bilavsky E, Weiner E, Shouval DS, Amir J. Successful antibiotic eradication of Streptococcus pneumoniae infection of a ventriculoatrial shunt. Int J Infect Dis 2009;13(3): e101-3. 65. Hellbusch LC, Penn RG. Treatment of haemophilus influenzae type B cerebrospinal fluid shunt infection with ceftriaxone and rifampin: case report. Nebr Med J 1995;80(2):27-9. 66. Bayston R. Epidemiology, diagnosis, treatment, and prevention of cerebrospinal fluid shunt infections. Neurosurg Clin N Am 2001;12(4):703-8. 67. Tush GM, Huneycutt S, Phillips A, Ward JD. Intraventricular quinupristin/dalfopristin for the treatment of vancomycin-resistant Enterococcus faecium shunt infection. Clin Infect Dis 1998;26(6):1460-1. 68. Arthur AS, Whitehead WE, Kestle JR. Duration of antibiotic therapy for the treatment of shunt infection: a surgeon and patient survey. Pediatr Neurosurg 2002;36(5):256-9. 69. James HE, Bradley JS. Aggressive management of shunt infection: combined intravenous and intraventricular antibiotic therapy for twelve or less days. Pediatr Neurosurg 2008;44(2):104-11. 70. Milhorat TH. Hydrocephalus: Pathophysiology and Clinical Features. In: Wilkins RH, Rengachary S, eds. Neurosurgery. Baltimore: Mc Graw-Hill Company; 1996. p.3625-31. 71. Vanaclocha V, Sáiz-Sapena N, Leiva J. Shunt malfunction in relation to shunt infection. Acta Neurochir (Wien) 1996;138(7):829-34. 72. Lerman SJ. Haemophilus influenzae infections of cerebrospinal fluid shunts. Report of two cases. J Neurosurg 1981;54(2):261-3. 73. Patriarca PA, Lauer BA. Ventriculoperitoneal shunt-associated infection due to haemophilus influenzae. Pediatr 1980;65(5):1007-9. Turkiye Klinikleri J Neurosurg-Special Topics 2015;5(1) 77 74. Petrak RM, Pottage JC Jr, Harris AA, Levin S. Haemophilus influenzae meningitis in the presence of a cerebrospinal fluid shunt. Neurosurgery 1986;18(1):79-81. 75. Rennels MB, Wald ER. Treatment of haemophilus influenzae type B meningitis in children with cerebrospinal fluid shunts. J Pediatr 1980;97(3):424-6. 76. Leggiadro RJ, Atluru VL, Katz SP. Meningococcal meningitis associated with cerebrospinal fluid shunts. Pediatr Infect Dis 1984;3(5):489-90. 77. Klein DM. Shunt infections. In: Scott RM, ed. Hydrocephalus: concepts in neurosurgery. Baltimore: Williams and Wilkins; 1990. p.88. 78. Ratilal B, Costa J, Sampaio C. Antibiotic prophylaxis for surgical introduction of intracranial ventricular shunts. Cochrane Database Syst Rev 2006;25(1):CD004884. 79. Haines SJ, Walters BC. Antibiotic prophylaxis for cerebrospinal fluid shunts: a metanalysis. Neurosurgery 1994;34(1):87-92. 80. Langley JM, LeBlanc JC, Drake J, Milner R. Efficacy of antimicrobial prophylaxis in placement of cerebrospinal fluid shunts: metaanalysis. Clin Infect Dis 1993;17(1):98-103. 81. Bayston R, Lambert E. Duration of protective activity of cerebrospinal fluid shunt catheters impregnated with antimicrobial agents to prevent bacterial catheter-related infection. J Neurosurg 1997;87(2):247-51. 82. Hayhurst C, Cooke R, Williams D, Kandasamy J, O'Brien DF, Mallucci CL. The impact of antibiotic-impregnated catheters on shunt infection in children and neonates. Childs Nerv Syst 2008;24(5):557-62. 83. Kan P, Kesstle J. Lack of efficacy of antibioticimpregnated shunt systems in preventing shunt infections in children. Childs Nerv Syst 2007;23(7):773-7. 84. Ritz R, Roser F, Morgalla M, Dietz K, Tatagiba M, Will BE. Do antibiotic-impregnated shunts in hydrocephalus therapy reduce the risk of infection? An observational study in 258 patients. BMC Infect Dis 2007;7:38. 85. Cruse PJ, Foord R. The epidemiology of wound infection. Surg Clin North Am 1980;60(1):27-40. 86. Jackson DW, Pollock AV, Tindal DS. The value of a plastic adhesive drape in the prevention of wound infection. Br J Surg 1971;58(5):340-2. 87. Tabara Z, Forrest D. Colonisation of CSF shunts: preventive measures. Z Kinderchir 1982;37:156-7. 88. Sandusky WR. Use of prophylactic in surgical patients. Surg Clin North Am 1980;60(1):83-92. 89. Langley JM, LeBlanc JC, Drake J, Milner R. Efficacy of antimicrobial prophylaxis in cerebrospinal fluid shunt placement: a meta-analysis. Clin Infect Dis 1993;17(1):98-103.