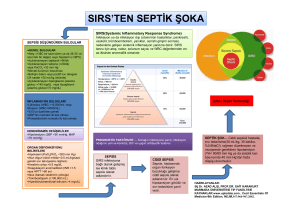
neonatal sepsisli hastalarda polimorfonükleer lökosit elastaz
advertisement

T.C Sağlık Bakanlığı Haseki Eğitim ve Araştırma Hastanesi Çocuk Sağlığı ve Hastalıkları Kliniği Şef : Prof. Dr. Murat Elevli NEONATAL SEPSİSLİ HASTALARDA POLİMORFONÜKLEER LÖKOSİT ELASTAZ DÜZEYLERİNİN DEĞERLENDİRİLMESİ ( Uzmanlık Tezi ) Dr. Müge Özay Payaslı İstanbul - 2007 1 KISALTMALAR C : Kompleman CRP : C reaktif protein CR : Kompleman reseptör EMR : Erken membran rüptürü fMLP : n-formyl-methionyl-leucyl-phenylalanine GH : Gestasyon haftası HLE : Human lökosit elastaz ICAM-I : İntraselüler adhezyon molekülü 1 I/T : İmmatür total nötrofil oranı Ig : İmmünglobulin INF : İnterferon IL : İnterlökin LPS : Lipopolisakkarit LT : Lökotrien MAPK : Mitojen aktive edici protein kinaz PAF : Trombosit aktive edici faktör PMNLE : Polimorfonükleer lökosit elastaz SPL-1 : Sekretuar lökoproteaz inhibitörü TDP : Taze donmuş plazma TGF : Transforming growth faktör TNF : Tümör nekroz faktör 2 İÇİNDEKİLER ÖNSÖZ………………………………………………………………………………. 1 GİRİŞ………………………………………………………………………………… 2 GENEL BİLGİLER YENİDOĞAN ENFEKSİYONLARI……………………………………….. 3-7 NEONATAL SEPSİS………………………………………………………… 8-25 POLİMORFONÜKLEER LÖKOSİT ELASTAZ…………………………. 26-33 MATERYAL VE METOD………………………………………………………….. 34-36 BULGULAR…………………………………………………………………………. 37-48 TARTIŞMA………………………………………………………………………….. 49-57 SONUÇLAR…………………………………………………………………………. 58 ÖZET………………………………………………………………………………… 59 SUMMARY………………………………………………………………………….. 60 KAYNAKLAR……………………………………………………………………….. 61-69 3 ÖNSÖZ Klinik Şefimiz olarak uzmanlık eğitimim boyunca yakın ilgi, destek ve anlayış gördüğüm, geniş bilgi ve deneyimlerinden yararlandığım, Haseki Eğitim ve Araştırma Hastanesi Çocuk Sağlığı ve Hastalıkları Kliniği Şefi Prof. Dr. Murat Elevli’ye içten teşekkürü bir borç bilir, saygılarımı sunarım. Tezimin yürütülmesinde bana yol gösteren, bilgi ve deneyimlerini esirgemeyen Uzmanımız Dr. Ayşe Ayaz Özkul’a, tezimin çalışılması esnasında yardımlarını esirgemeyen Türkiye Yüksek İhtisas Hastanesi Biyokimya ve Klinik Biyokimya Uzmanı Biyolog Selime Ayaz’a teşekkür ederim. Haseki Eğitim ve Araştırma Hastanesi Çocuk Kliniği’nde birlikte çalıştığım, Şef Yardımcımız Uz. Dr. Nilgün Selçuk’a; tüm uzmanlarımıza, asistanlık sürem boyunca sıcak bir çalışma ortamı paylaştığım ve değerli yardımlarını gördüğüm asistan arkadaşlarıma ve tezimin yazılmasında yardımını esirgemeyen sevgili eşime candan teşekkür ederim. Dr. Müge Özay Payaslı 1 GİRİŞ Yenidoğan sepsisi, yaşamın ilk 28 günü içinde ortaya çıkan ve sistemik belirtiler gösteren yaygın, bakteriyel bir enfeksiyondur (1-10). Sepsis sıklığı yenidoğanlarda 1000 canlı doğumda 1 ile 10 arasındadır (1,2,5,6). Mortalitesi %20-30 olan ve morbiditesi %30-50’ye ulaşan yenidoğan sepsisi, hem gelişmiş ülkelerde, hem de gelişmekte olan ülkelerde halen yenidoğan dönemindeki önemli bir mortalite ve morbidite nedenidir (1-5). Yenidoğan sepsisinde prognoz ve mortaliteyi etkileyen en önemli faktörlerden biri erken tanıdır (4,6,8). Günümüzde yenidoğan sepsisi tanısının mümkün olduğunca erken ve doğru olarak konulmasını sağlayabilecek tetkik yöntemleri araştırılmaktadır. Yenidoğan sepsisi tanısında kullanılacak testlerin özgünlük ve duyarlılığının, ayrıca negatif ve pozitif prediktif değerinin yüksek olması gerekir. Böylece enfeksiyon varlığında testin pozitif olması ve enfeksiyon yoksa negatif sonuç vermesi ile septik ve septik olmayan bebeğin ayırt edilmesi kolaylaşacaktır (8). Biz çalışmamızda Haseki Eğitim ve Araştırma Hastanesi Yenidoğan Servisinde yenidoğan sepsisi tanısı ile yatan 40 bebeği alarak, yenidoğan sepsisinin erken tanısının bir göstergesi olarak polimorfonükleer lökosit elastaz düzeylerini tayin ettik. Sepsisin tanısını koymada yararlandığımız klinik bulgular; CRP, I/T nötrofil oranı, lökosit sayısı, trombosit sayısı gibi bulguların PMNLE düzeyleri ile karşılaştırılmasını ve PMNLE düzeyinin bir tanı yöntemi olarak değerini araştırmayı amaçladık. 2 GENEL BİLGİLER YENİDOĞAN ENFEKSİYONLARI Enfeksiyonlar yenidoğan döneminde en önde gelen morbidite ve mortalite nedenini oluştururlar. Fetal yaşamda enfeksiyon sıklığı %2, yenidoğanlarda ilk ay içinde %10 dur (1-8). Yenidoğan enfeksiyonlarının özelliklerini belirleyen birçok faktör vardır. • Yenidoğan inutero, intrapartum veya postpartum dönemde çok sayıda ajanla enfekte olabilir. • Yenidoğanda immun sistemde yetersizlik olduğundan enfeksiyonlara yanıt düşüktür. • Birlikte olan hastalıklar genellikle neonatal enfeksiyonların tanı ve tedavisini güçleştirir. • Enfeksiyon hastalıkları çok değişken klinik tablolarla belirebilir. Bunların en hafif şekli subklinik enfeksiyondur. İntrauterin enfeksiyonlar doğumda veya daha sonra ortaya çıkabilen doğumsal malformasyonlara neden olabilirler ve bunlarla tanınabilirler (1). YENİDOĞAN İMMÜNİTESİ: Yenidoğanda immünolojik faktörlerin konsantrasyonlarının düşük ve immunolojik işlevlerin yetersiz olabileceği gösterilmiştir (4,8,9,10). Bu eksikliklere karşın obstetrik ve neonatal risk faktörleri olmadığında preterm ve miadında doğan yenidoğanlarda invaziv enfeksiyon oranı düşüktür (4,9-14). İmmunglobulinler: Genel olarak yenidoğanlarda Escherichia coli (E. coli) ve diğer enterobakterlere karşı antikor aracılığı ile koruma yetersizdir. Ig G: 11.GH’da sentezlenmeye başlar, plasentadan 20.GH’da aktif transportla geçer. Miadındaki yenidoğanda anneninkine benzerken preterm infantlarda düzeyi daha düşüktür. 3 Yenidoğanlarda yeterli özgül IgG antikoru varlığında antikorla korumanın mümkün olduğu enfeksiyonlara karşı korunma sağlanmış olur (örneğin Grup B streptococcus (GBS)) (24,8,15,16). Plazmadaki IgG’nin konakçı defansındaki yeri; bazı toksinleri direk bağlayarak nötralize etmesi, antijenle bağlandıktan sonra kompleman sistemini aktive etmesi, Fc fraksiyonu ile mononükleer ve polimorfonükleer lökosit hücre yüzeyindeki reseptörlerle etkileşerek mikroorganizma partiküllerinin fagositozunda rol almak şeklinde özetlenebilir (24,8,17,18). Ig M: 10-12.GH’da sentezlenmeye başlar. Materno-fetal geçişi yoktur. Yenidoğanlarda miktarı normalin 10’da biri kadardır. Enterik basillere karşı özgül bakterisidal ve opsonik antikorlar başlıca IgM sınıfındandır. IgM fetal ve neonatal konakçı defansında serumdan invazyon yapan mikroorganizmaların temizlenmesinde ve kompleman sisteminin aktivasyonunda önemli rol oynar (1,3,4,5-8,17,18). Ig A: Normalde plasentayı geçmez. Serum IgA doğumdan hemen sonra sentezlenmeye başlar ve bebek 4-5 aylık olunca saptanır. Salgısal IgA doğumu izleyerek birinci aydan itibaren belirir. Anne sütünde bol miktarda sekretuar IgA bulunur. Anne sütü ile beslenen yenidoğanların barsağında lokal bir koruyuculuk sağlayarak bakteri, virüs gibi çeşitli etkenlere karşı çocuğu korur. Salgısal IgA barsaktan emilmemekte ancak barsak mukozasındaki mikroorganizmaların üremesini inhibe etmektedir. Anne sütünde bulunan lizozim ve laktoferrin gibi maddelerin de çocuğun enfeksiyonlardan korunmasında yardımcı rolleri vardır ( 1,3,4,8,9,17) . Ig D: Plasentayı geçmeyen bir immünglobulindir. B lenfositlerinin yüzeyinde bulunur. Fetus ve yenidoğanda B hücrelerinin primer antijeni tanımasında önemli rol oynar (1,3,9). Kompleman: Fetal ve neonatal immünolojik cevap için önemli olan; klasik kompleman aktivasyonunun antikorla antijen interaksiyonundan sonuçlanmasına rağmen, alternatif yolun aktivasyonu antikordan bağımsız olup sıklıkla patojen organizmalarda rastlanılan polisakkarit 4 ve endotoksinler gibi yapılarla başlayabilir olmasıdır. İmmünolojik tanıma için spesifik tip IgG üretemeyen fetus ve infantta komplemanın efektör fonksiyonlarının tetiğinin çekilmesinde alternatif yolun kritik önemi vardır (1,4,8,10). Prematür ve miadında doğan bebeklerde E.coli için bakterisidal aktivite çalışıldığında klasik kompleman yolunun defektif olduğu, ancak alternatif yolun sağlam olması sonucu viral enfeksiyonların seyrinin daha hafif olması açıklanabilmektedir (19). Kompleman E.coli gibi bazı organizmalara karşı bakterisidal aktivitede aracılık ve GBS gibi bakterilerin optimal fagositozunda antikorla bir opsonin gibi görev yapar. Anneden fetusa kompleman geçişi olmaz. Fetus ilk trimesterde kompleman sentez etmeye başlar. Pretermlerde kompleman bileşenlerinin düzeyi düşüktür. Genel olarak Staphylococcus aureus (S.aureus) opsonizasyonu normaldir. GBS ve E.coli ile opsonizasyonda değişken bozukluklar bildirilmiştir (1,4,8,10). Polimorfonükleer lökositler (PMNL): Neonatal nötrofillerin kemotaksi, adherans, agregasyon ve şekil değiştirme yetenekleri azdır. PMNL’in önemli bir kısmı band formu veya metamyelosit şeklinde kemik iliğinde muhafaza edilir, bakteriyel enfeksiyon gibi durumlarda perifere salınır (15,20). Bakteriyel enfeksiyonlar sırasında da nötrofil tüketimi önemli ölçüde artmaktadır. Yenidoğanlarda granülosit ana hücrelerinin ve nötrofil depo havuzunun yetersiz olması ile sepsis sırasında nötrofil tüketiminin artması sonucu nötrofil rezervleri erişkinlere oranla daha çabuk tükenerek mortalitenin yükselmesine yol açmaktadır (21,22). Yenidoğanlarda hem intrensek hücresel faktörler hem de ekstrensek humoral faktörlerin eksikliği nedeniyle PMNL’lerin kemotaktik aktiviteleri düşüktür (21). Doğum sonrası dolaşımdaki nötrofil sayısı artar. Birinci günde normale ulaşır. Band nötrofiller yenidoğanlarda % 15’ten azdır (1,4,8). Lenfositler: Spesifik hücresel ve humoral immün yanıtların temel hücrelerini oluşturan lenfositler, tüm kan hücreleri gibi kemik iliğinde yapılmaktadır. Kemik iliğinde sayıları az 5 olan ortak bir kök hücreden hem humoral immün yanıttan sorumlu B hücreleri, hem de hücresel immün yanıttan sorumlu T hücreleri gelişmektedir (17,23,24). B Lenfositler: 8.GH’dan itibaren fetusun karaciğerinde bulunan kök hücreleri tarafından yapılır. 12.GH’dan itibaren bu hücreler IgM yapımına başlayabilir ve 15.GH’dan sonra tam fonksiyon gösterebilirler. Bu hücrelerin IgM yanı sıra IgD, IgG yaptıkları ayrıca C3 ve C1 antijenine karşı reseptörleri olduğu gösterilmiştir. 15-18.GH’da B lenfositlerinin erişkindekine yakın immünglobulin içerdikleri ancak özgül antikor yapımlarının sınırlı olduğu gözlenmiştir (1,25). T Lenfositler: Timositler başka bir deyişle lenfoid hücreler 9.GH’dan itibaren timusta belirirler. 11.GH’da koyun eritrositleri ile rozet formasyonu yapabilirler. Bu hücreler timusun korteks kısmında yoğundurlar. Hızla çoğalıp olgunlaşır ve medullaya göç ederler. Timusta lenfosit yanıtı 12, kanda ise 14.GH’da başlar. Baskılayıcı, yardımcı ve etkileyici fonksiyonlar doğumda gelişmiş olmakla birlikte yenidoğanın T Lenfositlerinde migrasyon-inhibisyon, faktör yapımı, interferon ve lenfotoksin oluşumu yeterli düzeyde değildir. Neonatal T lenfositleri invivo koşullarda düşük sitotoksisite gösterirler (24-27) . Monosit-Makrofaj Sistemi: Dolaşımda bulunan monosit sayısı yenidoğanda normaldir ancak retiküloendotelyal sistemdeki makrofaj kitlesi ve fonksiyonu azalmıştır. Pretermlerde monosit kemotaksisi bozulmuştur, monosit fagositozu da azalmıştır. Solübl antijenleri T hücrelerine sunuluşu ise normaldir (4,8). Doğal öldürücü hücreler: Doğal öldürücü hücreler lenfositlerin bir alt grubudur ve viruslarla enfekte olan hücrelere karşı sitolitik etki yapar. 9.GH’da aktivitesi fetal karaciğerde saptanmıştır. Antikorla kaplanmış hücreleri eritebilir. Sitotoksik aktiviteleri erişkine göre daha azdır (4,8,17,23,28,29). Sitokinler: Yenidoğanda interferon α ve β normaldir ancak INF δ sentezi azalmıştır. Neonatal sepsiste TNF α yükselir bu yanıt erişkine göre daha az tutarlıdır (1,4,10). Miadında 6 ve preterm yenidoğanların kordon kanında IL-2 aktivitesi erişkinden daha yüksektir ancak pretermlerde IL-2 reseptörleri için mRNA bulunmaz. Miadında yenidoğanlarda ise IL-2 için mRNA düzeyi erişkine benzerdir (1). IL-6 düzeyleri neonatal sepsis ve nekrotizan enterokolitte artar. Bu yenidoğanlardaki en tutarlı sitokin yanıtı olarak görünmektedir (1-4,8). 7 NEONATAL SEPSİS Neonatal sepsis yenidoğanda enfeksiyona sistemik yanıtı tanımlamak için kullanılan bir terimdir. Bu terimin bakteriyel enfeksiyonlara, pozitif kan kültürüne veya hastalığın ağırlığına sınırlı kalıp kalmaması konusunda fikir birliği yoktur. Ancak endotoksine ve TNF’ye karşı monoklonal antikorlar gibi yeni tedavi olanakları konusunda yapılan çalışmalar ve sepsisin patogenezine ilişkin bilgilerin artması neonatal sepsis için daha kesin bir tanımlama gerektirmektedir. Günümüzde neonatal sepsis genellikle “ağır sistemik hastalıklı bir yenidoğanda bu anormal fizyopatolojik durumun açıklanmasında enfeksiyöz olmayan nedenlerin kesinlikle ya da olasılıkla dışlanmış olduğu klinik tablo” olarak tanımlanmaktadır (1). ETYOLOJİ : Yenidoğan veye fetus 4 olası mekanizma ile enfekte olur: 1)Transplasental Enfeksiyon: Listeria monocytogenes (L.monocytogenes), Treponema pallidum, Mycobacterium tuberculosis fetusa anne kan dolaşımından geçerek enfeksiyona yol açabilir. Bebeğin bu yolla enfekte olması enderdir (9,10). 2)Asendan yol: Annenin genital traktusunda kolonize olan mikroorganizmalar, rüptüre membranlara asendan olarak ulaşarak enfeksiyona yol açabilirler. Özellikle membranların erken yırtılması veya amniyon sıvısının mekonyumla karışması söz konusu ise bu yol önem kazanır (31,33). 3)Travay sırasında ve doğum kanalından geçerken alınan enfeksiyon: Doğum sırasında deri, mukoza, konjunktiva, nazofarenks, orofarenks kolonize olur. Organizmanın çoğalmasını izleyerek üst solunum yolu veya diğer odaklardan kana invazyonu gerçekleşir. Bakteriyeminin ardından enfeksiyonun metastatik odakları ortaya çıkar ve merkezi sinir sistemi, akciğer, dalak, böbrek, kemik gibi organ tutulumu gerçekleşir (10,31). 8 4)Postnatal Enfeksiyon: Doğumdan sonra hastane veya ev koşullarında göbek, deri ve mukoz membranlardan sistemik dolaşıma geçen bakteriler septisemi oluşturabilir (10). Neonatal GBS enfeksiyonunun yıllık insidansı stabil maternal kolonizasyonun sebepsiz yere etkisi ile yıldan yıla değişir. E.coli ve GBS en az %60-70 enfeksiyondan sorumlu tutulur. Bunun yanısıra S.aureus, Klebsiella, Enterobakterler, Pseudomonas, Serratia ve Salmonella daha seyrek olarak geç başlangıçlı, nozokomiyal sepsiste izole edilmiştir. Listeria insidansı ise değişkendir. Gıda kaynaklı salgınlarda ve annenin enfeksiyözite durumunda görülür. Non-grup D alfa hemolitik streptococlar enfeksiyonları genelde GBS enfeksiyonu sonrasında görülür ve daha az virulandırlar. GBS için şok ve menenjitin fatalite oranının % 9’larda olduğu belirtilmişken bu oran sekonder enfeksiyondan dolayı %25’e çıkar. Grup D streptococcus; enterococcus ve nonenterococcus (Streptococcusus bovis) enfeksiyonlarında GBS enfeksiyonlarına göre klinik erken başlar ama erken başlangıçlı sepsis ve geç başlangıçlı nozokomiyal sepsis ayrımını yapmak güçtür. Vankomisine rezistan enterococlar 1990’larda tanımlanmışlardır ve geç başlangıçlı sepsisten sorumludurlar. Streptococcus pneumoniae, Neisseria meningitidis, Haemophilus influenza (H.influenza) ve Grup A, C ve G streptococcus solunum yolu patojenleri olup anne genital yolunda ürerler ve erken başlangıçlı sepsisten sorumludurlar. H.influenza ise yaşamın birinci ayında %20 tip B organizması olarak enfeksiyon yapar. H.influenza fatal olguların %50’sinden sorumludur. Streptococcus pneumoniae için de aynıdır ve solunum yolu patojenlerinden ayrımı yapılmalıdır. Koagülaz negatif Stafilococcus ve Candida yoğun bakım ünitelerinde uzun kalan pretermlerde sepsis etkenidirler. Parenteral hiperalimentasyon, iv lipid, santral venöz kateter ve antibiyotik setleri üremeyi kolaylaştırır. Koagülaz negatif Stafilococcus %40 oranında daha geç başlangıçlıdır. Candida %5-10 düşük doğum ağırlıklı bebeklerde özellikle 1500 gramın altındakilerde etkendir. 9 Neonatal kan kültürlerinde anaeroblar üremeyebilirler. Çoğunda fokal enfeksiyon bulunmayabilir. Clostridium ve Bacterioideste menenjit ve fasiit görülebilir. Neonatal enfeksiyonların fatalitesinin 1930’larda %80 iken 1990 larda %20’lere gerilemesi destek tedavileri ve yardımcı yaklaşımlar sayesinde olmuştur. GBS’ların onlarca yıl virulansının artmaması erken tanı, antimikrobiyal ajanların gelişimi ve serotip tayini ile mümkün olmuştur (2,3,10). EPİDEMİYOLOJİ: Yenidoğan enfeksiyon oranını anneyle, doğumla yada yenidoğanın kendisi ile ilgili çok sayıda etmen etkiler: 1)Anneye ait nedenler: • Koriyoamniyonit • Maternal üriner sistem enfeksiyonu • Maternal yolun farklı mikroorganizmalar ile kolonize olması • Erken membran rüptürü • Maternal intrapartum ateş, antenatal, peripartum enfeksiyonlar • Septik, travmatik doğumlar, obstetrik komplikasyonlar • Prenatal izlem, sosyo-ekonomik, kültürel durum, annenin sağlık ve beslenme durumu (1,10,30-34). 2)Bebeğe ait nedenler: • Cins: Yenidoğan sepsisi, erkeklerde kızlara göre daha sıktır. Bu farklılık X kromozomu üzerinde lokalize olan bir genin timus fonksiyonları ve immünglobulin yapımını daha güçlü uyardığı görüşü ile açıklanmaktadır (10,31). 10 • Prematürite ve SGA bebek: Sepsis insidansı bu bebeklerde belirgin olarak daha yüksektir. Term bebeklerde bile iyi gelişmemiş olan savunma mekanizmalarının bu bebeklerde daha yetersiz olması, yoğun bakıma daha çok gereksinim göstermeleri enfeksiyon sıklığını artıran nedenlerdir (31,32,35). • Doğum sırasında veya sonrasında yapılan girişimler: Bebeğin doğum sırasında kontamine araçlarla resüsite edilmesi, postnatal bakımı sırasında kontamine araçlar, kateter ile karşılaşması yenidoğanın enfekte olmasına yol açabilir (35). • Bebeğe ait nedenler: Bebeğin fetal distres altında olması, ilk 5 dakikada APGAR değerinin 6’nın altında olması, hipoksik doğması, ikiz eşi olması enfeksiyona ortam hazırlar. Ayrıca yenidoğanın merkezi sinir sistemi, üriner traktus, aspleni gibi konjenital anomalilerle doğması da sepsis için risk faktörüdür (10,32,36). 3)Çevreye ait nedenler: Ülkenin ve yörenin farklı floraları, anne ve bebek sağlığı için gerekli alt yapının yeterliliği sepsis sıklık ve etyolojisi ile ilişkilidir. Ülkemizde yeterli sağlıklı istatistiksel veriler olmamasına rağmen gebe takibinin yetersiz olması, doğum öncesi ve sonrası bakım için koşul ve olanakların yetersizliği , ev doğumlarının halen olması, yenidoğan bakımı konusunda çağdaş düşünce ve hijyen koşullarının henüz tüm toplumca yeterince benimsenmemiş olması ülkemizde sepsis insidansının yüksek olduğunu düşündürmektedir. Perinatal enfeksiyonların epidemiyolojisi hakkındaki bilgilerimiz GBS ve E.coli’ye dayanır. Her ikiside gastrointestinal sistem kaynaklıdır. GBS için rezervuar rektumdur. GBS vaginal kültürlerde servikse göre daha çok izole edilmiştir. Sağlıklı erişkinde proksimal ince barsakta mevcuttur. Gebede ürogenital sistem ve gastrointestinal sistemde %5-30 izole edilebilir. En az kolonizasyon Latin Amerikada, en fazla Afrikalı Amerikan kadınlarında 11 saptanmıştır. Genç, seksüel olarak deneyimli, düşük sosyoekonomik durumlu kadınlarda kolonizasyon çoktur. Seksüel bulaşıcı hastalıklar arasındaki oranı % 2-4 tür. Erkeklerde GBS %2 üretra ve farenkste saptanmış, eşlerinin de %45-60’ında identik, suşlar bulunmuştur. GBS kolonizasyonu %60-70 hamilelikte de devam eder. Antibiyotikler GBS’u eradike edemez. Sadece mukozada suprese eder. Antibiyotik tedavisi olmadığı durumlarda %40 infantta GBS kolonizasyonu görülür. Bundan maternal doğum yolu suçludur. Diğer üç bulaşma mekanizması transplasental, servikal akıntıdan transmisyon ve amniyotik sıvıdan rüptüre membranlar yoluyla bulaşmadır. Geçişi ve bakteri yükünü artıran en önemli neden düşünüldüğü gibi doğum yolu travması değil, annedeki kolonizasyon derecesidir. İnvaziv girişimler kolonizasyonu %50-75 artırır. E.coli'nin patojenik K1 suşları %75 neonatal menenjitten sorumludur. L.monocytogenes dünya genelinde toprakta yaşar, geniş hayvan rezervuarları vardır. Hayvandan insana transfer açıklanamamıştır. Perinatal Listeria salgınlarında az yıkanmış sebze ve meyvelerin suçlu olduğu düşünülmüştür. Gebelerdeki çalışmalarda %5-8 Listeria bulunmuş. İsveç çalışmasında asemptomatik fekal taşıyıcılık; %1 hospitalizasyon düzeyinden, %26 ev taşıyıcılığına kadar değişkenlik göstermiştir. 1993'te Listeria için %21 asemptomatik ev taşıyıcılığı saptanmıştır (2). PATOGENEZ: İnvaziv bakteriyel enfeksiyonların gelişimi obstetrik, yapısal virulans faktörlerinin patojene göre değişimi ve bozulmuş konak immünitesi olabilir (1,2). Bu risk faktörleri genelde artmış sistemik enfeksiyon riskleri olduğunda devreye girer. Obstetrik riskler uzamış doğum yolu travayı ve uzamış gebeliğe bağlıdır. Kültür pozitif infantlarda %75 neonatal menenjit, %40 sepsis oluşur. %20-30 asemptomatik rektal kolonizasyon vardır (1). 1983’te Boyer ve arkadaşları 18 saatten fazla membran rüptür zamanı olan, ateşi 38 derecenin üstünde 12 olan annelerin bebeklerinde enfeksiyon riskini; doğum tartısı 1000 gramın altında olanlarda %0.26, doğum tartısı 1000-2500 gr arasında olanlarda oran % 0.7 olarak saptamışlardır. Neonatal patojenlerde bu durumla ilişkili olabilir. Bu durum için bazı risk faktörleri vardır. İkizlerden birinin GBS ile enfekte olması, genetik yatkınlık, bakteriye direkt maruz kalma, GBS bakteriürisi infant için risk faktörleridir. Annede diabetes mellitus olması da risk faktörüdür. Diğer epidemiyolojik çalışmalar kemoproflaksinin intrapartum dönemde GBS için uygulandığında tüm bu kriterlere uyan kadınlarda koryoamnioniti ve 18 saatin üstünde membran rüptür zamanı olanlarda GBS kolonizasyonunu düşürdüğünü ortaya koymuştur. Amnios sıvısı aspirasyonu bronkopnömoniye yol açmakla birlikte primer bakteriyemi olmayabilir. Genital yol ve mukozalarda bulunması bakteriyemi yapar. Diğer giriş yerleri konjunktiva, nazofarenks, göbek kordonu ve travmatize deridir. Antibiyotiksiz infantlar GBS’u eradike etmekten uzaklardır. Geçişken bakteriyemi anne ve çocuk arasında sezilemez. Fokal odağın yayılmasında kan akımının rolü şüphesizdir. Meningeal invazyon için kritik seviye 1000 koloni/ml’dir. Bu bakteriler hücre duvarını geçer, dış membrandan girer, ekstrasellüler ürün ve mediatörler ile örneğin IL-1 ve IL-6 TNF ile konağı çepeçevre sarar. Endotoksin benzeri substratlar Grup B streptokoklarca üretilir, pulmoner hemodinamiyi ve vasküler geçirgenliği bozar ve infantı enfekte eder. Virulans faktörleri içinde polisakkarit kapsül ile ilgili çalışmalar önemlidir. GBS, E.coli K1 suşu, L.monocytogenes IV B suşları için patojenite ile ilişkileri şöyle izah edilir. • % 70-90 Menenjit etkenleridir. • Bu polisakkarit kapsüller opsonofagositoza oldukça dirençli ve erişkin PMNL’lerine karşı koruyucudur. 13 • Monoklonal antikorlar spesifik antijenlere karşı koyar; bunlar genellikle Rhesus maymun ve infant fare deneylerinde ortaya konur ve ilişki patojeniteyi belirler. • Annedeki GBS Tip 3 kolonizasyonu ml'de 2 μg düzeyinin altında ise infant sağlıklı kalabilir. • E.coli K1 suşu menenjitinde genelde BOS da konsantrasyon yüksekse kötü prognoz görülebilir. GBS Tip 3 suşlarının kapsüler polisakkaritlerindeki sialik asit ve antijenik molekül determinantlarındaki durum patojenitede yol göstericidir. İntrakapsüler polisakkarit ve antijenik molekül içeriklerinin antifagositik özellikleri patojenin enfeksiyözitesini belirler. Gen serisi GBS polisakkariti için çözümlenmiş ve virulanstan sorumlu tutulmuştur. LD50 düzeyinden düşük letal doz alan öldürücü infant fare deneylerinde gösterilmiştir. Opsonofagositoza direnç başka bir gen sekansının kopyalanması ile bulunmuştur. Sıçanlarda GBS’ların Ibc ve R proteinleri gibi insanda da invitro benzer opsonik antikorlar ortaya konmuştur. Bu proteinlerdeki değişkenlikler suşların virulansındaki değişkenliği izah eder ve aşısal immun özellikleri de artırmaktadır. Adezin, nöraminidaz, proteinaz gibi faktörler de virulansla ilgilidir. Bu savunma faktörleri infantlarda hipoksi, asidoz ve pretermlik ile hasarlanmışsa bakteri enfeksiyonları ortaya çıkar. Spesifik antikorların GBS’lara karşı koruyuculuğu bazı konak bağımlı mekanizmalarla açıklanır. Opsonizasyon alterne kompleman yolu yardımı ile nötropeniye engel olur, kemik iliğinde nötrofillerin enfeksiyona yanıt olarak çoğalmasını sağlar. Kompleman ve fibronektinlerin opsonofagositozu tetiklediği görülmüştür. Endojen ürünlerdeki ve invitro kordon kan hücrelerindeki granülosit koloni stimüle edici faktör yenidoğanı korur (2). 14 KLİNİK BULGULAR: Yenidoğanda bulguların çoğu nonspesifiktir. Emmeme ve iyi görünmeme enfeksiyon varlığının tek göstergesi olabilir. Daha belirgin bulgular; vücut ısısı değişiklikleri, solunum sıkıntısı, beslenme intoleransı, kusma, abdominal distansiyon, ishal, sarılık, peteşiel deri döküntüsü, hipotansiyon, taşikardi, apne ve bradikardi, huzursuzluk, tiz sesli ağlama, letarji, pulsatil fontanel ve konvulsiyondur (1-3,8-11). Yenidoğan sepsisi başlangıç zamanına göre erken ve geç başlangıçlı olarak gruplanabilir. ERKEN BAŞLANGIÇLI SEPSİS: %80 Term infantlarda yaşamın ilk haftasında, %95 ilk 72 saatte görülen enfeksiyon tablosudur (2). En sık GBS, E.coli, L.monocytogenes etkenlerdir. GBS enfeksiyonunda genelde bulgular ilk saatlerde başlar (4,11). Enfeksiyon %60 akciğer enfeksiyonu şeklindedir (2,3). Radyografide retikülonoduler patern, bronkogram ile hyalen membran hastalığı görülebilir. Ağır olgularda ilk 24 saatte hipotansiyon, apne ve DİC gelişebilir. Agresif antibiyotik tedavisi ile bu önlenebilir (2,3). H.influenza, Grup D ve C strepcoccus ile benzer sendrom görülür (1-3). Tedavi edilmeyen enfeksiyon yayılım gösterir ve fataldir (2). % 10-25 menenjitle birlikte görülür (1,2,10). L.monocytogenes ise doğum öncesi maternal kan kültüründe pozitiftir. Primer odak akciğer enfeksiyonu olabilir, beraberinde hepatosplenomegali, pürülan konjunktivit, makülopapüler döküntü, peteşi ve posterior farenkste karakteristik küçük granülomlar görülebilir. Akciğer enfeksiyonu retikülonodüler patern ile giden bronkopnömoni şeklindedir. %40-80 fataldir. Ia,Ib,IVb serotipleri ile menenjit görülmez (1,2). 15 GEÇ BAŞLANGIÇLI SEPSİS: Yaşamın 4. gününden sonra, genelde 2. haftada görülür (2,3,10,11). Pretermlerde 16. haftaya kadar uzayabilir. Bu durum çok geç başlangıçlı sepsis olarak adlandırılır (2,3,11). Etkenler GBS, L. monocytogenes’dir. Menenjit çok sıktır (1-3,8-11). GBS menenjiti ve hidrosefali karakteristiktir (8). GBS ile oluşan menenjitte BOS normal, ventriküller pleositotiktir ve hücre üretilir (3). Fatalite riski % 20’dir. Monocytogenetik menenjitte tipik BOS bulgusu bulunmaz. Kültürde üretilen bakteri Gr (+), küçük, silindir ve çomaktır. Fatalite riski %10’dur. 24-36 saatlik tedavi sonrası steril BOS oluşur (3). GBS menenjitinde % 50 nörolojik hasar oluşur (2,3). Görülebilecek diğer enfeksiyonlar; osteomyelit,septik artrit, üriner sistem enfeksiyonu, otitis media, deri ve yumuşak doku enfeksiyonu ve nazokomiyal enfeksiyonlardır (2). Diğer etkenler; Gr (-) basiller, Klebsiella pneumoniae, E.coli, Serratia marcescens, Pseudomonas, S.aureus ve Candidadır (8). TANI: Yenidoğanda yalnızca klinik bulgulara dayanarak sistemik enfeksiyon tanısı koymak güçtür. Sepsis ve menenjitin klinik bulguları genellikle belli belirsiz ve başlangıçta non spesifiktir, ancak hızla ilerleyebilir. Neonatal bakteriyel enfeksiyonlar; kan kültürleri, BOS, idrar ve enfekte vücut sıvıları, yumuşak doku aspiratları ile tanınır (1-3). Mikrobiyolojik Araştırmalar: Kan Kültürü ve diğer kültürler: Neonatal sepsisin kesin tanısı kan kültürü ile konur (1-8). İlk 24 saatte alınan kan kültürlerinde üreme saptanabilir, bu kullanılan metoda göre 48 saate de uzayabilir (8). Örneğin L.monocytogenes ve H.influenza uzun zamanda ürer. Deri antiseptik solüsyonla temizlenip kuruduktan sonra tercihen venden alınır. Antiseptik olarak 16 klorheksidine veya iyod solüsyonu kullanılır. 0.5 ml kan yeterlidir. Kapiller metod ve göbek kateterleri ile alımda kontaminasyon daha sıktır. Mikst organizmaların 24-48 saatte üremesi kontaminasyonu düşündürür. Çok düşük doğum ağırlıklı infantlarda çok değişken mikroorganizmalar ve birden çok mikrobiyal ajan rol oynar. Enfeksiyon hemogram ve CRP ile desteklenmelidir. Yine virus ve mantar enfeksiyonlarında üreme saptanmayabilir (8). Göz, kulak, farenks, rektum, umblikus giriş yerleri olabilir. Vücut yüzeylerinden alınan kültürlerin değeri çok iyi değildir. Farengeal üremesi olan hastaların ancak % 11’inde pozitif kan kültürü bulunmuştur. Nazal kültürde üreme görülmesinin negatif prediktif değeri %99, yalancı negatifliği %7’dir (8,37). Gastrik Aspirat: Amniyotik sıvı ve doğum kanalından geçen mikroorganizmalar GBS, enterococcus ve enterobaktericae bebekte nadir olarak septisemi tablosu yaparlar. Bundan dolayı antibiyotik tedavisi tartışmalı bir konudur. Klinik semptomların varlığında gastrik aspiratta üreyen mikroorganizmaya göre antibiyoterapi düzenlenmelidir (8). Maternal HSV: Bebekte ilk 24 saat içinde oluşan infeksiyon maternal vajina kaynaklı HSV olabilir. Buna uygun tedavi ajanı seçilmelidir (8). İdrar: Perine temizlendikten sonra dikkatlice idrar örneği alınmalıdır. 100000/ml bakteri olması idrar yolu enfeksiyonu olarak tanımlanır. Karışık mikroorganizmalar, sıklıkla da E.coli nedendir. Fotometrik olarak dipstiklerle lökosit, esteraz-nitrit ve proteindeki değişiklikler ölçülebilir (8). Trakeal Sekresyon ve Endotrakeal Tüp Kültürü: Mikroorganizmalar havada bulunur ve alt solunum yolu enfeksiyonu ve septisemiye neden olabilir. Koagülaz negatif stafilococcus ve Candida sık üreyen mikroorganizmalardır (8). Vasküler Kanüller ve Trokanterik Kanüller: Umblikal kateter, santral ve trokanterik kateterlerdende kültür alınabilir. Kontaminasyon ile ayırt etmek önemlidir (1,8) . 17 Lomber Ponksiyon: Neonatal bakteriyel menenjit önemli bir mortalite ve morbidite nedenidir (1-10). Özellikle tanı ve tedavinin gecikmesi önemlidir. RDS nedeni ile entübasyon bebeklerde lomber ponksiyon yapılmasını zorlaştırabilir. Geç başlangıçlı sepsise menenjit eşlik etmesi daha sıktır. BOS da 30/mm3 polimorfonükleer lökosit görülmesi menenjit lehinedir. Proteinin 1.5-2 g/l term, 3.7 g/l pretermlerde üst sınırıdır. BOS glukozu kan glukozunun %50 sinden düşükse bakteriyel menenjiti destekler. GBS, E.coli K1 suşu en sık menenjit etkenleridir. Neonatal menenjitlerde sitokinlerin (IL-6, TNFα) ölçümü de önemlidir. IL-6 ile yapılan bir çalışmada 20 infantta yüksek saptanmıştır (8). Aseptik menenjitlerde %10 IL-6 artar. TNF α ölçümü bakteriyel menenjitlerde duyarlı bir yöntemdir (1-8). Radyoloji: Güğüs radyogramı, abdominal grafi ve USG abdominal işaretleri destekleyebilir. Yumuşak doku ve kemik enfeksiyonlarında önemlidir. Hematolojik Değerlendirme: Beyaz Küre Sayısı: Enfeksiyondan 24 saat sonra beyaz küre sayısı artmaya başlar. Total beyaz küre sayısı gestasyona ve postnatal yaşa göre değişiklik gösterir. Periventriküler hemoraji, konvülsiyon ve asfiksi beyaz küre sayısını değiştirebilir (1-8,11). Nötrofil Sayısı: Term ve preterm oluşa ve postnatal yaşa göre değişkendir. I/T nötrofil oranında; ilk 24 saatte maksimum 0.16, 48 saate kadar 0.14, 60 saate kadar 0.13, ilk ay 0.12 üst değerlerdir. Nötrofillerdeki toksik granülasyonda önemlidir (8). Nötrofil Morfolojisi: Yenidoğanın ağır bakteriyel enfeksiyonlarında nötrofillerde toksik granülasyon, Döhle cisimciği, vakualizasyon gibi kalitatif dejeneratif değişiklikler görülebilir (38,39). Lenfosit Sayısı: Antikoagulan eklenmiş tüpte kanın santrifüje edilmesiyle elde edilen plazma ile eritrositler arasındaki buffy coat tabakası gram boyası ve metilen mavisi veya akridin oranj ile boyanır ve mikroskopta intrasellüler bakteriler araştırılır. Pozitif sonuç sepsis tanısını 18 destekler. Ancak enfeksiyöz etken ve diğer enfeksiyon odakları bu yöntemle saptanamaz (18). Trombosit Sayısı: Sepsiste %47-65 trombositopeni saptanır. Viral enfeksiyonlar, konjenital enfeksiyonlar (TORCH) ve enterovirus trombositopeni nedenleridir (8). Akut Faz Proteinleri: CRP: Generalize inflamatuar durumlarda IL-1 ve IL-6 sayesinde karaciğerden salınan globulin türünde bir taşıyıcı proteindir. Sistemik bakteriyel ve fungal enfeksiyonlarda kan CRP konsantrasyonu enfeksiyondan 10-12 saat sonra yükselir. 60 saat sonra en yüksektir. Sensitivitesi %62, spesifitesi %87, negatif prediktivite değeri %92 dir (1-8). Kültürde üreme yoksa ve CRP negatif ise 48 saat sonra antibiyotik tedavisi kesilir. Enfeksiyonun gidişini seri ölçümler gösterir. Persiste etmesi enfeksiyonun üzerine bir fungal enfeksiyonun eklenebileceğini akla getirmelidir (8,40). Fibronektin: Yüksek molekül ağırlıklı bir proteindir. Karaciğer hücreleri ve endotelyal hücrelerde yapılır. Makrofaj ve nötrofil fagositozunu güçlendirir ve retiküloendotelyal sistem için opsonin görevi yapar, immün yanıta yardımcıdır. Asfiksi ve bronkopulmoner displazide düşük bulunur. Sistemik enfeksiyonların göstergesidir (1-8). Diğer akut faz proteinleri α1 asit glikoprotein, haptoglobulin, α1 antitripsin ve α1 antikimotripsin neonatal enfeksiyonlarda artar (8). IL-6 ve TNFα: IL-6 neonatal enfeksiyonlarda CRP’ye göre daha erken yükselir. Sepsis tanısında yapılan prospektif seri çalışmalarında CRP’nin sensitivitesi %58, IL-6 nın %73 olarak bulunmuştur. TNFα seviyeleri neonatal infantlardaki akciğer enfeksiyonlarında artar. IL-6 ve TNFα’nın karşılaştırmalı çalışmalarında bakteriyel sepsiste IL-6 nın daha güvenilir bir gösterge olduğu saptanmıştır (1-4-8). 19 Granülosit-elastaz konsantrasyonu: Amniyotik sıvı granülosit elastaz konsantrasyonları neonatal sepsiste erken gösterge olarak anlamlı bulunmuştur (8). Serum prokalsitonin düzeyi: Serum düzeylerindeki yükselme sepsiste anlamlı bulunmuştur (8). Serum granülosit koloni stimüle edici faktör düzeyi: Serum G-CSF cut off değeri 120 pg/ml olarak bulunmuş olup sensitivitesi %95, spesifitesi %73, pozitif prediktif değeri %40, negatif prediktif değeri %99’dur. Neonatal sepsiste önemlidir (8). İmmunolojik Çalışmalar: Antijen Saptama Testleri: Kan, idrar ve BOS’daki bakteriyel antijenler immünelektroforezle saptanabilir. Yenidoğanda pratikte bu yöntemler pek kullanılmaz. GBS’un lateks aglütinasyon ile hem anne hem bebekteki kolonizasyonu saptanabilir. GBS’un antijeninin idrardaki ilk 24 saatteki sensitivitesi %90, spesifitesi %70, pozitif prediktif değeri %12, negatif prediktif değeri %99 dur (8). Antikor Saptama Testleri: Viral enfeksiyonlarda kanda 2 hafta antikor saptanabilir. Eğer enfeksiyon konjenitalse organizmanın spesifik IgM’i gösterilebilir (8). Genetik Teknikler: Gr (-) ve Gr (+) organizmaların DNA sekansları ve bazı viruslar PCR ile saptanabilir (8). AYIRICI TANI: Neonatal sepsis klinik bulguları pnömoni ile birlikte olan veya olmayan respiratuvar distres sendromu, yenidoğanın geçici taşipnesi, mekonyum aspirasyon sendromu klinik tabloları ile karışabilir. MSS belirtileri, intrakraniyal kanama, ilaç bağımlılığı ve doğumsal metabolik hastalıklarda da görülür. İntestinal obstrüksiyon, gastrik perforasyon, nekrotizan 20 enterokolit de sepsiste görülen GIS bulgularına benzer bulgularla belirebilir. Dissemine HSV enfeksiyonu sepsisten klinik olarak ayrılamaz. TEDAVİ: Sepsisin sistemik hasarında infantın karşı koyabilme gücü mortalite ve morbiditeyi etkiler (1,2-8). Seçilecek antimikrobiyal ajanlar etyolojik ajana, SSS penetrasyonuna, toksisiteye ve infantın karaciğer ve böbrek fonksiyonlarına göre ayarlanmalıdır (2). Antibiyotiklerin farmakokinetiği, etkisi, güvenilirliği değişkendir. Yenidoğanda böbrek ve karaciğer immatür olduğu için antibiyotikler özenle seçilmelidir (2). Örneğin vankomisin ve aminoglikozitler düşük doğum ağırlıklı infantlarda kullanılırken serum seviyeleri, kreatinin düzeyleri kontrol edilmelidir. Düşük doğum ağırlıklı infantlarda bu ilaçlar 18-24 saat aralıklarla kullanılır (3). Sulfonamidler ve seftriakson yenidoğan peryodunda bilirubinin metabolize olmasını azaltacağından kernikterus riskini artırabilir (2,44). Ampirik Antimikrobiyal Tedavi: Yenidoğanda klinik bulgular ve öykü ile enfeksiyon olasılığı düşünülüyorsa tanıya yönelik araştırmalar yapılır yapılmaz antimikrobiyal ajanlarla tedaviye başlanmalıdır. Antibiyotik seçimi sırasında gestasyon yaşı, postnatal yaş ve risk faktörleri önemlidir (1,2,13). Yan etkileri, MSS’ne penetrasyonu önemlidir. Yenidoğan farmakolojik ve fizyolojik açıdan kendine özgü bir organizmadır. Geniş ekstrasellüler sıvı volümü, enzim sistemlerinin immatüritesi, renal fonksiyonlarda değişkenlik ve vücut sıvı bileşimindeki farklılıklar antibiyotiklerin emilimini, metabolizmasını ve vücuttan atılım süreçlerini etkiler (1,2,12,4145). Yaşamın ilk günlerinde yenidoğanda tedavi Gr (+) koklar özellikle GBS’lar ve Gr (-) enterik basillere yönelik olmalıdır. L.monocytogenes, H.influenza ve Streptococcus 21 pneumoniae gibi mikroorganizmalar erken sepsisten sorumludurlar. İnisial tedavide mutlaka penisilin ve penisilin türevi bulunmalıdır (1,2,14). Ampisilin birçok antimikrobiyal kombinasyonda enterokoklara ve L.monocytogenese ve ayrıca penisiline duyarlı diğer Gr (+) koklara etkili olduğundan seçilir. Erken başlangıçlı enfeksiyonlarda kombinasyon içinde Gr (-) mikroorganizmalara karşı mutlaka bir aminoglikozit de bulunmalıdır. Gentamisin en sık kullanılandır. Tobramisin, amikasin, netilmisin ve 3. kuşak sefalosporinler de olabilir. Pseudomonas enfeksiyonunda karbenisilin veya tikarsilin-mezlosilin bir aminoglikozitle birlikte verilmelidir. Piperasilin tazobaktam veya seftazidim de kullanılabilir. Menenjit kuşkusunda MSS penetrasyonu iyi olan 3.kuşak sefalosporin verilmelidir. Geç başlangıçlı, toplumdan kazanılmış enfeksiyonlar erken başlangıçlı enfeksiyonlarda sözü edilen organizmaların yanı sıra Streptococcus pneumoniae, H.influenza tip b ve Neisseria meningitidis ile de oluşabilir. Menenjit sıklıkla geç başlangıçlı sepsise eşlik ettiğinden ampisilin ve bir 3. kuşak sefalosporin önerilir. Nozokomiyal geç başlangıçlı hastalık tedavisi Koagülaz negatif Stafilococcus, enterococcus, Gr (-) enterik basiller, Pseudomonas ve Serratia suşlarına yönelik olmalı ve bu nedenle tedavi programında penisilinaza dirençli bir antistafilokokal penisilin ve aminoglikozit veya 3. kuşak sefalosporin yer almalıdır. Vankomisin tüm stafilococ suşlarına, streptococlara ve enterococlara etkilidir. Sefotaksim veya seftriakson GBS, penisiline dirençli suşlar dışı pnömokoklar ve Gr (-) enterik basillere etkilidir, ancak Stafilococlar, L.monocytogenes, Enterococlar ve Pseudomonas suşları, Serratia, Citrobakter üzerine etkisizdir. Bakterioides fragilis ile oluşan sistemik enfeksiyonlar klindamisin ile, MSS tutulumu varsa metranidazol ile tedavi edilir. Kültürü negatif olan hasta 48-72 saat sonra değerlendirilir. Değerlendirme sonunda bebek iyi ise ve bakteriyel sepsis tanısı olası değilse tedavi kesilebilir ve hasta 24 saat izlenir. Sistemik bakteriyel enfeksiyon tedavi süresi 7-17 gündür. Kemik ve eklem enfeksiyonlarında tedavi süresi uzar (1,2,4,5,8). 22 Neonatal Menenjit Tedavisi: Neonatal menenjite neden olan patojenler neonatal sepsise neden olanlarla aynı olduğundan başlangıç ve sonraki tedavi aynı olacaktır. Gr (-) bakterilerde yüksek mortalite olduğundan yüksek antibiyotik konsantrasyonları sağlanmaya çalışılmıştır. Sefotaksim kullanımı tek veya ampisilin ve aminoglikozitle birlikte yeterlidir (1) . Sepsiste Yardımcı Tedavi: İmmünoterapi: Profilaktik olarak immunoglobulin verilmesiyle ilgili çalışmalar vardır (8). Yenidoğanın immün sistemi; patojenlere nötrofillerin kemotaktik yanıtı, proenflamatuar lenfokinlerin T hücre üretimi ve kompleman aktivitesi gibi birçok yönden yetersizdir. İmmünglobulinlerin anneden geçişi 32-34. gestasyon haftasında olur. IVIG’in yenidoğan enfeksiyonları üzerine mortalite ve morbiditeyi azaltıcı rolü saptanmamıştır (1,46-48). Taze Donmuş Plazma (TDP): Humoral immunite için TDP ile çalışmalar yapılmıştır. Bu çalışmalarda DIC gelişen infantlarda TDP’nın yeri saptanmıştır; fakat viral enfeksiyon yapıcı etkisi de vardır (8). Kan Değişimi: Bakteriyel toksinler, fibrin yıkım ürünleri ve sitokinler vücuttan bu şekilde uzaklaştırılabilir. Yapılan kontrollü çalışmalarda hemen sonrasında yine aynı durumun oluştuğu saptanmıştır (8). Granülosit Transfüzyonu: Sepsiste granülosit depoları tükenmekte ve nötropeni olmaktadır. Yapılan kontrollü çalışmalarda anlamlı bulunmamıştır . Aşırı duyarlılık reaksiyonları, virüs bulaşması, volüm yüklenmesi gibi yan etkileri önemlidir (1,8) G-CSF ve GM-CSF: Enfeksiyon göstergesi olarak rol oynar. İnfantlarda alloimmun nötropeni ve konjenital agranülositozda etkileri saptanmıştır (8). Pentoksifilin: Yenidoğanda nötrofil fonksiyonlarını düzenleyen immunmodülatör ajandır. (8) Antilipid A monoklonal antikorları: Gr (-) şokta lipopolisakkarid toksik olan Lipid A mortalite ve morbiditeyi belirlediğinden önemlidir (8). 23 DESTEKLEYİCİ TEDAVİ: Arteriyel ve venöz kateter: 24 saatten fazla damar yolu kalacaksa arteriyel veya venöz kateter takılmalıdır (1,8). Kanama Diyatezi: Trombositopeni ve DIC; neonatal sepsis sonucu oluşur. Tedavi ile düzelebilir (8). Beslenme: Sepsisli bebekte; nekrotizan enterokolit, gastroözofageal reflü sık olduğundan beslenmeyi iyi tolere edemezler. Katabolizmaları da fazladır. Parenteral ve enteral nütrisyon önemlidir (8). NEONATAL SEPSİSİ ÖNLEME: Annede koriyoamniyonitten şüphelenildiğinde doğumdan önce tedavi başlanması, bebeğin erken doğurtulması ve selektif intrapartum kemoproflaksi ile özellikle GBS enfeksiyonu olmak üzere ampisiline duyarlı bakterilerle oluşan enfeksiyonda mortalite ve morbidite oranları azalmıştır. Enfekte yenidoğanın süratle tanınması ve tedavi edilmesi ve yeterli el yıkama, nazokomiyal enfeksiyonu önlemede esastır. El yıkama yeterli ve uygun şekilde yapıldığında nazokomiyal enfeksiyon sıklığını azaltmada en etkili yöntemdir. % 3’lük heksaklorofenli sabun solüsyonları Gr (+) bakterilere, çeşitli iyot preparatları; örneğin % 0.5 iyotlu klorheksidin Gr (-) bakterilere karşı etkilidir. Kordon arter ve veni ile resüsitasyon ve ventilatör aletlerinin steril olmasına özen gösterilmelidir (1,7). NEONATAL SEPSİSTE PROGNOZ: Bakteriyel enfeksiyonun komplikasyonları endokardit, septik emboli, abse oluşumu, septik artrit, osteomiyelit ve kemik yıkımıdır. Neonatal sepsis ve menenjitte mortalite %20’dir. Menenjitin akut komplikasyonları serebral abse ve ventrikülittir. Geç dönemde işitme kaybı, motor bozukluk, anormal konuşma, hidrosefali, mental reterdasyon ve körlük 24 görülebilir. Bu sekellerin bazıları menenjitsiz sepsiste serebrit ve septik şok sonucu da oluşur. Mortalite ve uzun dönemdeki sekeller; hastalığın başlangıç yaşı, prematürite derecesi, eşlik eden hastalıklar, tedavide gecikme ve etyolojik ajana bağlı olarak değişir (1,49) . 25 POLİMORFONÜKLEER LÖKOSİT ELASTAZ PMNLE nötrofillerde bulunan azurofilik granüllerde mevcut bir tür serin proteazdır. Aynı zamanda Human Lökosit Elastaz olarak da bilinmekle birlikte uluslararası biyokimya enzim komisyonu tarafından aktivitesine bağlı olarak E.C.3.4.21.37 şeklinde özgün bir numara ile kodlanmıştır. Bu enzimin potansiyel sübstratları hemen hemen her çeşit ekstrasellüler matriksi içermektedir (sitokinler, kompleman, immunglobulinler, pıhtılaşma faktörleri gibi) (50,51,53,54). Lökosit ve diğer akciğer hücreleri tarafından salgılanan onlarca proteazdan sadece biri olan PMNLE’a ilgi son zamanlarda artmaktadır. Bunun nedeni genetik bir rahatsızlık olan α1-antitripsin eksikliğindeki gibi PMNLE’a karşı koyulamayan aşırı cevaptır. Bu durum prematürelerde şiddetli amfizeme yol açabilmektedir. Akut akciğer hasarı ve akut respiratuar distres sendromunda inflamatuar doku hasarı patogenezinde PMNLE’ın potent proteolitik repertuarı sayesinde nötrofiller bazal membran içinden sıyrılırlar (50,53,55). Elastazın Genetiği: PMNLE geni; ELA 2;19. kromozomun kısa kolunun 50 kilobazlık bir segmentinde en terminal uçta bulunmaktadır. Bu bölge serum proteaz azurosidin ve proteinaz 3 genlerini içerir. Bu genin yüksek derecede trankripsiyonu promyelositik fazdaki granülosit gelişimi ile sınırlıdır ve PMNLE üretilip sitoplazmadaki azurofilik granüllerde depolandığında bu transkripsiyon gerçekleşir. Aslında PMNLE’ın mRNA’ları olgun nötrofillerde sistemik dolaşım esnasında bulunmaz. 218 aminoasitlik ve 4 disülfit bağlı glikoprotein ürün serum proteaz ailesinin de bir üyesidir. Bu enzimler katalitik etkili aminoasit üçlü rezidüsüne sahiplerdir. Örneğin; elastaz His-41, Asp-88 ve Ser-173 içerir. Aktif kısımdaki serin oldukça nükleofilik ve küçük, yüksüz aminoasitlere yüksek afiniteye sahiptir. PMNLE’daki 26 mutasyonlar siklik nötropeni ile ilişkilidir ki; bu hastalık otozomal dominant karakterli ve 21 günlük periyodlarda nötrofil ve diğer kan hücrelerinin üretiminde ossilasyonlarla giden nadir bir hastalıktır (50,56,57). PMNLE ekspresyonunun regülasyonunun hem transkripsiyonel hem de translasyonel aşamalarda nasıl olduğu tam anlamıyla anlaşılamamıştır. Kromatin reorganizasyonu PMNLE transkripsiyonunun regülasyonu ile ilgili olabilir. HLE gen promoter bölgesi c-Myb,c/ EBP, PU.1 transkripsiyon faktörlerinin bağlama bölgesini kodladıkları bilinir. Bu bölümün eksikliğinde granülosit gelişiminin spesifik fazları boyunca nötrofil geninin ekspresyonunda aksaklıklar olacağı kesindir. Bu tarz eksiklikler PMNLE gibi nötrofil granüllü proteinlerinin çeşitli gen ekspresyon ve biyosentez granüllerinde bulunmamasına sebep olur (50,58). PMNLE konsantrasyonu nötrofillerde 5 mμ’yi geçtiğinde yaklaşık her nötrofil 400 PMNLE bulunduran granül içerir ve toplam PMNLE’ın sellüler konsantrasyonu 1-2 pg’a ulaşır. PMNLE en fazla nötrofillerde görülmesine rağmen küçük miktarlarda monosit ve T hücrelerinde eksprese edilmektedir. PMNLE’ın mRNA transkripsiyonu monosit veya makrofajlarda görülmemiştir. Nötrofiller aktive olduğunda PMNLE ekstrasellüler boşluğa stoplazmik granüller aracılığı ile hızla boşaltılırken yine de birtakım kalıntıları nötrofilik plazma membranına bağlı kalır (50). İnvitro Elastaz Substratlarının İnvivo Görevleri: PMNLE proteolizine maruz kalacak substrat listesi oldukça geniştir. Bunlar ekstrasellüler proteinler olup bunların en önemlileri: kollogen, elastin, fibrin, fibronektin, platelet 2B3A reseptörü ve kadherinlerdir. PMNLE’lar aynı zamanda koagülasyon faktörleri, immünglobulinler, kompleman ve proteaz inhibitörleri gibi birçok çözünebilen proteinlerin degrade edilmesinde de rol alırlar. Bunlara ek olarak PMNLE inflamasyonun negatif regülatörü olarakta görev yapar. Proinflamatuar sitokinlerin (IL-6, TNF) yıkımından da 27 PMNLE sorumludur. En son yapılan invitro deneyler PMNLE’ın hem IL-2 hem IL-6’yı degrade ettiğini göstermektedir. IL-2 T hücre aktivasyonu ve kemotaksisten sorumludur. PMNLE tarafından üretilen peptid fragmanlar T hücre adherasyonu, migrasyonu ve inflamasyonun modülasyonunu kontrol eder. IL-2 bu peptid fragmanların indüksiyonundan sorumludur. HLE eritrosit yüzeyinden CR1 ayrımından sorumludur. Açığa çıkan erimiş CR1 kompleman inhibitörü olarak görev yapar. PMNLE aynı zamanda proteolitik olarak CD-14 ün en önemli serbestleyicisidir. CD-14 bakteriyel lipopolisakkarit için en önemli reseptördür. Monosit ve fibroblastlarda bulunur. PMNLE; CD-14 ün hücre yüzeyinden daha az ekspresyonuna ve daha az TNF, IL-8 üretimine sebep olur. Bunu lipopolisakkarite cevaben yapar. D vitaminine bağımlı protein (DBP) nötrofillerin yüzeyine bağlanır ve C5a’nın sayıca artmasına neden olur. DBP’in bağlayıcı kısmını açığa çıkaran elastaz ekstrasellüler ortamdan DBP salınımını sağlar. Elastazın inhibisyonu nötrofil yüzeyindeki DBP akümülasyonuna olumsuz etki ederek, ko-kemotaktik aktivitesini engeller (50,59,60). Diğer invitro çalışmalar PMNLE’ın nötrofil adhezyonunda önemli rol oynadığını göstermektedir. CR3 integrini (aynı zamanda Mac-1 veya CD11b/CD18 olarak da bilinir) ligandlara bağlanır, fibrinojen ve ICAM-1 nötrofillerin endotel yüzeye yapışmasını sağlar. İnvitro PMNLE CR3’e bağlıdır. Eğer PMNLE başka türlü ligandlara bağlanırsa nötrofil adezyonunu azaltır, PMNLE integrinlerin kendi substratlarından sakınmasına sebep olur. PMNLE ICAM-1 ve CR3 arasındaki ilişkiyi düzenler. Bu sayede nötrofil adhezyon ve migrasyonu da düzenlenir (50,60-62). PMNLE’ın enflamasyonun bir down regülatörü olduğu; tüm bu bulgularla söylenebilir. Fakat potent bir proinflamatuar etkisi de saptanmıştır. Örneğin; nötrofillerin migrasyonu GM-CSF, IL-6 ve IL-8’in epitel hücrelerinden salınmasını sağlayarak artırır. PMNLE antiproteaz 1 inhibitörünün salınmasını sağlar ki; bu şekilde nötrofil kemotaksisi sağlanır. Ek olarak PMNLE interendotelyal (VE-kadherine) ve interepitelyal (E-kadherine) 28 gibi bağlayıcı proteinlerin yıkımını sağlayarak endotel ve epitel permeabilitesini artırarak pulmoner ödeme neden olur. PMNLE’ın çeşit ve heterojenite açısından değişken substratları hem fizyolojik hem patolojik bakımdan birbiri ile paradoksal olan sonuçlara neden olmaktadır (50). Elastazın Fonksiyonu ve Kontrol Mekanizması: Multipl proteaz inhibitörleri PMNLE ve diğer proteazların kontrolsüz proteolizinden konak dokuyu korur. Bunlar antiproteaz 1, sekrete edilmiş lökoproteaz inhibitörü, makroglobulin ve elgindir. Yine de nötrofiller birçok savunma mekanizmasını aynı zamanda işletebilen bir depoya sahiptir. Öncelikle nötrofiller nisbi olarak sekestre olup mikroçevrede korunmuş boşluk yaratır. Hacime karşı direnç sayesinde birçok endojen antiproteazlar bu bölgeye girmekten alıkonurlar ve elastazı bu şekilde inhibe edemezler. İkincil olarak antiproteazlar SLP1, antiproteaz 1 aktive nötrofillerden salınan oksidanlara duyarlıdır. Sonuçta aktive nötrofillerin hücre membranından PMNLE ekstre ettikleri kanıtlanmıştır. PMNLE aktive olur ve antiproteazların inhibisyonuna karşı koyar. PMNLE perisellüler ve çevre nötrofilli bölgelerde inhibitör olarak görev alır. SPL-1 bu korunmuş mikroçevreye girme özelliğine sahiptir. SPL-1 11.7 kilodalton polipeptid büyüklüğünde, muköz sekresyonlarda PMNLE karşıtı görev sahibi olan, PMNLE’a karşı rölatif küçük olan ve yine daha az oranda bulunan membran bağlı mikroproteindir (50,63). Elastaz’ın doku konsantrasyonu azaldığında reseptör rejenerasyonu sonuç itibariyle artar. Bu sayede hücrenin yabancı opsonojenlere karşı afinitesi artarak fagositoz olayı aktive olur. Nötrofil elastaz salınımı bu artmış fagositoz mekanizması sonucudur. Nötrofilik elastazın etkisi ile reseptör degredasyonu başlar. Bu da dokunun fagositoz özelliğini kısıtlar. Sonuç olarak dokunun elastaz konsantrasyonu azalır ve reseptör rejenerasyonu tekrar başlar. Bu bir kapalı denge sistemidir (52,64,65). 29 Nötrofiller Tarafından Elastaz Salınımı: Çeşitli sitokin ve kemoatraktanlar ile TNF, C5a, IL-8, LPS ve bakteri duvarından alınan fMLP’i nötrofiller elastaz salmak üzere stimüle edebilirler. Kalmodulin, LPS ile stimüle olan nötrofillerden elastaz salınımını artırır. İntegrinlerin mediatör salınımındaki rolü hala açık değildir. Bir çalışma; CD-18 veya CD-11B’ye karşı oluşan monoklonal antikorların kemoatraktanlarla stimüle olan nötrofillerden PMNLE salınımını; trombosit yüzeylere yapışsa bile; engellediğini göstermiştir. Bunun aksine başka bir çalışma CD-18 ile cross-match veren antikorlar izole insan nötrofillerinde intrasellüler kalsiyum artışı ve elastaz ekzositozunu artırdığını göstermiştir. Bu gözlemler endotelyal hücrelerdeki bilinmeyen parakrin faktörlerin nötrofil degranülasyonunun negatif regülasyonunu sağladığı görüşünü ortaya koymuştur. Elastazın da içinde olduğu intrasellüler sinyal transdüksiyon yolları pek açık olmamakla birlikte nötrofillerin cevaplı olduğu uyarılara bağlı olduğu düşünülmektedir. Lökotrienler, fosfolipaz C ve MAPK ailesi elastaz salınımına yardımcı olurlar (50). İntertisyuma Transvasküler Yönelimle Nötrofil Elastazın Yayılımı: Bazal Membran: Nötrofillerin direkt intertisyuma geçişini kolaylaştıran elastaz, bazal membrandan mediatör degredasyonuna yolaçar. Bu durum yapım ve tamirin zıttı olarak zordur. fMLP uyarılı nötrofil migrasyonu bazal membrana karşı olup bunu düşük molekül ağırlıklı proteinaz inhibitörlerinin etkilemediği görülmüştür. Daha az miktarlarda migrasyon sağlayabilir (50). Endotelyum: Nötrofillerin bazal membranı geçmesi için PMNLE gerekli olmasa da transendotelyal migrasyon için yine de katkı sağlar. İnsan umblikal ven endotelyal hücrelerinin kullanıldığı bir çalışmada bazal membransız tek katlı endotelyal hücrelerde elastazın inhibitörleri nötrofillerin PAF yada fMLP’ye cevaben transendotelyal migrasyonuna mani olmuştur. HLE hem endotelyal hem epitelyal kadherinleri degrade edebilmektedir. 30 Migrasyonda CD-11 ve CD-18’e ihtiyaç duyulabilir. Bazı uyarıcılar (formol-miristad asetat,endotoksin); CD-11 ve CD-18’e bağımlı nötrofil migrasyonunu sağlarken bazıları ise örneğin; Streptococcus pneumoniae; C5a, CD11, CD18’e bağımsız migrasyondan sorumludur. Nötrofil migrasyonunun değişik mekanizmalarla var olması selektif PMNLE katılımının bu mekanizmalara katkısı olduğunu gösterir. Bu şekilde CD-18 bağımlı nötrofil migrasyonu ve CD-18 bağımsız nötrofil migrasyonu invitro koşullarda PMNLE’a gerek duyulmadığını göstermiştir. Nötrofil bağımlı migrasyon fMLP’ye karşı bağımsız ise IL-8, LTB4’e karşı görülmüştür. Deneysel çalışmalarda nötrofil migrasyonunun aslında varolan kapiller bazal lamina delikleri aracılığı ile olduğu ki bu da elastazla indüklenen degredasyonla ortaya çıktığı saptanmıştır (50). Elastaz Nötrofiller için Migrasyonda bir Hedef mi?: Nötrofillerin TNF veya IL-8 ile stimülasyonu plazma membran elastaz aktivitesinin PMNLE’ın muhtemel bir immünmodülatör etkisi mekanizması dahilinde bir değişim gösterdiği çalışmalarda ortaya konmuştur. Elastaz bağlanması hücre membranının spesifik bölgesine doğru olmakta ve nötrofillerin migrasyonunun yönünü etkilememektedir. Membran bağımlı elastaz migratuar hücrelerin öncü uçlarında lokalizedir ve transendotelyal pasajı kolaylaştırır. Buna ek olarak elastazın kemoatraktanlar üzerindeki etkileri bu bölgede görülebilmektedir. ICAM-I yıkımı elastazla mümkün olup, elastaz nötrofilde adhezyonunun sübstrattan serbest hale gelmesini kolaylaştırmıştır (50,66). Elastaz Aracılı Sitotoksisite ve Yara İyileşmesi: Elastaz endotelyal hücrelere sitotoksiktir. Her ne kadar epitelyal hücreler relatif olarak elastazın sitotksik etkisine dirençli ise de endotelyal hücreler için geçerli değildir. İnsan mikrovasküler endotel hücre modeli ile çalışılan bir çalışmada PMNLE ile kombinasyon 31 dahilindeki fMLP ve C5a; LPS ile uyarıldığında dikkate değer endotel hücre lizisine neden olmakta ve bunlar serbest oksijen radikal toplayıcılarınca karşılanamamaktadır. Pürifiye PMNLE’a maruz kalma hücre lizisine neden olmakta ve benzer bir doku hasarına sebep olmaktadır, bunda da oksijen radikal toplayıcıları yetersiz kalmaktadır. PMNLE’ın tek başına neden olduğu yıkım veya nötrofil uyarıları ile oluşan halinde serum proteaz inhibitörleri ile önemli bir inhibisyon sağlamakta ve bu sayede lökosit elastazının nötrofil bağımlı endotelyal doku hasarında önemli bir rol oynadığı görülmektedir. Lökosit elastaz hücre yüzey proteinlerinin sindirilmesi yoluyla endotelyal hücre ayrışmasına neden olmaktadır. Son dönem bulgularımız elastaz aktivitesinin karşılanamadığı taktirde geçilmiş doku iyileşmesi de mümkün olamamaktadır (50). TGF-1 ekstrasellüler matrikse bağlı olarak elastaz ile salınmaktadır. SMLP1’in eksikliğinde TGF’nin aktif miktarı artmakta ve karşı gelinmeyen elastaz aktiviteleri ortaya çıkmaktadır (50,64). Lökosit elastazının; PMNL’in pulmoner mikrovaskülatör ve intertisyuma migrasyonu esnasında gerekli olmadığı görülmüştür. Bu sitotoksisite özelliği ile lökosit elastaz endotelyal hücrelerde nötrofillere karşı artmış bir gerginliğe sahip olmakta ve nötrofil translokasyonu için pek istenmeyen bir durum oluşmaktadır (50,60,64,67). LÖKOSİT ELASTAZIN SEPSİSLE İLİŞKİSİ: Şiddetli enflamasyonun temelinde yatan patolojik mekanizmada; azurofilik granüllü polimorfonükleer lökositlerdeki nötral proteaz ve elastazlar lizozomal fagositik enzimler olarak bilinmektedir (51). Nötrofiller büyüme faktörleri, sitokin ve kemokinleri salarak inflamatuar cevabı artırırlar (50). Elastaz sadece miktar yönünden dominant özelliğinin yanı sıra nötral pH aralığında da sübstrat nonspesifik özelliği ile de önemli bir ajandır. Humoral ve yapısal proteinlerin (pıhtılaşma, fibrinoliz, kompleman, Ig’ler, transport proteinleri, proteaz 32 inhibitörleri) nonspesifik yıkımında önemli rol oynayan elastaz aynı zamanda bazal membran proteinleri, hücre reseptörleri, fibronektin, elastin, kollajen, proteoglikan yıkımından da sorumludur. 1990’dan itibaren 90’dan fazla makalede; invitro 45’ten fazla proteinin lizisinden sorumlu olduğu gösterilmiştir. Pıhtılaşmanın inaktivasyon sekansında, fibrinoliziste, sistein proteinaz inhibitörlerinde ve heparin kofaktör 2’nin trombin inhibe edici aktivitesinde ve yine protein 5a ve 8a nın pıhtılaştırma etkisinde, protein S’nin inaktive edici etkisinde ve protein C’nin aktivasyonunda PMNLE’ın rolü büyüktür. Travma ile oluşan primer akciğer disfonksiyonunda elastaz ve mediatörleri endotel hücre hasarında akciğerin surfaktan assosiye proteinlerinin nötrofilik elastazlar ile yıkımında PMNLE’ın etkisi kaçınılmazdır. Nötrofile bağımlı TNF ve reseptörlerinin provakasyonundan da elastaz sorumludur. Enflamatuar proçesin otoregülasyonunda elastaz anahtar rol oynar. Tabi bu anahtar görevin yanında birçok ek görev üstlenen özgün vital enflamatuar protein ürünleri de görev alır. Elastazla uyarılan Ig G örneğin; kemotaksis ve oksidatif yanmayı engellerken proteolize olmuş elastin, α1proteinaz inhibitörü ve elastaz-α1-proteinaz inhibitörü kompleksleri potent kemoatraktanlar olarak görev yaparlar. İnsan nötrofillerindeki superoksit oluşumunu proteolize olmuş ve kompleks haldeki α1-kimotripsin inhibe eder (51). 33 MATERYAL VE METOD Çalışmamız; 01.06.2004-01.06.2005 tarihleri arasında Haseki Eğitim ve Araştırma Hastanesi Çocuk Kliniği Yenidoğan Servisinde yenidoğan sepsisi tanısı konularak izlenen 40 hasta ve kontrol grubu olarak ele alınan 20 sağlıklı yenidoğan üzerinde gerçekleştirildi. Çalışmaya gebelik yaşı ≥ 38 ile ≤ 42 hafta arasında olan, yaşamlarının ilk bir ayında klinik olarak sepsis bulguları (ısı düzensizliği, letarji, apne, taşipne, bradikardi, beslenme intoleransı, deri rengi değişikliği, hipotoni) bulunan yenidoğanlar alındı ve laboratuar değerlendirmeleri (hemokültür, biyokimya tetkikleri, tam kan sayımı, periferik kan yayması incelemesi, I/T nötrofil oranı, CRP, tam idrar incelemesi, PT, aPTT; gerekirse beyin-omurilik sıvı incelemesi, kan gazı, akciğer grafisi, ayakta direkt batın grafisi) yapıldı. PMNLE düzey tayini için alınan kanlar; hastanın rutin sepsis incelemeleri için kan alma sırasında alındı. Çalışma Haseki Eğitim ve Araştırma Hastanesi Etik Kurulunun izni ile yapıldı. Klinik olarak tanı konduğu gün birinci gün kabul edilerek PMNLE ve CRP düzeyi için birinci kan örnekleri alındıktan sonra tüm bebekler Töllner Skorlaması ile (deri renginde değişiklik, periferik dolaşım bozukluğu, hipotoni, bradikardi, apne, respiratuvar distres, hepatomegali, gastrointestinal sistem bulgusu, lökosit sayısı, sola kayma, trombositopeni, metabolik asidoz) değerlendirildi (68). Skorlamada ≥10 alan 40 bebek çalışma grubunu oluşturdu ve bütün bebeklere aynı gün intravenöz geniş spektrumlu ampirik kombine antibiyotik tedavisi başlandı. Tüm hastaların dördüncü gün CRP düzeyleri tekrar değerlendirildi ve PMNLE için tekrar serum ayrıldı. Ayrıca kontrol grubunu oluşturmak amacıyla hastaların gebelik yaşlarına ve tanı konduğu sıradaki postnatal yaşlarına uygun 20 sağlıklı bebekten herhangi bir nedenle kan örneği alındığı sırada CRP düzeyi ölçüldü ve PMNLE düzeyi ölçümü için serum ayrıldı. 34 Kültür pozitif, kanıtlanmış sepsisi ve klinik sepsisi (hemokültürde üreme olmayıp klinik ve yardımcı laboratuvar incelemeleri ile tanı koyulmuş hastalar) grup 1, herhangi bir nedenle kan alınan ve sepsis düşünülmeyen sağlıklı yenidoğanlar (kontrol grubu) grup 2 olarak ayrıldı. CRP Nefelometrik (BEC-Man Nephelometric CRP kit ) yöntem ile ölçüldü ve ≥ 6 mg/l’nin olması anlamlı kabul edildi. Tam kan sayımı ‘counter’ kullanılarak yapıldı. Lökosit sayısı ≥25000 /mm3 lökositoz, ≤5000 /mm3 lökopeni, trombosit sayısı ≤100000 /mm3 trombositopeni olarak kabul edildi. May-Grünwald ve Giemsa ile hazırlanan periferik kan yaymalarında I/T nötrofil oranı ≥0.20 ise artmış kabul edildi. Deri iyod-alkol ile temizlendikten sonra periferik venlerden ve farklı bölgelerden alınan 1-2 ml kan kültür örnekleri BACTEC (Peti-Bact blood culture, Organon Technica) besiyerine konularak değerlendirildi. Bir haftadan sonra üreme yoksa negatif kabul edildi, üreme olanlarda mikroorganizmanın cinsi saptandı ve disk difüzyon yöntemi ile antibiyogramları yapıldı. Kültürler bakteriyoloji laboratuvarında, biyokimya tetkikleri biyokimya ve klinik biyokimya laboratuvarlarında gerçekleştirildi. PMNLE Tayini: PMNLE tayini için 2 ml kan örneği düz tüplere alınarak 2500 devirde 10 dakika santrifüj edilerek plazması ayrıldı, mikropipet ile alınan plazma steril kapaklı plastik saklama tüplerine konularak – 20 OC’lik derin dondurucuda saklandı (PMNLE’ın biyoaktivitesinin azalmasından sakınmak için). Örnekler soğuk zincire uygun şekilde Türkiye Yüksek İhtisas Hastanesi’ne ulaştırılarak hematoloji laboratuarında çift kontrollü olarak çalışıldı. Çalışmadan önce yavaşça çözünerek oda ısısına getirildi. PMNLE düzeyleri; PMNLE kitleri (BMS 269) kullanılarak enzimimmunassay (ELISA) yöntemi ile ölçüldü. 35 Testin prensibi: -Tüm örnekler 1 : 100 oranında sulandırıldı. -Polystren mikroELISA stripleri (kuyuları) PMNLE poliklonal antikorları ile kaplı idi. Test örnekleri (0.1 ml) ve kalibratörler kuyulara ilave edilerek oda ısısında 3 saat inkübe edildi. -Kuyuya 0.1 ml konjugat (Horse Radish Peroksidaz (HRP)) ile işaretlenmiş PMNLE poliklonal antikorları ilave edildi. Oda ısısında 1 saat inkübe edildi. (Bu aşamada; PMNLE ile birinci ve ikinci antikorlar kompleks oluşturur.) -Kuyular dilüe fosfat tamponadı ile 4 kez yıkandı. (Yıkama işlemi ile ankonjuge durumdaki anti PMNLE birinci antikorları ortamdan ayıklanmış olur.) -Kuyulara 0.1 ml Tetra Metil Benzidin (TMB ) substratı ilave edildi. Oda ısısında 20 dakika inkübe edildi. Sonuçta mavi renk oluştu. -Reaksiyonu durdurmak için kuyulara 0.1 ml sülfirik asit ilave edildi ve renk sarıya dönüştü. Rengin şiddeti örneklerdeki PMNLE konsantrasyonu ile orantılıdır. MikroELISA okuyucusunda 450 nm’de absorbans okundu. Örnekteki PMNLE miktarı kalibrasyon eğrisinden değerlendirildi. İstatistiksel Yöntem: Verilerin analizi Microsoft Excel ve SPSS 11 for windows programında yapıldı. İki grup ortalamaları arasındaki fark Student-t, Mann-Witney U, Wilcoxon W ve ROC Analiz testleri ile saptandı. p<0.01 değeri anlamlı olarak kabul edildi. 36 BULGULAR Neonatal sepsis tanısı konularak Yenidoğan Servisine yatırılan 40 hastanın 26’sı erkek (%65) ve 14’ü kız (%35) idi. Gebelik yaşları 38-42 gestasyon haftası arasında olup ortalama 39.5 ± 1.20 GH’sı ve doğum ağırlıkları 3147 ± 423.28 gr olarak bulundu. 40 hastanın 10’u evde (%25), 30’u hastanede (%75) doğmuştu. Çalışmaya alındıkları postnatal yaş ortalaması 5.98 ± 4.33 gün idi (Tablo I). Herhangi bir sağlık sorunu olmayan 20 kontrol vakasının 13’ü erkek (%65), 7’si kız (%35) idi. Gebelik yaşları 38-42 GH arasında olup ortalama 39.8 ± 0.84 GH’sı ve doğum ağırlıkları 3149 ± 456 gr idi. 20 hastanın 5’i evde (%25), 15’i hastanede (%75) doğmuştu Çalışmaya alındıkları postnatal yaş ortalaması 7.0 ± 5.3 gün idi (Tablo I). Tablo I. Çalışma ve Kontrol Grubunun Özellikleri Yenidoğan sepsisli vakalar (n=40) Kontrol vakaları (n=20) Cins Erkek 26 ( % 65 ) 13 ( % 65 ) Kız 14 ( % 35 ) 7 ( % 35 ) Gebelik yaşı ( hafta ) 39.5 ± 1.20 ( 38-42 ) 39.8 ± 0.84 ( 38-42 ) Doğum ağırlığı (gr ) 3147 ± 423.28 ( 2450-4100 ) 3149 ± 456 ( 2500-4200 ) Ev 10 ( % 25 ) 5 ( % 25 ) Hastane 30 ( % 75 ) 15 ( % 75 ) Doğum yeri Çalışmaya alındığı yaş (gün) 5.98 ± 4.33 ( 1-30 gün ) 7.0 ± 5.3 ( 1-30 gün ) 37 Sıklık sırasına göre hasta grubunun klinik bulguları: Kusma %77.5, emmede azalma %72.5, hipotoni %55, ateş %52.5, sarılık %52.5, solunum sıkıntısı %42.5, dolaşım bozukluğu %42.5, huzursuzluk %32.5, siyanoz %25, apne %20, hipotermi %20, letarji %12.5, konvülsiyon %12.5, hepatomegali %10, ishal %7.5, batın distansiyonu %5, bradikardi %2.5 olarak bulundu (Tablo II). Tablo II. Yenidoğan sepsisli vakaların klinik bulgularının dağılımı Klinik Bulgular n % Kusma 31 % 77.5 Emmede azalma 29 % 72.5 Hipotoni 22 % 55 Ateş 21 % 52.5 Sarılık 21 % 52.5 Solunum sıkıntısı 17 % 42.5 Dolaşım bozukluğu 17 % 42.5 Huzursuzluk 13 % 32.5 Siyanoz 10 % 25 Apne 8 % 20 Hipotermi 8 % 20 Letarji 5 % 12.5 Konvülsiyon 5 % 12.5 Hepatomegali 4 % 10 İshal 3 % 7.5 Batında distansiyon 2 %5 Bradikardi 1 % 2.5 38 Çalışma grubunda saptanabilen enfeksiyon odakları sıklık sırasına göre şöyle sıralanmaktaydı; üriner sistem enfeksiyonu %12.5, gastroenterit %7.5, alt solunum yolu enfeksiyonu %5, menenjit %5 (Tablo III). Tablo III. Çalışma grubunda saptanan enfeksiyon odakları Üriner sistem enfeksiyon Gastroenterit Alt solunum yolu enfeksiyonu Menenjit n 5 3 2 2 % % 12.5 % 7.5 %5 %5 Kan kültüründe üreyen bakteriler ise sıklık sırasına göre; Koagülaz negatif Stafilokoklardan Staphylococcus epidermidis %12.5 ve Staphylococcus haemolyticus %5, Klebsiella oxitoca %10, Klebsiella pneumoniae %5, Grup B streptococcus %2.5 idi (Tablo IV). Tablo IV. İzole edilen bakterilerin dağılımı Bakteri cinsi n % Koagülaz negatif stafilokoklar Staphylococcus epidermidis Staphylococcus haemolyticus 7 5 2 % 17.5 % 12.5 %5 Klebsiella oxitoca 4 % 10 Klebsiella pneumoniae 2 %5 Grup B streptococcus 1 % 2.5 39 Sepsisli gruptaki vakaların 2’sinde (%5) menenjit saptandı. BOS kültürlerinde üreme olmadı. Kan kültürlerinde birisinde Klebsiella oxitoca, diğerinde Koagülaz negatif stafilococcus üredi. Menenjitli vakaların ikisinde de CRP ve PMNLE düzeyleri yüksekti (Tablo V). Tablo V. Menenjitli vakalara ait veriler No BOS kültürü 1 - 2 - Hemokültür PMNLE (ng/ml) CRP (mg/l) Klebsiella oxitoca 123.20 24 Koagülaz negatif stafilokoklar 131.70 48 Hastaların 3’ünde (%7.5) hemoglobin 10g/dl’nin altında, 4’ünde (%10) hematokrit %30’un altında, 7’sinde (%17.5) lökosit sayısı 25000/mm3’ün üzerinde, 10’unda (%25) trombosit sayısı 100000/mm3’ün altında, 33’ünde (%82.5) I/T nötrofil oranı 0.2’nin üzerinde, 10’unda (%25) kreatinin 1mg/dl’nin üzerinde, 16 hastada (%40) transaminazlar yüksek saptandı. Hasta ve kontrol grubunun laboratuar bulguları karşılaştırıldığında hasta grubunda hemoglobin, hematokrit, total protein, albumin kontrol grubuna göre düşük, PT, aPTT, BUN, CRP, lökosit sayısı, I/T nötrofil oranı yüksek bulundu. 40 Tüm hasta grubu ile kontrol grubu arasında hemoglobin, hematokrit, I/T nötrofil oranı, CRP, kreatinin, albumin değerleri arasında anlamlı fark saptandı (p<0.01) (Tablo VI). Tablo VI. Sepsis pozitif ve sepsis negatif vaka gruplarındaki labaratuar bulguları Labaratuar bulguları Hemoglobin (g/dl) Hematokrit (%) 3 Lökosit sayısı (/mm ) 3 Trombosit sayısı (/mm ) İmmatür /Total nötrofil (I/T) Sepsis (n=40) X ± SD Kontrol (n=20) X ± SD p 16.4 ± 4.05 19.95 ± 4.26 <0.005 47.98 ± 11.69 55.45 ± 2.31 <0.001 16641.5 ± 7455.4 13970.0 ± 7556.04 230975 ± 139478.7 196430 ± 108331.4 <0.1 <0.3 0.26 ± 0.12 0.09 ± 0.05 <0.0001 CRP (mg/l) 26.95 ± 26.83 6.20 ± 2.67 <0.0001 PT (sn) 17.05 ± 6.13 15.25 ± 2.47 <0.2 aPTT (sn) 37.3 ± 8.64 34.40 ± 3.49 <0.15 AST (U/L) 50.28 ± 24.87 47.30 ± 22.48 <0.6 ALT (U/L) 24.25 ± 16.61 29.70 ± 16.30 <0.2 BUN (mg/dl) 10.58 ± 4.82 12.70 ± 5.73 <0.1 Kreatinin (mg/dl) 0.74 ± 0.32 0.56 ± 0.23 <0.002 Total protein (g/dl) 5.71 ± 0.69 5.60 ± 0.50 <0.5 Albumin (g/dl) 3.47 ± 0.57 3.03 ± 0.32 <0.002 Çalışma ve kontrol grubundaki bebekler cinsiyet, gebelik yaşı, doğum ağırlığı açısından değerlendirildiklerinde gruplar arasında anlamlı fark saptanmadı (p>0.05). Çalışma grubunda tedavi başlanmadan birinci günde ve dört günlük tedavi sonrasında PMNLE ve CRP düzeyleri bakıldı (Tablo VII). Yaşama etkisi araştırıldı. Kontrol grubunda çalışmaya alındığı günkü PMNLE ve CRP değerleri birinci günkü değer olarak kabul edildi (Tablo VIII). Çalışma grubunun birinci günkü PMNLE ve CRP düzeyleri kontrol grubu ile karşılaştırıldı (Tablo IX). 41 Tablo VII. Hasta grubundaki PMNLE ve CRP düzeyleri Vaka no 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 PMNLE (ng/ml) 1.gün 123.20 131.70 135.50 144.60 138.00 147.10 137.90 184.40 121.90 134.40 127.50 133.70 147.30 123.80 137.10 195.50 151.00 184.70 150.10 100.20 148.60 142.90 258.00 105.00 147.30 149.70 131.70 152.70 123.50 275.00 104.40 137.40 138.00 106.10 122.60 139.00 140.50 151.40 159.10 120.30 PMNLE (ng/ml) 4.gün 80.90 86.30 86.30 113.80 120.00 113.50 109.60 136.60 105.30 108.10 144.80 110.10 59.20 100.60 102.50 155.20 55.60 106.70 84.50 86.40 109.40 81.20 123.50 61.10 52.20 87.30 80.10 81.40 88.10 151.80 102.70 83.00 94.40 80.70 108.60 77.30 113.30 142.50 113.40 68.10 CRP (mg/l) 1.gün 24 96 24 4 12 12 96 12 48 12 96 48 48 12 12 4 24 4 4 24 48 12 48 48 48 72 4 54 8 8 8 8 24 24 12 4 8 12 4 8 CRP (mg/l) 4.gün 4 48 192 4 4 48 192 12 12 4 192 4 4 4 4 12 4 4 4 4 4 4 24 24 12 24 4 4 4 4 4 12 4 4 4 4 4 4 4 4 42 Tablo VIII. Kontrol grubunda PMNLE ve CRP düzeyleri Vaka no 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 PMNLE (ng/ml) 1.gün 81.40 95.00 71.20 68.70 96.80 81.20 63.50 73.00 69.70 77.00 68.40 84.10 61.20 74.80 86.40 64.50 67.20 73.60 81.00 73.20 CRP (mg/l) 1.gün 4 4 6 8 4 12 4 4 8 8 4 4 4 8 8 4 6 4 8 12 Tablo IX. Hasta ve kontrol grubunda PMNLE ve CRP düzeylerinin karşılaştırılması PMNLE (ng/ml) CRP (mg/l) Sepsis (n=40) X ± SD Kontrol (n=20) X ± SD p 145.07 ± 34.67 75.59 ± 9.81 <0.0001 26.95 ± 26.83 6.20 ± 2.67 <0.0001 Çalışma grubunda mortalite oranı %7.5 (3/40) olarak bulundu. Ölen hastaların hepsinde birinci gün PMNLE düzeylerinin ortalamanın üstünde olduğu saptandı. Birinci ve dördüncü günkü PMNLE ve CRP düzeylerinin yaşama etkisi açısından anlamlı fark bulunmadı (p>0.05) (Tablo X). 43 Tablo X. Exitus ile sonuçlanan vakalarda PMNLE ve CRP düzeylerinin yaşama etkisi Vaka no PMNLE (ng/ml) PMNLE (ng/ml) 1.gün 4.gün CRP (mg/l) 1.gün CRP (mg/l) 4.gün 5 138.00 120.00 12 4 33 138.00 94.40 24 4 36 139.00 77.30 4 4 Sepsis saptanan hasta grubu ile kontrol grubu arasında PMNLE düzeyleri, CRP düzeyleri, I/T nötrofil oranları, lökosit sayıları ve trombosit sayıları ölçüldü ve ortalamaları ile standart sapmaları hesaplandı. Her iki gruba ait verilerin Student-t testi ile istatistiksel anlamlılıkları araştırıldı (Tablo XI, XII). ROC Analizi yapıldı. Sonuçta çalışma ve kontrol grubu arasında lökosit ve trombosit sayılarının karşılaştırması açısından anlamlı fark yokken; PMNLE, CRP, I/T nötrofil oranları arasında anlamlı fark saptandı. Tablo XI. Labaratuar bulgularının sepsis ve kontrol grubunda dağılımı Parametreler Kültür pozitif sepsis (n=14) Klinik sepsis (n=26) Kontrol grubu (n=20) PMNLE artışı 12 (% 85.7) 22 (% 84.6) 0 (% 0) CRP artışı 12 (% 85.7) 21 (% 80.7) 10 (%50) I/T artışı 13 (% 92.8) 20 (% 76.9) 2 (%10) Lökositoz ve lökopeni 3 (% 21.4) 5 (% 19.2) 2 (%10) Trombositopeni 3 (% 21.4) 7 (% 26.9) 2 (%10) 44 Tablo XII. Laboratuar bulgularının sepsis ve kontrol grubunda karşılaştırması Parametreler Kontrol grubu t p 75.5 ± 9.80 8.754 <0.0001 26.95 ± 26.83 6.20 ± 2.67 3.436 <0.0001 I/T nötrofil (%) 0.26 ± 0.12 0.09 ± 0.05 6.338 <0.0001 Lökositoz veya lökopeni (/mm3) 16641.5 ± 7455.4 13970.0 ± 7556.4 1.303 <0.101 Trombositopeni (/mm3) 230975 ± 139478.7 196430 ± 108331.4 0.970 <0.428 PMNLE (ng/ml) CRP (mg/l) Sepsis grubu 145.07 ± 34.6 Bu veriler doğrultusunda serum PMNLE değerlerinin özgünlüğü %96.3, duyarlılığı %94.6, negatif tahmin değeri %93.5, pozitif tahmin değeri %95.1 olarak hesaplandı. Bu sonuçlar; PMNLE düzeyi ölçümünün; sepsis tanısı koymada ve tedaviye cevabı değerlendirmede Student-t testine göre anlamlı olduğunu gösterdi (p<0.01) (Tablo XIII). Tablo XIII. Laboratuar bulgularının istatistiksel değerlendirilmesi Özgünlük Duyarlılık Negatif tahmin değeri Pozitif tahmin değeri Artmış PMNLE % 96.3 % 94.6 % 93.5 % 95.1 Artmış CRP % 90.3 % 91.2 % 91.1 % 89.7 Artmış I/T % 93.2 % 80.5 % 82.7 % 93.0 Lökositoz veya lökopeni % 88.2 % 60.3 % 64.8 % 89.7 Trombositopeni %87.71 % 58.02 % 59.52 % 87.03 PMNLE’ın birinci gün düzeyleri sepsis grubundaki 4 vakada ortalamanın altında saptanırken, kontrol grubundakilerde hepsi ortalamanın altında idi. Sepsis grubunda CRP 7 vakada normal (<6mg/l) bulunurken kontrol grubunda 10 vakada yüksek bulundu (Tablo VII, VIII). Ortalama PMNLE düzeyleri sepsis grubunda 145.07 ± 34.6 ng/ml, kontrol grubunda 75.59 ± 9.81 ng/ml bulundu. Hasta ve kontrol gruplarının PMNLE düzeyleri istatistiksel olarak karşılaştırıldığında anlamlı fark saptandı (p<0.0001) (Tablo XII). 45 Sepsis skoru ≥10 olan hastalarda birinci gün serum PMNLE düzeyleri sepsis skoru <10 olanlardan daha yüksekti. Tedavi öncesi; birinci gün 145.07 ± 34.67 ng/ml olan PMNLE düzeyleri tedavi sonrası, dördüncü gün 99.15 ± 25.45 ng/ml’ye geriledi. Birinci günkü PMNLE düzeylerine göre dördüncü günkü düzey 39 vakada anlamlı derecede düşüktü. İstatistiksel karşılaştırmada Wilcoxon Signed Ranks Testi kullanıldı (p<0.0001). Birinci günkü CPR düzeyleri 26.95 ± 16.83 mg/l iken dördüncü gün 22.8 ± 19.95 mg/l idi. Aralarındaki ilişki yine aynı test ile araştırıldı. 27 vakada dördüncü günkü CRP düzeyleri birinci gün ölçülen düzeylerden düşüktü ve fark anlamlı idi (p<0.0001) (Şekil I,II). 46 160.000 140.000 120.000 100.000 Sepsis Kontrol 80.000 60.000 40.000 20.000 0 1.GÜN Şekil I. 4.GÜN Sepsis ve kontrol grubunda PMNLE düzeyleri (ortalama). PMNLE düzeyleri sepsis grubunda birinci gün 145.07 ± 34.67 ng/ml, dördüncü gün 99.15 ± 25.45 ng/ml, kontrol grubunda PMNLE düzeyleri birinci gün 75.59 ± 9.81 ng/ml, dördüncü gün 74.22 ± 8.34 ng/ml. 47 30 25 20 Sepsis Kontrol 15 10 5 0 1.GÜN Şekil II. 4.GÜN Sepsis ve kontrol grubunda CRP düzeyleri (ortalama). CRP düzeyleri sepsis grubunda birinci gün 26.95 ± 16.83 mg/l, dördüncü gün 22.88 ± 19.95 mg/l, kontrol grubunda CRP düzeyleri birinci gün 6.2 ± 2.67 mg/l, dördüncü gün 5.9 ± 2.01 mg/l. 48 TARTIŞMA Sepsis halen tüm yenidoğanlarda önemli morbidite ve mortalite nedenlerinden biri olmaya devam etmektedir. Yenidoğan sepsisinin başlangıç dönemindeki özgün olmayan bulgular gereksiz veya gecikmiş antibiyotik kullanımına neden olabilmektedir. Kesin tanı kriteri olan kan kültürü üremesi; hem tüm hastalarda sağlanamamakta hem de sonuçlar en az 24 saat sonra elde edilebilmektedir. Günümüzde erken dönemde yenidoğan sepsisinin tanısında kullanılabilecek duyarlılığı ve özgünlüğü yüksek bir test henüz bulunamamıştır. Bu amaçla birçok hematolojik ve biyokimyasal tanı göstergelerinin tek başlarına ve birlikte etkinlikleri araştırılmıştır (69). Çalışmamızdaki 40 hasta grubunun 26’sı erkekti. Bu sonuç erkek çocuklarda sepsisin daha sık görüldüğünü bildiren literatür verileri ile uyumlu idi (10,31). Yenidoğan sepsisinin klinik belirtileri arasında ateş, kusma, taşipne, taşikardi, mental durum değişiklikleri en sık görülenlerdir. Sepsisin tanısı için ana belirti olan ateş bazı mediatörlerin (IL6, IL1, TNF, PGE2, INF) salınımı sonucu oluşur (2). Bizim çalışmamızdaki hastaların başvuru şikayetleri sıklık sırasına göre; kusma %77.5, ateş %52.5, mental durum değişiklikleri %50, taşipne %42.5, taşikardi %42.5 idi (Tablo II). Çalışma grubunun 20’sinde (%50) yenidoğan sepsisi için risk faktörü vardı. 10 olguda (%25) evde doğum, 6 olguda (%15) erken membran rüptürü, 4 olguda (%10) maternal üriner sistem enfeksiyonu ve septik doğum vardı. Bu risk faktörleri literatür bilgileri ile uyumlu idi ( 70,71,72). Gelişmekte olan ülkelerde alt solunum yolu enfeksiyonu, akut gastroenterit, MSS enfeksiyonu, üriner sistem enfeksiyonu sık görülen ölüm nedenleridir. Ülkemizde de bu hastalıklar sepsise ve ölüme yol açarlar (73). 49 Yenidoğan sepsisli hastalarımızın enfeksiyon odakları sıklık sırasına göre üriner sistem enfeksiyonu, gastroenterit, alt solunum yolu enfeksiyonu ve menenjit idi (Tablo III). Yenidoğan sepsisinde kırmızı hücre yapımı azalır ve uzamış enfeksiyöz süreçte bu daha belirgin hale gelir (2). Çalışmamızda neonatal sepsisli hastalarda kontrol grubuna göre hemoglobin ve hematokrit değerleri daha düşük ve istatistiksel olarak bu anlamlıydı (p<0.01). Yenidoğan sepsisinde lökosit sayısı genellikle artar (2). Bizim çalışmamızda sepsis grubunda kontrol grubundan daha yüksek olmak üzere lökosit sayıları her iki grupta da yüksek bulundu ve istatistiksel olarak anlamlı değildi (p>0.05). Kontrol grubundaki lökositozun nedeni yenidoğanlarda ilk günlerde artmış olan granulopoeze bağlandı. Periferik kanda bakılan I/T nötrofil oranı literatürde özgünlüğü (%50-70), duyarlılığı (%73.4), negatif tahmin değeri (%74.6) düşük olarak belirtilmektedir (74). Sepsis grubunda I/T nötrofil oranı 33 vakada (%82.5) yüksek bulunurken, literatürde tek başına I/T nötrofil oranının özgünlüğünün düşük (%50-78) olduğuna dair çalışmalar bildirilmektedir. Bizim çalışmamızda bu oran %96.3 olarak bulunmuştur. Ancak I/T nötrofil oranının duyarlılığının %80.5 ve negatif tahmin değerlerinin %82.7 olarak, düşüklüğü güvenilirliğini gölgelemektedir (Tablo XIII). CRP sepsisin erken tanısında 1980’li yılların başlarında klinik kullanıma girmiş bir akut faz reaktanıdır (75). Üzerinde en çok araştırma yapılan ve klinikte en çok kullanılan test CRP’dir. Fakat travma, cerrahi müdahale, yanıklar, intramuskuler uygulamalar, kan alma gibi spesifik olmayan birçok durumda yalancı pozitiflik gelişebilmektedir. Duyarlılık ve negatif tahmin değerlerinin yüksek olmaması nedeniyle CRP kesin tanıda tek başına yeterli değildir (76,77). Araştırmaların sonuçları CRP’nin enfeksiyonun başlangıcında yeterli duyarlılığı (%50-70) ve özgünlüğü (%60-90) olmadığını, çünkü CRP’nin enfeksiyöz olayın başlamasından 10-12 saat sonra yükselmeye başladığını, 60. saatte pik yaptığını 50 göstermektedir (78,79). Ayrıca seri ölçümlerle yapılan değerlendirmelerde CRP’nin duyarlılığının enfeksiyonun başlangıcından 1-3 gün sonra %75-98’e, özgünlüğünün %90’a, negatif prediktif değerinin %99’a çıktığını göstermiştir (79,80). Enfeksiyonun başlangıcına göre geç yükselen CRP’nin sepsis tanısının konulmasında ve antibiyotik tedavisine başlama kararının verilmesinde tek başına kullanılmaması ve pratikte seri ölçümler yapılarak tedavi etkinliğinin değerlendirilmesinde, komplikasyonların saptanmasında ve enfeksiyonun olmadığının gösterilmesinde kullanılması önerilmektedir. Bizim çalışmamız da birinci ve dördüncü günde bakılan CRP değerlerinin kontrol grubuna göre istatistiksel olarak anlamlı (p<0.0001) derecede yüksek olduğunu, günler içerisinde giderek azaldığını ve birinci gün bakılan CRP’nin duyarlılığının %91.2, özgünlüğünün %90.3 olduğunu göstermektedir (Tablo XIII). Fibronektin, haptoglobin gibi akut faz reaktanları da 1980’li yıllarda sepsis erken tanısında dikkati çekmiştir. Ancak enfeksiyon yanıtları CRP’ye oranla daha yavaş olduğundan klinik kullanımları sınırlıdır. Fibronektin düzeyleri, yenidoğan sepsisinde azalmakla birlikte respiratuar distres sendromu, perinatal asfiksi ve intrauterin büyüme geriliği gibi durumlardan da etkilenmesi nedeniyle pratik kullanımı tartışmalıdır (75,81). Haptoglobin ise bir akut faz reaktanı olarak sepsise ek olarak travma, yanık, steroid kullanımı gibi birçok durumda yükselmekte; karaciğer hastalıkları ve hemolitik anemiler gibi bazı durumlarda da düşmektedir (81). Yenidoğan sepsisindeki klinik bulgulardan salıverilen sitokinler büyük oranda sorumludur. Bunlardan yenidoğan sepsisi tanısında en önemlileri IL6, IL8, TNFα’dır. Ancak viral enfeksiyonlar, steroid tedavisi, otoimmun hastalıklar, sistemik enflamatuar hastalıklar, cerrahi girişimler, transplantasyon reddi gibi durumlarda da yükselmeleri tanısal değerlerini düşürmektedir (82). 51 Yenidoğan sepsisine bakteriler, viruslar, mantarlar, riketsialar neden olabilir. Bunlar arasında en sık neden Gr(-) bakterilerdir (3,10,83). Hemokültür sepsis tanısında altın standarttır. Ancak etkenin üretilebilmesi için alınışından itibaren en az 24-48 saat geçmesinin gerekliliği bazı mikroorganizmaların (GBS, H.influenza, L.monocytogenes, anaeroblar gibi) üretilmesindeki güçlükler, kontaminasyona bağlı yalancı pozitiflik gibi bazı olumsuzlukları da birlikte taşımaktadır (75,83). Bu nedenle yenidoğan sepsisi erken tanısı mutlaka diğer klinik ve laboratuvar parametreleri ile desteklenmelidir. Whalen ve arkadaşları yenidoğan sepsisli hastaların %71.4’ünde kan kültürünü pozitif saptamışlar (84). Sessler ve arkadaşları hastaların %28’inde kan kültürünü negatif saptamışlardır (85). Bamberger ve Gurley çalışmalarında hastaların %50’sinde etyolojik ajan saptayamamışlardır (86). Çalışmamızda hastaların 14’ünde (%35) hemokültürde üreme oldu. Hemokültürde üreme olan hastaların 7’sinde (%17.5) Koagülaz negatif Stafilococcus, 4’ünde (%10) Klebsiella oxitoca, 2’sinde (%5) Klebsiella pneumoniae, 1’inde (%2.5) GBS üredi (Tablo IV). Çalışmamızda en çok üretilen mikroorganizma Koagülaz negatif Stafilokoklar idi. Bunlar geç başlangıçlı sepsise yol açan, yenidoğan ünitelerindeki bebeklerden sık olarak izole edilen, tedaviye dirençli bir mikroorganizmadır. Diğer olgularda üreyen mikroorganizmalar da literatür bulguları ile uyumlu idi. Geç başlangıçlı sepsis etkenleri; Gr (-) basiller, Klebsiella pneumoniae, E.coli, Serratia marcescens, Pseudomonas, S.aureus ve Candidadır (70,87,88). Madsuda ve arkadaşları; Granülosit elastaz düzeyi ile perinatal enfeksiyon ilişkisini araştırmışlar, perinatal enfeksiyonda bir prediktör faktör olarak granülosit elastaz düzeyinin ölçümü ne derecede faydalıdır sorusuna cevap aramışlardır. 48 saat içerisinde amniyosentez ile sistemik bakteriyel enfeksiyon şüphesi olan ve 41 doğumu yapılan hasta üzerinde 52 çalışılmıştır. Servikal granülosit elastaz (Cx-E), CRP ve amniyotik sıvı granülosit elastaz (AfE) ve plasental enfeksiyon ve yenidoğan enfeksiyonu mevcudiyeti kıyas edilerek araştırılmıştır. Bazı vakalarda gastrik sıvı granülosit elastazı (Gj-E) ölçülmüş ve korelasyon ilişkisi araştırılmıştır. Elastaz değerleri bir kontrol protokolü olmadan kullanılmamıştır. Yenidoğan enfeksiyonların teşhisinde tanısal efikasite (sensitiviteXspesifite); plasental enfeksiyonda 0.97, anormal Af-E değerinde 0.79 ölçülerek anormal Cx-E değerlerine göre (0.40) ve anormal CRP’ye göre (0.49) yüksek bulunmuş. Cx-E, Af-E arasında bir korelasyon saptanmamış ve Cx-E, Cj-E arasında da korelasyon saptanmamıştır. Ama Af-E, Gj-E arasında anlamlı bir korelasyon saptanmıştır. Anormal amniyotik sıvı tayininde Cx-E (>=1.2 μg/ml) + CRP (>=1.0 mg/dl) en önemli tanısal efikasite değerine sahip olarak tanımlanmıştır (0.58). Bu sonuçlar gösterir ki Af-E değeri önemli bir diagnostik yenidoğan enfeksiyon kriteridir, İntrauterin enfeksiyonda tanısal amaçla amniyosentezin şayet servikal elastaz ve CRP düzeyi yüksekse önerilebilir olduğunu söylemişlerdir (89,90). Yenidoğan sepsisinde mortalite %20-50 arasında değişmektedir. Çalışmamızda mortalite oranı %7.5 olarak bulundu. Bu sonuç literatürle uyumlu değildi (31,35). Bunun nedeni çalışmanın yapıldığı dönemde yenidoğan yoğun bakım ünitemizin olmayışı ve yoğun bakımda izlem gerektiren ağır sepsisli vakaların çalışmaya alınamamasına bağlandı. Lawskoska ve arkadaşları; 143 yenidoğanın kord kanında nötrofil elastaz seviyesi bakmışlardır. Yenidoğanlar; term ve enfekte olmayanlar, term ve enfekte olanlar, preterm ve enfekte olmayanlar, preterm ve enfekte olanlar Çalışmada düşük kordon kan elastaz olmak üzere dört gruba ayırmışlardır. konsantrasyonu bulunan prematür yenidoğanları almışlardır. Bu değer; nonenfekte pretermlerde anlamlı derecede düşük (p<0.001) ve enfekte yenidoğanlarda yüksek bulunmuştur (p<0.05). Fullterm enfekte yenidoğanlarda ortalama elastaz konsantrasyonu sağlıklılara kıyasla anlamlı derecede yüksek (p<0.01) saptanmıştır. Kordon kanı elastaz değerleri, %87 oranında enfekte fulltermlerde ve %6 oranında enfekte 53 pretermlerde üst limit olan 209.3 ug/L’yi aşmakta iken; %97 oranında preterm yenidoğanlarda; klinik bulgular olsun veya olmasın referans aralığında kalmıştır. Sonuç olarak kordon kanı PMNLE düzeyindeki değişiklikler anlamlı derecede GH ile ilgili bulunmuştur. Bu yaş bağımlı değişiklikler göz önüne alınmak kaydıyla kordon kanı elastaz konsantrasyonu yenidoğan sepsisi erken tanısında önemli bir indikatör olarak kabul edilebilir denmiştir. Ayrıca araştırmacılar fullterm yenidoğanlarda kordon kanı PMNLE düzeyinin iyi bir enfeksiyon markeri olduğunu göstermişlerdir (91). Çalışmamızda sepsis grubunda PMNLE düzeyleri 145.07±34.6 ng/ml, kontrol grubunda 75.59±9.81 ng/ml olarak ve tedavinin dördüncü gününde sepsis grubunda bakılan PMNLE 99.15±25.45 ng/ml olarak saptandı (Tablo VII,VIII). Serum PMNLE düzeyi, sepsisli yenidoğanlarda kontrol grubuna göre belirgin olarak yüksek bulundu ve yenidoğan sepsisi ile PMNLE konsantrasyonu arasında istatistiksel olarak anlamlı ilişki saptandı (p<0.0001). Bir çalışmada; Tsaka ve arkadaşları; 135 yenidoğan üzerinde 28 gün takiple PMNLE kantitatif analiz çalışmasında 15 yenidoğanda anlamlı derecede artmış olarak bulmuşlardır. PMNLE aktivitesi enfeksiyonla tanışılan birinci günden itibaren görülmüştür. Anlamlı düzey 65 mcg/l kabul edilmiş ve elastaz düzeyinin normalleşmesi sadece gerçekten de klinik bulgular gerileyince gözlemlenmiştir. Bunun klinik önemi plazma elastaz düzey tayini güncel hastane ortamında neonatoloji bilimi açısından da sensitif bir sistemik enfeksiyon markeri olarak kullanılabilir. Yine aynı zamanda hastalığın gidiş hali hakkında iyi bir fikir verir. Çünkü PMNLE birebir olarak hastanın klinik durumu ile koreledir (92). Çalışmamızda yenidoğan sepsisli grupta tedavinin dördüncü gününde bakılan serum PMNLE düzeyleri birinci günkülere göre anlamlı derecede düşüktü (p<0.05) (Tablo VII). Jensen ve arkadaşları; yenidoğanlarda enfeksiyon parametresi olarak kapiller nötrofil elastaz α1 proteinaz inhibitörü kullanmışlardır. Artmış plazma nötrofil elastaz düzeyi 54 yenidoğanda erken ve efektif bir enfeksiyon markeri olarak kabul edilebilir. 79 yenidoğan serisi olan bu örnek çalışmada bakteriyel enfeksiyonun bulunduğu yenidoğanlarda CRP’e karşı elastaz cevabı immatür/matür nötrofil profiliyle kıyaslanarak enfeksiyonla ilgili bir korelasyon aranmıştır. Elastazdaki artış CRP artışı ile korele görülmüş ve semptomatolojinin ortaya çıkışı ile korele olmuştur (93). Wojsyk ve arkadaşlarının çalışması; PMNLE’ın erken yenidoğan sepsisinde tanı açısından güvenilirliği ile ilgilidir. PMNLE’ın serum konsantrasyon değerlerini, erken yenidoğan sepsisi teşhisi açısından diğer rutin enfeksiyon markerları ile kıyaslamışlardır. PMNLE düzeyi 74 sistemik bakteriyel enfeksiyon şüphesi olan 3. düzey Yoğun bakım ünitesi hastalarında ölçülmüştür. Ortalama PMNLE değeri nonenfektif yenidoğanlarda 38-85 ng/ml iken, enfekte neonatallerde 184.12 ng/ml (p<0.05) saptanmıştır. Kültürle ispatlı bakteriyel sistemik enfeksiyon vaka sayısına göre %76 PMNLE sensitif çıkmıştır. CRP kıyasına göre %60 sensitif saptanmıştır. Total nötrofil oranına göre %59 sensitif ve tam kanda total beyaz küre sayısına göre %56 sensitif bulunmuştur. Sırasıyla ilgili spesifite ise %81, %86, %100, %80 saptanmıştır. Sonuçta serum PMNLE düzeyi diğer rutin sepsis teşhis kriterlerine oranla daha değerli bir erken endikatör olarak kullanılabilir denmiştir (94). Çalışmamızda sepsis grubundaki 40 vakadan 36’sında (%90) yüksek PMNLE düzeyleri, 34’ünde (%85) yüksek CRP düzeyleri, 33’ünde (%82.5) yüksek I/T nötrofil oranları, 9’unda (%22.5) lökositoz veya lökopeni, 9’unda (%22.5) trombositopeni saptanmıştır. Yenidoğan sepsisi saptanmayan kontrol grubundaki 20 vakada PMNLE düzeyleri ortalamanın altında saptanmıştır. 10’unda (%50) yüksek CRP düzeyleri, 2’sinde (%10) yüksek I/T oranları, 2’sinde (%10) lökositoz, 2’sinde (%10) trombositopeni saptanmıştır (Tablo XI). Kontrol grubundaki vakalardaki CRP yüksekliği intramuskuler uygulamalar ve yenidoğan taramaları için kan alınmasına, I/T oranındaki yükseklik yenidoğanların ilk 55 günlerde band nötrofil oranlarının yüksek oluşuna; lökositoz yenidoğanların ilk günlerde olan artmış granulopoezine, trombositopeni de annede olan trombositopeniye ve annedeki ilaç kullanımına bağlandı. Yaptığımız çalışmada sepsisli vaka grubunda akut faz proteinlerinden CRP yine anlamlı düzeyde yüksek sonuçlar vermiştir. Ancak CRP’nin yüksek bulunmadığı 7 vakada PMNLE değerleri yüksek bulunmuştur. PMNLE'ın yükselmediği 4 vakada ise yüksek CRP düzeyi saptanmıştır. Kontrol grubunda ise PMNLE düzeyleri hiçbirinde yüksek saptanmamış, 10 vakada CRP yüksek bulunmuştur. Bu da PMNLE’ın yalancı pozitiflik oranının CRP’ye göre daha düşük olduğunu göstermektedir (71). Çalışmamızda yenidoğan sepsisi saptanan ve saptanmayan gruplar incelendiğinde serum PMNLE düzeylerinin duyarlılığı %94.6, özgünlüğü %96.3, pozitif tahmin değeri %95.1, negatif tahmin değeri %93.5 olarak saptanmıştır. CRP için ise bu oranlar duyarlılık %91.2, özgünlük %90.3, pozitif tahmin değeri %89.7, negatif tahmin değeri %91.1 olarak bulunmuş olup; literatürle uyumludur (Tablo XIII) (95,96). Çalışmamızda yenidoğan sepsisli hastalarda PMNLE düzeyleri ile CRP, I/T nötrofil oranları, lökosit sayısı, trombosit sayısı karşılaştırıldı. Lökosit ve trombosit sayısı ile anlamlı ilişki saptanmadı (p>0.05) (Tablo XI, XII). Çalışmamızda yenidoğan sepsisinin tanısında ve prognozunun tayininde serum PMNLE düzeyinin bir belirteç olabileceğini bulduk. Mortalite ve morbiditenin saptanması ve önlenmesinde erken bir haberci olabileceğini saptadık. Ülkemizde PMNLE düzeylerinin ölçümü yenidoğan sepsisi tanısında kullanılan bir yöntem değildir. Bunun nedeni pahalı bir yöntem olmasıdır. Yenidoğan sepsisinin erken tanısına yardımcı olması ve prognoz açısından prediktif değerinin yüksek olması nedeniyle; rutin kullanıma girmesi kabul gördüğünde PMNLE tayini için maliyeti daha düşük yeni 56 yöntemler geliştirilmesi için çalışmalar yapılması gerektiğini düşünüyoruz. Yenidoğan sepsisinin pediatrik enfeksiyonlar içinde mortalitesi en yüksek ve tedavi masrafları çok yüksek olan bir hastalık olduğu düşünülecek olursa maliyetin ikinci plana itilebileceği kanısındayız. Çalışmamızda enfeksiyon göstergeleri arasında duyarlılık, özgünlük, negatif ve pozitif tahmin değerleri en yüksek PMNLE bulunmuştur. PMNLE diğer sepsis göstergeleri ile beraber kullanıldığında yenidoğan sepsisinin kesin tanısında iyi sonuçlar alınabilecektir. Elde edilen verilerin sonucunda PMNLE’ın bir enfeksiyon göstergesi olarak yenidoğan sepsisinin tanısındaki skorlama sistemleri içerisine girmesi gerektiğini düşünüyoruz. 57 SONUÇLAR 1. Çalışmamızda yenidoğan sepsisli erkek çocukların kızlardan fazla olduğunu saptadık. 2. Hastaların %5’inde menenjitte eşlik ediyordu. 3. Yenidoğan sepsisinde mortalite oranı %7.5 olarak bulundu. 4. Hastaların %35’inde hemokültürde üreme oldu. Bunların %17.5’i Koagülaz negatif Stafilokoklardı. 5. Sepsisli hastaların PMNLE düzeyleri anlamlı derecede yüksek bulundu (p<0.0001). 6. Sepsisli hastalarda tedavinin dördüncü gününde bakılan serum PMNLE düzeyleri anlamlı derecede azalmış bulundu (p<0.01). 58 ÖZET Çalışmamızda sepsisli yenidoğanlarda plazma PMNLE düzeylerinin saptanması ve bu düzeylerin diğer klinik ve laboratuvar bulguları ile ilişkisinin incelenmesi, tedavinin dördüncü günü alınan kanda plazma PMNLE düzeylerinin karşılaştırılması amaçlandı. Haseki Eğitim ve Araştırma Hastanesi Çocuk Kliniği Yenidoğan Servisine yatırılarak sepsis tanısı koyulan 40 hasta çalışma grubunu ve 20 sağlıklı yenidoğan kontrol grubunu oluşturdu. Çalışmaya alınma kriterleri önceden saptanan bu olgularda klinik ve laboratuar yöntemleri ve Töllner skorlama sistemi kullanılarak tanıya gidildi. Her iki grubun kültür sonuçları, lökosit ve trombosit sayıları, I/T nötrofil oranları, CRP ve PMNLE değerleri incelendi. Tüm hasta ve kontrol grubunda birinci gün PMNLE düzeyleri ELİSA yöntemi ile ölçüldü. Hasta grubu ile kontrol grubu arasında PMNLE, CRP ve I/T nötrofil oranı bakımından anlamlı fark olduğu belirlendi (p<0.0001). Sepsisli çalışma grubunda 36 vakada (%90) PMNLE düzeyleri yüksek bulundu, kontrol grubunda PMNLE düzeyleri hepsinde normaldi. Her iki grup karşılaştırıldığında plazma PMNLE düzeyinin özgünlüğü %96.3, duyarlılığı %94.6, negatif tahmin değeri %93.5, pozitif tahmin değeri %95.1 olarak hesaplandı. Sonuç olarak yenidoğan sepsisinin erken tanısında ve tedaviye cevabın izlenmesinde PMNLE düzeylerinin önemli bir gösterge olduğu belirlendi. Ayrıca mortalite ve morbiditenin saptanmasında erken bir haberci olabileceği kanısına varıldı. 59 SUMMARY İn our clinical study, we aimed to evaluate the correspondence of PMNLE plasma levels to other clinical and laboratory findings of newborns within the determination of PMNLE plasma level comparison in the fourth day of treatment. The study group was consisted of 40 patients within the comparison to the 20 healty newborn control group who were admitted to Haseki Training and Research Hospital Newborn Department of Pediatric Clinics with the diagnosis of sepsis. Inclusion criteria were formerly sought in our subject who were diagnosed due to the Tollner scoring system and clinical and laboratory methods. The cultiration findings, leucocytes and thrombocytes counts, I/T neutrophil ratios, CRP and PMNLE values were evaluated in both groups. ELİSA screening methods wereutilised in evaluating the PMNLE levels both the study and control groups by the first day. A significant difference was monitorized (p<0.001) betwen the two groups in terms of PMNLE, CRP and I/T neutrophil ratios. PMNLE levels were more likely to be higher in sepsis positive individuals of 36 cases (%90) which on the other hand PMNLE levels were all in the normal range in the control group. Whilst the comparison of the plasma PMNLE levels in both groups the spesifity was %96.3, sensitivity was %94.6, negative estimation value was %93.5, positive estimation value was %95.1. As a conclusion these finding showed that PMNLE levels are a major screening object of great importance in the early diagnosis of newborn sepsis and relevant therapy which means that it is as well an accurate indicator of mortality and morbidity. 60 KAYNAKLAR 1. Neyzi O, Ertuğrul T. Pediatri (3. Baskı) Nobel Tıp Kitabevi, İstanbul. 2002; Cilt:1, 431-44. 2. Sanchez P.J, Siegel J.D. Bacterial and Viral İnfections in: Mc Millan JA Oski’s Pediatrics. (3 rd ed) Phidelphia : Lippincott. Williams and Wilkins Co, 1999; 404-416. 3. Friedland IR, Mc Cracken GH. Neonatal Sepsis and Meningitis in: Rudolph AM (ed). Rodolph’s Pediatrics. (20 th ed) Stamford: A Siman and Schuster Co, 1996; 536-548. 4. Awad H, Kültürsay N, Köksal N. Neonatal Sepsis: 1. Congress of Unıon OF Medıterranean Neonatal Socıetıes (UMENS) and XII Natıonal Congress of Neonatology. 3-6 Sept 2003; 80-90. 5. Aggarwal R, Sarkar N, Derori AK, Paul VK. Sepsis in the newborn: Indian J-Pediatr: New Delhi: 2002 ; 69(11): 1007; author reply 1008. 6. Wolach B: Neonatal sepsis: patogenesis and supportive therapy: Semin Perinatol Israel: 1997; 21 (1): 28-38. 7. Sater KJ: Treatment of sepsis in the neonate: J Intraven Nurs. Texas: 1998; 21(5): 27581. 8. Dear P, Remie JM, Roberton MR. C.: Infection in the newborn in: Textbook of Neonatology. (3 rd ed) London: Harcourt Brace and Co, 1999 ; 1109-1138. 9. Cole FS, Taeusch HW, Ballard RA.: Bacterial Infections of the Newborn in: Avery’s Diseases of the newborn. (7 th ed) Pennsylvania: Harcourt Brace and Co. 1991; 490-500. 10. Behrman RE, Kliegman RM, Jenson HB: Clinical Manifestation of Transplasental Intrauterine Infections: Nelson Textbook of Pedıatrıcs. (17 th ed) Phidelphia: 2004; 630-640. 11. Türk Neonatoloji Derneği Tanı ve Tedavi Protokolleri No: 1: 2002; 6 : 5-11. 12. Yurdakök M: Antibiotic use in neonatal sepsisi: Turk J Pediatr. Ankara. Turkey: 1998; 40 (1): 17-33. 61 13. Gerdes JS, Polin R: Early diagnosis and treatment of neonatal sepsis: Indian J Pediatr. Phidephia: 1998; 65 (1): 63-78. 14. Geme ST, Polin RA :Neonatal sepsis. Progress in diagnosis and management: Drugs. Pennsylvania: 1988; 36(6): 784-800. 15. Christensen RD: Hematopoiesis in the neonate. Pediatr Res Dis 1989; 26: 531. 16. Hill HR, Shigeoka AO, Pincus S, et al.: Intravenous Ig G in combination with other modalities in the treatment of neonatal infection. Pediatr Infect. Dis. 1986; 5: 180. 17. Stiehm ER. Immunologıc Disorders in infants and children. W.B. Saunders Company. Chapter I Ontogeny of Immunity. (17 th ed) Phidelphia: 1989; 1: 66. 18. Wilson C: Immunologic basis for increased susceptibility of the neonate to infection, J Pediatr 1986; 108: 1-2 19. Fietta A, Sacchi F, Bersani C, et al.: Complement dependent bactericidal activity for E.coli K12 in serum of preterm newborn infants, Acta Pediatr Scand. 1987; 7: 76. 20. Hill HR: Biochemical, Structural and functional abnormalites of Polimorfonuclear leucocytes in the neonate, Pediatr Res, 1987; 22: 375. 21. Cario MS. Neonatal neurrophil host defense. Am J Dis Child. 1989; 143: 40-46. 22. Krause PJ, Herson VC, Eisenfeld L, Johnson FM: Enhancement of neutrophil function for treatment of neonatal infections. Pediatr Infect Dis J 1989; 8: 382. 23. Roitt L, Brostoft J, Male D: Imuunology. Gover Medical Publishing, Adaptive and Innate Immunity. 1985; 1: 1-12. 24. Söylemez Y: T lenfositlerin fonksiyonları. Klinik gelişim (3.baskı). Ankara: 1990; 3: 638. 25. Söylemez Y: Fetus ve yenidoğanda lenfositler ve fonksiyonları. 1. Ulusal Neonatoloji Kongresi 4-8 Haziran 1990; İstanbul. 62 26. Klein JO, Marcy SM. Neonatal bacterial Sepsis and meningitis in Ranington J.Klein JO (eds): Infectious Diseases of the Fetus and Newborn infant. Philadelphia WB Saunders Co.1991; 601. 27. Oldung LB, Oldstone MBAX. Thymus derived peripheral lymphocytes from human newborns inhibits division of their mothers lymohocytes. J.Immunol. 1976; 116: 682. 28. Hercend T, Schmidt S: Characteristics and uses of Natural Killer Cells. Immunology Today. 1988; 9: 10; 291. 29. Squire EF, Favara B, Todd J, Diagnosis of neonatal bacterial infection: Hematologic and pathologic findings in fatal and nonfatal cases. Pediatrics. 1979; 64: 60-64. 30. Gilstrap LC, Kenneth JL, Intrapartum treatment of acute chorioamniyonitis: Impact on neonatal sepsis, Am J.Obst.Gyn. 1988; 159: 579-583. 31. Klein JD, Maray MM, Bacterial Sepsis and Meningitis, Remingtons’s Infect.Dis. of Newborn. 1988; 679-735. 32. Schaffer A, Mc Cracken GH, Bacterial Infection of the Newborn, Schaffers’s Diseases of the Newborn. VI. Edition. 1991; 350-357. 33. Garland SM.Early Onset Neonatal Group B Streptococcus Infection associated obstetric risk factors, Aust N.Z.J.Obstet.Gynecol. 1991; 31: 117-118. 34. Siegel JD, Mc Cracken GH: Sepsis Neonatarum, New Eng.J.of Med. 1981; 304: 642647. 35. Çoban A: Neonatal Sepsis:Etyoloji, klinik tanı, Neonatolojide Güncel Sorunlar (1.Ulusal Neonatoloji Kongresi ) .1991: 201-207. 36. Krugman S, Katz SL, Infect. Dis. of Children, IX. Edition. 1992; 402-418. 37. Knudson RP, Maj MC: Neonatal Heelstick Blood Culture, Pediatrics. 1980; 65: 505507. 63 38. Liu CH, Lehon C, Degenerative Changes in Neutrophils an Indicatör of Bacterial Infection, Pediatrics. 1984; 74: 823-827. 39. Yalçın I, Neonatal Sepsis ve Menenjitler, Literatür Tıp Dergisi. 1990; 78: 28-29. 40. Stuart J, Whicher JT.Test for detecting and monitoring the acut phase respons.Arch Dis Child. 1988; 63: 115-117. 41. Kreuz W, Veldmann A, Fischer D, Schlosser R, et al. Neonatal sepsis: a challenge in hemostaseology. Semin Tromb Hemost.Germany:1999; 25 (6): 531-535. 42. Eicher DJ, Annibale DJ. Neonatal sepsis: evaluation and management. J S C Mec Assoc. USA. 2002; 98(3): 106-112. 43. Lanari M, Papa I ,Venturi V, et al. Neonatal sepsis. Article in italian. Bologna.2001; 92(11): 690-695. 44. Parez EM, Weisman LE. Novel approaches to the prevention and therapy of neonatal bacterial sepsis. Clin Perinatol. 1997; 24(1): 213-229. 45. Stetzer BP, Mercer BM. Antibiotics and preterm labor. Clin Obstet Gynecol. 2000; 43(4): 809-817. 46. Wilson C: Immunologıc basis for increased susceptibility of the neonate to infection, J Pediatr. 1986; 108: 1-2. 47. Wasserman RL. Intravenous gamma globulin prophylaxis for newborn infants. Pediatr Infect Dis J. 1986: 5; 620-626. 48. Stabile A, Sopo SM, Romanelli V, et al. Intravenous for prophylaxis of neonatal sepsis in premature infants. Arch Dis Cild. 1988; 63: 441-443. 49. Gando S, Kameue T, Morimoto Y et al. Tissue factor production not balanced by tissue factor patway inhibitor in sepsis promotes poor prognosis. Crit Care Med. 2002; 30(8): 1914-1915. 64 50. Warren LL, Gregory PD. Leukocyte Elastase. Am J Respir Crit Med. 2001; 164(5): 896-904. 51. Marıanne J., Cornella GS, Werner M, Hans F. The Role of Phagocyte Proteinases and Proteinase Inhibitors in Multiple Organ Failure. Am J Respir Crit Care Meç. 1994; 150: 123130. 52. Gerg D. The Role of Neutrophil Elastase in Chronic Inflammation. Am J Respir Crit Care Med. 1994; 150: 114-117. 53. Stockley RA. Neutrophils and Protease-Antiprotease Imbalance. Am J Respir Crit Care Med. 1999; 160 (5): 49-52. 54. Takahashi H, Urano T, Nagai N. et al. Neutrophil Elastase May Play a Key Role in Developing Symptomatic Disseminated Intravascular Coagulation and Multiple Organ Failure in Patient with Head Injury. The Journal of Trauma Injury, Infection and Critical Care. 2000 ; 49:86-91. 55. Jay AN. Role of Neutrophil Elastase in Hypersecretion During COPD Exacerbations and Proposed Therapies. American College of Chest Physicians. 2000; 117: 386-389. 56. Ailko WJB, Johan G, Lambertus GT. Prediction of Microbial Infection and Mortality in Medical Ptients with Fever :Plasma Procalcitonin, Neutrophilic Elastase-α1-Antitripsin and Lactoferrin Compared with Clinical Variables. Clinical Infectious Diseases. 1999; 29: 398407. 57. Shaw JP, Chuang N, Yee H, Shamamian P. Polymorphonuclear neutrophils promote rFGF-2-induced angiogenesis in vivo. J Surg Res.2003; 109 (1): 37-42. 58. Takala A, Nupponen I, Kylanpaa BML, Repo H.Markers of inflammation in sepsis. Ann Med. 2002; 34 (7-8): 614-623. 65 59. Zorn B, Sesek BA, Osredkar J, Meden VH. Semen polymophonuclear neutrophil leucocyte elastase as a diagnostic and prognostic marker of genital tract inflammation. Clin Chem Lab Med. 2003; 41 (1): 2-12. 60. Nuntnarumit P, Pinkaew O, Kitiwanwanich S. Predictive values of serial C-reaktive protein in neonatal sepsis. J Meç Assoc Thai. 2002; 85 (4): 1151-1158. 61. Endo S, Inada K, Ceska M, Takakuwa T. et al. Plasma interleukin 8 and polymorphonuclear leukocyte elastase concentrations in patient with septic shock.J Inflamm. 1995; 45 (2): 136-142. 62. Ertel W, Jarrar D, Jochum M, Thiele V. et al. Enhanced release of elastase is not concomitant with increased secretion of granulocyte activating cytokines in whole blood from patient with sepsis. Arch Surg. 1994; 129 (1): 90-97. 63. Peters KM, Koberg K, Rosendahl T, Haubeck HD. PMN elastase in bone and joint infections. Int Orthop. 1994; 18 (6): 352-355. 64. Windolf J, Oremek G, Inglis R, Zega A. Prospective validation of PMN elastase as a prognostic parameter in the surgical intensive care unit. Article in German. 1994; 20 (6): 339. 65. Viljoen M, Roux LJ, Pretorius JP, Coetzee IH, Viljoen E. Hemostatic competency and elastase- α1- proteinase inhibitor levels in surgery, trauma and sepsis. J Trauma. 1995; 39 (2): 381-385. 66. Belaaouaj A, McCarthy R, Baumann M, Gao Z, Ley TJ, et al. Mice lacking neutrophil elastase reveal ampaired host defense against gram negative bacterial sepsis. Nat Med. 1998; 4 (5): 615-618. 67. Fujimi S, Ogura H, Tanaka H, Koh T, Hosotsubo H. et al. Actived polymorphonuclear leucocytes enhance production of leukocyte microparticles with increased adhesion molecules in patients with sepsis. J Trauma. 2002; 52 (3): 443-448. 66 68. Töllner U. Early diagnosis of septicemia in the newborn: clinical studies and Apgar score. Eur J Pediatr. 1982; 138: 331-337. 69. Güra A, Oygür N, Ongun H, Saka O. Yenidoğan geç sepsisinde erken tanı ve tedavi kriteri olarak E-selektin. Çocuk Sağlığı ve Hastalıklar Dergisi. 2003; 46: 261-266. 70. Schaffer A, Mc Cracken GH. ‘Bacterial Infection of the Newborn’, Schaffer’s Disease of the Newborn. VI.Edition. 1991; 350-357. 71. Fulgunitti VA. ‘Bacterial Infections in the Newborn Infant’, J Pediatr. 1970; 76: 646648. 72. Siegal JD, Mc Cracken GH. ‘Sepsis Neonatarum’, New Eng. J. of Med. 1981; 304: 642-647. 73. Gökçay G, Bulut A. Epidemiyoloji ve sağlık ölçütleri. In: Neyzi O, Ertuğrul (Yüksel) T. Pediatri Cilt 1 (3. Baskı). İstanbul: Nobel Tıp Kitapevi: 2002; 37-43. 74. Yıldız C, Yıldız H, Kavuncuoğlu S, Şiraneci R. Yenidoğan sepsisinin erken tanısında prokalsitonin. Çocuk sağlığı ve Hastalıkları Dergisi 2003; 46: 90-97. 75. Le Moullec JM, Jullienne A, Chenais J, et al. The complete sequence of human preprocalsitonin. FEBS Lett. 1984; 167: 93-97. 76. Krediet T, Gerards L, Fleer A, Van Stekellenburg G. The predictive value of CRP and I/T-ratio in neonatal infection. J Perinat Mod. 1992; 20: 479-485. 77. Ainbender E, Cabatu EE, Guzman DM, Sweet AY. Serum C-reaktive protein and problems of newborn infants. J Pediatr 1982; 101: 438-485. 78. Philip AG, Hewitt JR. Early diagnosis of neonatal sepsis. Pediatrics. 1980; 65: 10361041. 79. Berger C, Uehlinger J, Ghelfi D. Comparison of C-reaktive protein and white blood cell count with differential in neonates at risk for septicemia. Eur J Pediatr. 1995; 154: 138144. 67 80. Pourcyrous M, Bada HS, Korones SB. Significance of serial C-reaktive protein responses in neonatal infection and other disorders. Pediatrics 1993; 92: 431-435. 81. Putterman C. Modern approaches to the therapy of septic shock. Am J Emerg Med 1990; 8: 152-161. 82. Butler B. Endotoxin, tumor necrosis factor and related mediators: new approaches to shock. New Horizons 1993; 1: 3-12. 83. Bone RC. The pathogenesis of sepsis. Ann Intern Med 1991; 115: 457-469. 84. Whalen MJ, Doughty LA, Carlos TM, Wisniewski SR, Kochanek PM, Carcillo JA. Intercellular adhesion molecule-1 and vascular cell adhesion molecule-1 are increased in the plasma of children with sepsis-induced multiple organ failure. Crit Care Med 2000; 28: 26002607. 85. Sessler CN, Windsor AC, Shwartz M, et al. Circulating ICAM-1 is increased in septic shock. Am J Respir Crit Care Med 1995; 151: 1420-1427. 86. Bamberger DM, Gurley MB. Microbial etiology and clinical characteristics of distributive shock. Clin Infect Dis 1994; 18: 726-730. 87. Krugman S, Katz SL. Infactius Dis of Children, IX.Edition. 1992; 402-418. 88. Wilson DH, Eichenwal H. ‘Sepsis Neonatarum’, Pediatric Clinics of North Am. 1974; 21: 571-581. 89. Madsuda Y, Maruyama H, Kuraya K. Rrlationship between granulocyte elastase levels and perinatal infections. Gynecol Obstet Invest. 1995; 39 (3): 162-166. 90. Philip AG, Tito AM, Gefeller O, Speer CP. Neutrophil elastase in the diagnosis of neonatal infection. Pediatr Infect Dis J. 1994;13 (4): 323-326. 91. Laskowska KT, Czerwi SB, Maj PM. Neutrophil elastase level in cord blood and diagnosis of infection in mature and premature neonates. Article in Polish. 2002; 6 (1): 13-21. 68 92. Tsaka T, Herkner KR. Polymorphonuclear elastase in neonatal sepsis. Clin.Chim.Acta. 1990; 14 ;193 (3): 103-111. 93. Jensen JG, Madsen P, Rix M, Rosthoj S, Ebbesen F. Capillary plasma neutrophil elastase alpha-1-proteinase inhibitor as infection parameter in neonates. Scand J Lab Invest.1996; 56 (1): 37-40. 94. Wojsyk BI, Szczapa J. Reliability of polymorphonuclear elastase for the diagnosis of neonatal sepsis. Article in Polish. 2002; 59 (1): 43-45. 95. Chiesa C, Panero A, Rossi N, et al. Realiability of procalsitonin concentrations for the diagnosis of sepsis in critically ill neonates. Clin Infect Dis. 1998; 26: 664-672. 96. Gendrel D, Assicot M, Rraymond J, et al. Procalsitonin as a marker for the early diagnosis of neonatal infection. J Pediatr. 1996; 128: 570-573. 69