FİZİKSEL ve KİMYASAL DEĞİŞİM
Çevremizde bulunan çeşitli maddelerde zaman zaman çeşitli nedenlerden dolayı bazı
değişiklikler meydana gelir. Örneğin ; buzun eriyerek su haline gelmesi , kesme şekerin ezilerek
toz şeker haline gelmesi gibi. Bu değişiklikler kimi zaman maddelerin görünüşünü , kimi zaman ise
yapısını değiştirir. Maddenin yapısının değişmesine neden olan olaylara “ kimyasal değişim ” adı
verilir. Örneğin ; şekerin ısıtılarak kömür haline gelmesi olayı kimyasal değişimdir . Kömür haline
dönüşmüş olan maddeden tekrar şeker elde edilmesi mümkün değildir.
Maddelerin sadece dış görünüşlerinin , biçimlerinin değişmesine ise “ fiziksel değişim ”
adı verilir. Fiziksel değişime uğrayan maddeler tekrar eski haline gelebilirler . Su donarak buz
haline , toz şekerin tanecikleri birleşerek kesme şeker haline gelebilir.
Kimyasal Değişime Örnekler :
Sütün yoğurt haline gelmesi
Üzümden sirke elde edilmesi
Sütün ekşimesi
Etin bozulması
Kağıdın ve odunun yanması
Metallerin ( örneğin , demirin ) paslanma sonucu çürümesi
Fiziksel Değişime örnekler :
Suyun buharlaşması
Odunun parçalanması
Naftalinin erimesi
Şekerin suda çözünmesi
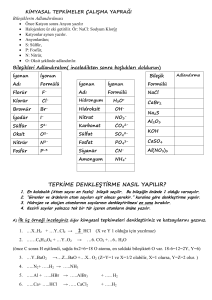
BASİT TEPKİME DENKLEMLERİNİN YAZILMASI VE DENKLEŞTİRİLMESİ
Bir maddenin, başka maddelerin etkisiyle yapısını değiştirerek başka maddelere dönüşmesine “Kimyasal
olay” veya “Kimyasal reaksiyon” denir.
Bir kimyasal reaksiyonda girenler ve ürünler bulunur. Kimyasal reaksiyonlar denklemlerle gösterilirler.
Denklemlerde girenlerle ürünler bir ok ile ayrılır. Okun sol tarafında girenler, sağ tarafında ürünler yer alır.
Birden fazla giren veya ürün varsa bunlar arasına (+) işareti konur.
H2 + 1/2O2
H2O
(Girenler)
HCl + NaOH
(Girenler)
(Ürünler)
NaCl + H 2O
(Ürünler)
DENKLEŞTİRME YÖNTEMLERİ
DENEME - YANILMA (SINAMA) YÖNTEMİ
Bu yöntemde işimizi kolaylaştırmak için bir kaç ufak kurala dikkat edeceğiz.
Verilen tepkimede hem sayı hem de cins bakımından en kalabalık bileşiği seçelim.
Ve bu bileşiğin katsayısına "1" diyerek denemeye başlayalım... olmazsa "2" ...olmazsa "3" ....
deriz.
Reaksiyona giren atom sayısını reaksiyondan çıkan atom sayısına eşitlemek için atomların
önüne sayılar konması işlemine “denkleştirme” denir. Denkleştirme işlemlerinde önce metal, sonra
ametal ve en son hidrojen atomları denkleştirilir.
NOT: Bu yöntemde oksijen ve hidrojen elementlerinin denkleştirilmesi genellikle en sona bırakılır.
Tepkimesini en küçük tam kat sayılarla denkleştirelim;
Mg(OH)2 + H3PO4
Mg3(PO4)2 + H2O
tepkimede en kalabalık bileşik Mg3(PO4)2 olduğuna göre onun tepkimedeki kat sayısını "1" alalım. Bu durumda
tepkime;
1
Mg(OH)2 + H3PO4
Mg3(PO4)2 + H2O
olur.
Şimdi diğer atomları sayarak denkleştirelim
Mg'nin 3 tane girmesi için Mg(OH)2 in kat sayısın 3 alalım...
3 Mg(OH) + H PO
2
3
1 Mg (PO )
4
3
4 2
+ H2O
P'ninde 2 tane çıkabilmesi için 2 tane girmesi gerekir. O zaman H3PO4 'ün kat sayısı da 2 olmalı
3 Mg(OH) + 2 H PO
2
3
1 Mg (PO )
4
3
4 2
+ H2O
Şimdi geriye denkleşmeyen bir tek H2O kaldı. onu da denkleştirmek için, oksijen ya da hidrojen
elementlerinden birini sayalım.
Ben Oksijeni sayacağım.. siz de Hidrojeni sayın :-)
3 Mg(OH) + 2 H PO
2
3
1 Mg (PO ) + ? H O
4
3
4 2
2
6 tane O + 8 tane O 8 tane O + ?
6+8=8+?
Göründüğü gibi 14 tane O atomu girmiş o zaman 14 tane'de çıkması lazım gelir.
14 - 8 = 6
1mol H2O'da 1 mol O olduğundan suyun katsayısını 6 yazmalıyız
Dolayısıyla bizim denklem;
3 Mg(OH) + 2 H PO
2
3
4
1 Mg (PO ) + 6 H O olur
3
4 2
2
Şimdi siz de şu denklemleri aynı yöntemle denkleştirmeye çalışınız...
C2H5OH + O2
NH3 + O2
N2O5 + H2O
Fe2O3 + C
Fe + CO2
CnH2n+2 + O2
Al + H2O
CO2 + H2O
CO2 + H2O
Al2O3 + H2
H2 + N2 NH3
Mg + O2 MgO
Ag + Cl2 AgCl
Al + O2 Al2O3
N2 + O2 N2O4
Mg + HCl MgCl2 + H2
Zn + HCl ZnCl2 + H2
3H2 + N2 2NH3
2Mg + O 2 2MgO
Ag + 1/2 Cl 2 AgCl
2Al + 3/2O2 Al2O3
N2 + 2O2 N2O4
Mg + 2HCl MgCl2 + H2
Zn + 2HCl ZnCl2 + H2
TEPKİMELERDE ISI ALIŞVERİŞİ
Kimyasal reaksiyonun meydana gelmesi için dışarıdan ısı enerjisi gerekiyorsa bu reaksiyonlara
“endotermik reaksiyon” denir.
Endotermik reaksiyonlara birkaç örnek verelim.
Suyun ayrışması:
H2O + enerji
H 2 + ½ O2
Kalsiyum karbonatın ısıtılması:
CaCO3 + ısı
CaO + CO 2
Amonyum klorürün ısıtılması
NH4Cl + ısı
NH 3 + HCl
Kimyasal reaksiyon sonrasında dışarıya ısı veren reaksiyonlara “ekzotermik reaksiyon” denir.
Ekzotermik reaksiyonlara birkaç örnek verelim.
Yanma olayları:
C + O2
CO2 + ısı
Sönmüş kirecin oluşumu
CaO + H2O
Ca(OH) 2 + ısı
KİMYASAL TEPKİMELERİN ÖNEMİ
Canlılar yaşamak için oksijene ihtiyaç duyarlar. Bu oksijen bitkiler tarafından fotosentez ile oluşturulur.
Canlıların oksijen alıp karbondioksit vermesi olayına ise solunum denir. Bu iki olay birbirinin tersidir ve
zincirleme olarak birbirini takip eder.
Bu olaylar kimyasal olarak aşağıdaki gibi ifade edilir.
Fotosentez;
KLOROFİL
Karbondioksit + Su + Güneş ışığı
Besin + Oksijen
6 CO2 + 6 H2O + Güneş ışığı
Solunum;
Besin + Oksijen
C6H12O6 + 6 O2
tepkimeleri ile kimyasal olarak izah edilir.
KLOROFİL
C6H12O6 + 6 O2
Karbondioksit + Su + Enerji
6 CO2 + 6 H2O + Enerji
Bunların dışında yaşamımızın bir çok yerinde kimyasal tepkimelerin etkileri vardır. Bunların başında
büyümemiz gelir.