www.kimyadersim.com
advertisement

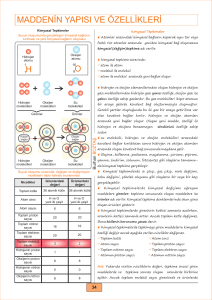
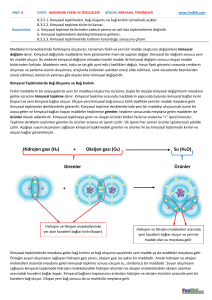
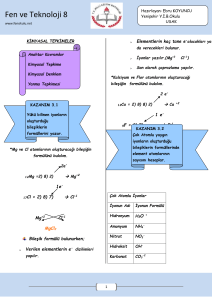
www.kimyadersim.com KİMYASAL DEĞİŞİMLER Kimyasal değişim maddenin farklı maddelere ayrışmasına veya farklı maddelerin etkileşerek yeni maddeleri oluşturmasına denir. Kimyasal değişmeler sonucunda maddenin yeni kimyasal özelliği oluşur ve kimlik özelliği değişir. Kimyasal özellikler, maddenin yeni maddelere dönüşmesi sırasında gözlenen özellik olarak da tanımlanabilir. Örneğin, sönmemiş kirecin üzerine su döküldüğünde ısı açığa çıkar ve kireç değişime uğrar. bileşikler moleküllerine ayrılarak çözünürken NaCl, KI gibi iyonik maddeler iyonlarına ayrılarak çözünürler. Bir çökelme tepkimesinde belirli katyon ve anyonlar birleşerek çökelek (çökelti) denen ve çözünmeyen iyonik bir katı verir. Aküler elektrik enerjisini kimyasal enerji olarak depo eden, istenildiğinde bunu elektrik enerjisi olarak veren cihazlardır. Akümülatörlerin çalışma prensibi indirgenme-yükseltgenme (redoks) tepkimelerine dayanır. Kimyasal Tepkimeler Kimyasal tepkimeler tepkime denklemi ile yazılarak gösterilir. Kimyasal tepkime denkleminin yazılması için tepkimeye girenlerin ve oluşan ürünlerin sembol ve formülleri bilinmelidir. Tepkime denkleminde okun ( ) sol tarafına girenlerin sembol ve formülleri, sağ tarafına ise oluşan ürünlerin sembol ve formülleri yazılır. Hidrojen, anot elektrota, oksijen ise katot elektrota gönderilir. Anot elektrota gönderilen hidrojen molekülü, anot üzerinden geçerken elektron bu molekülden ayrılır ve molekül iyon yapıya dönüşür. Polimerleşme 2. Asit – Baz (Nötrleşme) Tepkimeleri Kovalent bağlarla birbirine bağlanıp büyük moleküller oluşturabilen küçük mol kütleli kimyasal maddelere monomer denir. Monomer moleküllerde karbon atomları arasında ikili yada üçlü bağ vardır. Asitler ve bazların tepkimeye girmesi sonucu tuz ve su oluşması olayına nötralleşme denir. Suyun oluşmadığı asit baz tepkimeleri nötralleşme değildir TEPKİME TÜRLERİ 2.1 Yanma Tepkimeleri Yanma: Herhangi bir maddenin oksijenle birleşmesi olayına denir. Bir maddenin oksijenle birleşmesine ait tepkimeler yanma tepkimeleridir. Yanma için yanıcı madde, hava (oksijen), tutuşma sıcaklığı Gerekir. Yanmanın olduğu ortamda yanan madde ile oksijenin ilişkisi kesilirse yanma engellenmiş olur. Bunun için karbon dioksit gibi havadan daha yoğun ve oksijenle tepkime vermeyen maddeler yangın söndürmede Kullanılırlar Yanma tepkimeleri genelde hızlı gerçekleşmesine karşılık demirin oksijenle yanması olayı (paslanma) yavaş yanmaya örnektir. 2. İndirgenme -Yükseltgenme Tepkimeleri En az 1000 monomerin birleşmesi ile polimer oluşur. Bu tür polimerleşmelere katılma polimerleşmesi denir. Yükseltgenme sayısının değiştiği tepkimeler indirgenmeyükseltgenme tepkimeleridir. İki farklı monomerin birleşerek küçük bir yapının ayrılması ile gerçekleşen polimrleşmeye kondenzasyon polimerleşmesi denir. Yanma tepkimelerinin tamamı indirgenmeyükseltgenme tepkimeleri sınıfına girer. Yakıt Pilleri ve Akümülatörler 2. Çözünme Tepkimeleri - Çökelme Bir maddenin diğer bir madde içerisinde küçük parçacıklar hâlinde homojen olarak dağılmasına çözünme denir. Çözünme moleküler ve iyonik olarak ikiye ayrılır. Şeker, etil alkol gibi organik Elektrokimyasal enerji dönüşüm cihazlarıdır. Yakıt pillerinin temel yakıtı hidrojendir. Hidrojen su, metanol, doğal gaz, bor hidrür vb. bileşiklerden ayrıştırılarak elde edilir. Bir yakıt pili kendi içerisinde hidrojen ve oksijeni suya dönüştürürken bu reaksiyon sonucu elektrik akımı üretilir. Hekzametilen diamin ile adipik asidin birleşmesinden su ayrılması ile dimer oluşur. Oluşan dimerin polimerleşmesinden poliamid (naylon) oluşur. Amino asitlerden Protein oluşumu kondenzasyon polimerleşmesine örnektir.