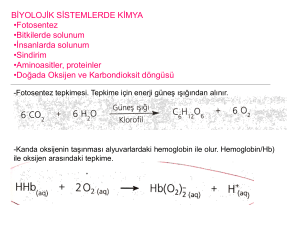
KİMYASAL DENGE
TERSİNİR TEPKİME: Çift yönlü tepkimelerdir.Geriye dönüşümü mümkün olan
olaylardır.
TERSİNMEZ TEPKİME: Tek yönlü tepkimelerdir.Geriye dönüşümü mümkün olmayan
olaylardır.Örnek:Nötürleşme tepkimeleri
KAPALI BİR KAPTA SABİT SICAKLIKTA ÇİFT YÖNLÜ GERÇEKLEŞEN TEPKİMELERE
KİMYASAL DENGE TEPKİMELERİ denir.
H2 + Br2
2HBr
DENGE OLMA ŞARTLARI:
1-Kapalı bir kapta olmalıdır.
2-Denge dinamik bir olaydır.Makroskobik (Çıplak gözle görülen )olaylar durmuştur.Örneğin
renk değişim,basınç-hacim değişimi gibi...Mikroskobik (çıplak gözle görülmeyen)olaylar
içten içe devam eder.
3-Denge anında tüm derişimler sabit kalır.
4- ileri tepkime hızı= geri tepkime hızı
5-Maksimum düzensizlik ve minimum enerji eğilim birbirini zıt yönde desteklemelidir.
6-
Tükenen madde
olmamalıdır.(Tam verimli
tepkimeler denge
tepkimeleri değildir.)
7-Mekanizmalı tepkimelerde denge bağıntısı toplam tepkimeye göre yazılır.
2N2O(g) + O2(g)
4N O(g) (YAVAŞ)
4NO(g) + O2(g)
2N2O3(g) (HIZLI)
denge bağıntısını yazınız.
HOMOJEN DENGE TEPKİMELERİ: Kimyasal reaksiyonlarda girenler ve ürünler aynı fazdadır.
2O2(g)
2O3(g)
HETEROJEN DENGE TEPKİMELERİ :Kimyasal reaksiyonlarda giren ve ürünler aynı fazda
değildir.
CaCO3(k)
Ca+2(suda) + CO3-2(suda)
DENGE BAĞINTISININ YAZILMASI
İLERİ TEPKİME HIZI= GERİ TEPKİME HIZI
aX(g) + bY (g)
cZ(g) + dT(g)
Denge bağıntısı yazılırken katı ve sıvıların derişimleri sabit olduğundan denge
bağıntısında yer almaz.
DENGE SABİTİNİN BİRİMİ YOKTUR.
ÖRNEK:
C(k) + O2(g)
Cu+2(suda) + H2(g)
CO2(g)
2H+1(suda) + Cu(k)
DENGE SABİTİNİ
ETKİLEYEN TEK FAKTÖR SICAKLIKTIR.
GAZLARLA İLGİLİ DENGE SABİTİ:
Kapalı kaplarda sabit sıcaklıkta gazlarla ilgili denge ifadelerle kısmi basınçları cinsinden
yazılabilir.
ideal gaz denklemi üzerinden açıklanması:
N2(g) + 3H2(g)
2NH3(g) tepkimesinin kısmi basınçlar üzerinden denge bağıntısı
Kp ve Kc ARASINDAKİ İLİŞKİ
Kp = Kc (RT)∆n
!!!
∆n= 0 olduğunda Kp=Kc dir.
ÖRNEK:
H2(g) + Cl(g)
N2(g) + 3H2(g)
2HCl(g)
2NH3(g)
ÖRNEK:
2A(g)
B(g) + 3C(g)
2 mol A ile başlatılan tepkimede 0,4 mol B oluşunca tepkime dengeye
ulaşıyor.Denge sırasında kaptaki toplam basınç 7 atm olduğuna göre Kp değeri
kaçtır?
ÇÖZÜM:
ÖRNEK:
X(g) + 3Y(g)
2Z(g)
0
tepkimesi için -173 C de Kd= 4,1 dirAynı sıcaklıkta tepkime için Kp değeri kaçtır?
DENGEDE HESS YASASI
2A + 3C
TERS ÇEVRİLİRSE:
D(g)
Kc= 10 ise
2A + 3C
D(g)
X(g)
+
2Y(g)
X(g)
+ K(g)
Kc= 10 ise
K(g) + 3Z(g)
K1= 10
Z(g)
K2= 20
ÖRNEK ÇALIŞMALAR:
1 litrelik sabit hacimli bir kapta ve 25 0C de gerçekleşen tepkimenin
mol zaman değişimi grafiği verilmiştir.Buna göre Bu tepkimeye ait
Kc değerini bulunuz.
ÖRNEK:
Tek basamakta gerçekleşen ;
2X (g) + Y(g)
X2Y(g) tepkimesine ait deney sonuçları aşağıdaki tabloda verilmiştir.
Deney
[X](mol/l)
[Y] (mol/l)
Hız (mol/L.sn)
1
0,2
0,2
1,6.10--3
2
0,4
0,1
3,2.10-3
geri yöndeki tepkimenin hız sabiti 0,4 olduğuna göre aynı sıcaklıktaki derişimler türünden denge sabiti
kaçtır?
A) 1/2
B) 1
C) 3/2
D) 2
E) 5/2
ÇÖZÜM
ÖRNEK: N2(g) + O2(g)
NO(g) + 1/2O2(g)
N2O4(g)
2NO(g)
Kc=4
NO2(g)
Kc=9
2NO2(g)
Kc=36
tepkimeleri verildiğine göre;
N2O4(g)
N2(g)
+ 2O2(g)
tepkimesine ait Kc değerini hesaplayınız