7.SINIF SUNULARI
Elementler ve Sembolleri
SAF MADDE: Kendisinden baĢka madde bulundurmayan maddelere denir.
ELEMENT: Ġçerisinde tek cins atom bulunduran
maddelere denir. Yani elementlerin yapı yaĢı atom-lardır.
BĠLEġĠK: En az iki farklı cins elementin belirli oranlarda
bir araya gelerek, oluĢturdukları yeni özellikteki maddeye
denir. Yani bileĢiklerin yapı taĢı moleküldür.
MOLEKÜL: Ġki veya daha çok atomun bir araya gelerek
oluĢturduğu atom gruplarıdır.
Elementler : Aynı cins atomlardan oluĢan, fiziksel ya da
kimyasal yollarla kendinden daha basit ve farklı maddelere
ayrılamayan saf maddelere element denir. Bir elementi oluĢturan
bütün atomların büyüklükleri ve atomların arasındaki uzaklık
aynıdır. Fakat bir elementin atomları ile baĢka bir elementin
atomlarının büyüklükleri ve atomların arasındaki uzaklıkları
farklıdır. Aynı elementten yapılan farklı maddeler de aynı cins
atomlardan oluĢurlar. Elementi oluĢturan atomların birbirine olan
uzaklığı elementin katı, sıvı ve gaz haline göre değiĢebilir. Canlı
ve cansız varlıkların tamamı elementlerden oluĢurlar.
ELEMENTLERĠN ÖZELLĠKLERĠ
1- En küçük yapı birimleri atomlardır.
2- Aynı cins atomlardan oluĢurlar.
3- Kendinden daha basit ve farklı maddelere
ayrılamazlar.
4- Saf maddelerdir.
5- Sembollerle gösterilirler.
Element ÇeĢitleri :
Atomik Yapıdaki Elementler : Bazı elementleri oluĢturan
aynı cins atomlar doğada tek baĢlarına bulunurlar. Böyle
atomlara sahip elementlere atomik yapılı elementler denir.
Atomik yapılı elementlerin en küçük taneciği atomlardır.
Demir, bakır, alüminyum, çinko, kurĢun, altın gibi elementler
atomik yapılıdır.
Moleküler Yapıdaki Elementler : Bazı
elementleri oluĢturan aynı cins atomlar doğada ikili
(veya daha fazla sayıda atomdan oluĢan karmaĢık
yapılı) gruplar halinde bulunurlar. Böyle
atomlara sahip elementlere moleküler yapılı
elementler denir. Moleküler yapılı elementlerin en
küçük taneciği moleküllerdir.
ELEMENTLER VE SEMBOLLERĠ:
Günümüzde bilinen 118 element vardır. Bu elementlerin
92 tanesi doğada bulunurken geri kalanı da
laboratuarlarda elde edilen yapay elementlerdir.
Elementler sembollerle gösterilir ve her elementin kendine
özgü sembolü vardır. Element sembolü yazılırken;
• Sembol tek harfli ise büyük harfle yazılır.
• Sembol iki veya üç harfli ise ilk harf daima büyük, diğer
harfler küçük yazılır. (Sembollerin iki veya üç harften
oluĢmasının nedeni, bazı elementlerin baĢ harflerinin aynı
olmasıdır).
Elementlerin sembollerle gösterilmesinin nedeni, bütün
Dünya’da ortak bir bilim dili oluĢturmak, bilimsel
iletiĢimi ve yazımlarını kolaylaĢtırmaktır. Elementlerin
bütün Dünya’da kullanılan sembolleri aynı olmasına
rağmen isimleri dillere göre farklıdır. (Türkçe, Rusça,
Çince, Japonca da element isimleri farklı olmasına
rağmen sembolleri aynıdır).
Elementler ilk bulunduklarında bir kısmına elementlerin
özelliklerini belirten bir isim (hidrojene Latincede su üreten
anlamına gelen hydro–genes, oksijene Latincede asit yapan
anlamına gelen oxygenium, fosfora Latincede ıĢık veren
phosphorus), bir kısmına elementi bulan bilim adamının ismi
(Albert Einstein–AynĢtaynyum–Es, Gregor Mendel–
Mendelevyum–Md, Rutherford–Rutherfordiyum–Rf, Andre
Marie Curi– Küriyum–Cm), bir kısmına gezegen ve yıldızların
isimleri (Neptün–Neptünyum–Np, Plüton–Plütunyum–Pu,
Uranüs–Uranyum–U), bir kısmına da çeĢitli kıta, Ģehir ve ülke
isimleri (Avrupa–Europyum–Eu, Amerika–Amerikyum–Am,
Kaliforniya–Kaliforniyum–Cf, Fransa–
Fransiyum–Fr) verilmiĢtir. Elementlerin sembolleri
belirlenirken, elementlerin Latince isimlerinin ilk veya
ilk iki (üç) harfi kullanılmıĢtır.
Elementlerin Kullanım Alanları ve Özellikleri :
1- Hidrojen (H) :
• Ġlk olarak 1776 yılında Henry Cavendish tarafından
keĢfedilmiĢtir.
• Hidrojen ismi ise Antoine Lavoisier tarafından
verilmiĢtir.
• Bilinen renksiz en hafif gazdır.
• Suyun, canlıların ve petrol gibi birçok maddenin
yapısında bulunur.
• Roket yakıtı olarak kullanılır.
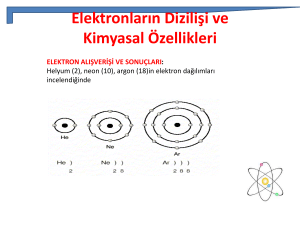
2- Helyum (He) :
• 1868 yılında Fransız Pierre Janssen ve Ġngiliz Norman
Lockyer birbirinden bağımsız olarak helyumu keĢfetmiĢlerdir.
• 1908 yılında Heike Kamerlingh Onnes ilk sıvı helyumu elde
etmiĢtir.
• Helyum atmosferde çok az miktarda bulunur.
• GüneĢ’te ve diğer yıldızlarda bol miktarda bulunur.
• Renksiz bir gazdır.
• Zeplin ve balon gibi hava taĢıtlarının ĢiĢirilmesinde, roket
yakıtlarının sıkıĢtırılmasında kullanılır. (Havadan daha hafif
gaz olması nedeniyle).
3- Lityum (Li) :
• Ġlk olarak 1817 yılında Johann Arvedson tarafından keĢfedilmiĢtir.
• GümüĢümsü gri metalik renkte bulunan katı bir elementtir.
• Ġlaçlarda, pil üretiminde, seramik ve cam yapımında kullanılır.
4- Berilyum (Be) :
• 1828 yılında birbirlerinden bağımsız olarak Friedrich Wöhler ve
Antony Bussy tarafından elde edilmiĢtir.
• Gri renklidir katıdır.
• Uçak ve uzay araçlarının yapımında elektrik ve ısı iletkeni olarak
kullanılır.
5- Bor (B) :
• 1808 yılında Humphry Davy, Gay–Lussac ve Thenard tarafından ilk
defa elde edilmiĢtir.
• Oda koĢullarında katı halde bulunur.
• Isıya dayanıklı renkli cam imalatında, seramiklerde ve roket yakıtlarında
kullanılır.
6- Karbon (C) :
• Saf haldeyken karbon, elmas, grafit, is, kömür gibi (4 tane allotropu
vardır) birçok çeĢitli maddelerde bulunur.
• Grafitin yapısı siyah, elmasın yapısı ise renksiz bir katıdır.
• Yeryüzünde kömür, petrol, doğal gaz gibi maddelerin ve canlıların
yapısında bulunup canlılar açısından çok önemlidir.
7- Azot (N) :
• Azot ilk olarak 1772 yılında Daniel Rutherford tarafından keĢfedildi.
• Renksiz ve kokusuz bir gazdır.
• Canlılar için gerekli temel elementlerden biridir.
• Sıvı azot soğutma amacıyla kullanılır.
• Bazı azot bileĢikleri tarımda gübre olarak kullanılır.
8- Oksijen (O) :
• Oksijen ilk olarak 1774 yılında Joseph Priestley ve Carl Wilhelm Scheele
tarafından keĢfedilmiĢtir.
• 1781 yılında Lavosier, oksijenin havada bulunan ve yanmaya etki eden bir
madde olduğunu keĢfetmiĢtir.
• Renksiz bir gazdır.
• Canlıların yaĢaması için gerekli temel elementtir.
• Dalgıçların ve astronotların solunum yapmaları için kullandıkları oksijen
tüplerinde bulunur.
9- Flor (F) :
• Ġlk defa 1886 yılında Henri Moissan tarafından elde edilmiĢtir.
• Açık sarı renkli bir gazdır.
• DiĢ macunları ve deodorantların yapısında bulunur.
• Buzdolabı ve klimaların soğutma sisteminin çalıĢmasında
kullanılır.
10- Neon (Ne) :
• Neon 1898 yılında William Ramsay ve Morris Travers
tarafından keĢfedilmiĢtir.
• Renksiz bir gazdır.
• Renkli reklam panolarının aydınlatılmasında ve televizyon
tüplerinde kullanılır.
11- Sodyum (Na) :
• Sodyum ilk olarak 1877 yılında Humphrey Davy tarafından elde
edilmiĢtir.
• YumuĢak, kaygan bir metal olup gümüĢümsü beyaz renkli bir katıdır.
• Doğada en çok sofra tuzunun (sodyum klorürün) yapısında bulunur.
• Kağıt, gıda, tekstil, kimya, sabun, cam ve metal gibi bir çok
endüstriyel kullanılır.
12- Magnezyum (Mg) : • 1755 yılında Ġngiltereli Joseph Black
tarafından ilk olarak keĢfedilmiĢtir.
• GümüĢümsü beyaz renkli bir metaldir.
• Oda koĢullarında katı halde bulunur.
• Hafif bir metal olduğu için hava taĢıtlarının yapımında kullanılır.
• KurutulmuĢ meyvelerde bulunur.
13- Alüminyum (Al) :
• 1827 yılında Wohler tarafından bulunmuĢtur.
• Alüminyum yumuĢak ve hafif bir metaldir.
• Mat, gümüĢümsü renkli bir katıdır.
• Mutfak araç gereçlerinin, elektrik kablolarının ve içecek
kutularının yapımında kullanılır.
14- Silisyum (Si) :
• Silisyumun ilk keĢfi 1824 yılında Berzelius tarafından
gerçekleĢtirilmiĢtir.
• Yeryüzünde en fazla bulunan elementlerden biridir.
• Koyu gri renkli bir katıdır.
• Kumda, kilde, cam yapımında ve yapı malzemelerinde bulunur.
15- Fosfor (P) :
• Fosfor ilk olarak 1669 yılında Hennig Brand tarafından keĢfedildi.
• Fosfor renksiz, beyaz, kırmızı ve siyah renklerinde bulunabilir.
• Oda koĢullarında katı halde bulunur.
• Canlıların sinir ve kemik dokularında görevlidir.
• Suni gübre yapımında kullanılır.
16- Kükürt (S) :
• Kükürt, antik çağda bilinen dokuz elementten biriydi. Kükürdün
kimyasal bir element olduğunu 1777’de Lavoisier ortaya attı. 1810
yılında Gay Lussac ile Thenard tarafından deneysel olarak
doğrulandı. • Sarı renkli tatsız, kokusuz bir maddedir.
• Oda koĢullarında katı halde bulunur.
• Isı ve elektriği iyi iletemez.
• Barut ve sülfürik asit yapımı ile kuru meyvelerde mikrop öldürücü
olarak kullanılır.
17- Klor (Cl) :
• Klor ilk olarak 1774 yılında Carl Wilhelm Scheele tarafından
keĢfedildi. 1810 yılında ise Humphry Davy tarafından bugünkü
ismi verildi.
• Sarı–yeĢil renkli zehirli bir gazdır.
• Doğada en çok sofra tuzunun yapısında bulunur.
• Ġçme sularında mikrop öldürücü olarak bulunur.
18- Argon (Ar) :
• 1785 yılında havada argon olduğu ilk defa Henry Cavendish
tarafından iddia edilmiĢ ve 1894 yılında Lord Rayleigh ve
William Ramsay tarafından keĢfedilmiĢ.
• Kokusuz ve renksiz bir gazdır.
• Ampullerde ve flüoresan tüplerinde kullanılır.
19- Potasyum (K) :
• Potasyum ilk olarak 1807 yılında Humphrey Davy
tarafından elde edilmiĢtir.
• GümüĢümsü beyaz renkli bir katıdır.
• Sıvı deterjan, gübre, barut, cam ve lens yapımında
kullanılır.
20- Kalsiyum (Ca) :
• Ġlk olarak 1808 yılında Berzelius ve Pontin tarafından,
daha sonra saf olarak ilk defa Humphry Davy tarafından
elde edilmiĢtir.
• GümüĢ gibi parlak ve beyaz renkli bir katıdır.
• Çimento, alçı, kireç gibi maddeler ile diĢlerin ve kemiklerin
yapısında bulunur.
21- GümüĢ (Ag) :
• GümüĢ elementinin keĢfi tam olarak bilinmemekle birlikte altın ve bakır
elementlerinden sonra keĢfedilmiĢtir. GümüĢün MÖ 2500 yıllarında
Çinliler ve Persler tarafından kullanıldığı belirtilmiĢtir.
• Parlak, beyaz renkli bir katıdır.
• Süs eĢyası yapımında, diĢ dolgusu (amalgam) yapımında kullanılır.
22- Altın (Au) :
• Tarihte bilinen kayıtlara göre Mısır hükümdarları zamanında MÖ
3200 yıllarında, altın darphanelerde eĢit boyda çubuklar halinde çekilerek
para olarak kullanıldı.
• YumuĢak, parlak sarı renkli bir katıdır.
• Süs eĢyası yapımında kullanılır.
23- Cıva (Hg) :
• Cıva çok uçucu bir element olduğu için oda sıcaklığında kolayca
buharlaĢabilir.
• GümüĢümsü gri renkli bir sıvıdır.
• Zehirli bir elementtir.
• Herhangi bir yüzeye cıva döküldüğü zaman üzerine toz kükürt
dökülmelidir.
• DiĢ dolgusu (amalgam) yapımında ve termometrelerde
kullanılır.
24- Bakır (Cu) :
• Tarihte ilk defa 10.000 yıl kadar önce Kıbrıs’ta rastlanmıĢtır.
• Turuncu renkli yumuĢak bir katıdır.
• Mutfak ve süs eĢyası yapımında kullanılır.
25- Nikel (Ni) :
• Nikel elementi ilk olarak 1751 yılında Axel Fredric
Cronstedt tarafından keĢfedilmiĢtir.
• GümüĢümsü parlak renkli bir katıdır.
• Arabaların kaplamalarında, musluklarda ve paslanmaz
tencere yapımında nikel kullanılır.
26- Ġyot (I) :
• Ġyot elementi ilk kez Bernard Courtois tarafından 1811
yılında keĢfedilmiĢtir.
• Parlak, menekĢe–siyah renkli bir katıdır.
• Deniz ürünlerinde ve iyotlu sofra tuzlarında bol miktarda
bulunur.
27- Çinko (Zn) :
• Çinko elementi 1746 yılında Andreas Maggart tarafından
keĢfedilmiĢtir.
• Mavimsi, açık gri renkte, kırılgan bir katıdır. • Mutfak
eĢyalarının ve pilin yapımında kullanılır.
28- Demir (Fe) :
• Demir metalinin keĢfi tam olarak bilinmemektedir.
• Grimsi parlak renkli bir katıdır.
• Element halindeki saf demir dövülebilir, ince tel ve levha haline
getirilebilir.
• ĠnĢaat malzemesi ile günlük hayatta kullanılan bazı eĢyaların
yapımında kullanılır.
• Marul ve pekmez gibi besinlerle kanın yapısında bulunur.
29- Kalay (Sn) :
• MÖ 3000 yıllardan beri kullanılan bir elementtir.
• GümüĢümsü parlak renkli bir katıdır.
• Mutfak eĢyası yapımında ve metallerin kaplanmasında
kullanılır.
30- KurĢun (Pb) :
• KeĢfi tam olarak bilinmemektedir.
• Mavimsi–beyaz renkte bulunan bir katıdır.
• YumuĢak, ağır, zehirleyici, kolay dövülebilen bir
maddedir.
NOT :
1- Elementi oluĢturan taneciklerin renkleri, elementlerin
renkleriyle aynı olmayabilir. Taneciklerin renkleri yoktur.
Tanecikler bir araya gelerek elementleri oluĢturduklarında yani
elementler görünür boyuta ulaĢtıklarında renkli görünürler.
2- Farklı maddeler de aynı elementlerden oluĢabilir yani farklı
maddelerde aynı cins elemenler bulunabilir. Ispanak ve
bezelyede bulunan demir atomlarıyla, demir parçasında
bulunan demir atomları aynı atomlardır.
3- Doğada bilinen 118 element olmasına rağmen bu elementler
farklı Ģekillerde bir araya gelerek milyonlarca yeni madde yani
bileĢik elde edilir.
Doğada Kullanılan Elementlerin Benzerliği :
Doğadaki canlı ve cansız varlıkların tamamı elementlerden
oluĢur. Canlı varlıkları oluĢturan elementlerden bir kısmı
aynı zamanda yeryüzünün yapısını da oluĢturur. Aynı
elementlerden oluĢtukları halde canlı vücudu, yeryüzü veya
diğer maddelerin yapısı arasında farklılıkların bulunmasının
nedeni, canlı vücudunu, yeryüzünü veya diğer maddeleri
oluĢturan elementlerin farklı sayı, çeĢit ve Ģekillerde
dizilmesidir.
Canlı Vücudunu OluĢturan Element ÇeĢitleri
ve Bunların Oranları :
• Oksijen → % 65
• Karbon → % 18
• Hidrojen → % 10
• Azot → % 3
• Kalsiyum → % 2
• Fosfor → % 1,1
• Potasyum → % 0,35
• Kükürt → % 0,25
• Sodyum → % 0,15
Yeryüzünde Bulunan Elementlerin Oranları :
• Oksijen → % 46,6
• Silisyum → % 27,7
• Alüminyum → % 8,1
• Demir → % 5,0
• Kalsiyum → % 3,6
• Sodyum → % 2,8
• Potasyum → % 2,6
• Magnezyum → % 2,1
kimyasal bağlar
Kimyasal bağ, moleküllerde atomları bir arada tutan kuvvettir.
Atomlar daha düĢük enerjili duruma eriĢmek için bir araya gelirler.
Bir bağın oluĢabilmesi için atomlar tek baĢına bulundukları
zamankinden daha kararlı olmalıdırlar. Genelleme yapmak gerekirse
bağlar oluĢurken dıĢarıya enerji verirler. Atomlar bağ yaparken,
elektron diziliĢlerini soy gazlara benzetmeye çalıĢırlar. Bir atomun
yapabileceği bağ sayısı, sahip olduğu veya az enerji ile sahip olduğu
veya az enerji ile sahip olabileceği yarı dolu orbital sayısına eĢittir.
Soy gazların bileĢik oluĢturamamasının sebebi bütün orbitallerinin
dolu olmasıdır.
Elektron yapıları farklı olan atomlar değiĢik biçimlerde bir araya
gelerek kimyasal bağ oluĢtururlar;
Bir atomdan diğer bir atoma elektron aktarılmasıyla
iki atomun ortak elektron kullanmasıyla
Not: Elektron alıĢ veriĢi ya da elektron ortaklaĢmasının nedeni;
atomların kararlı hale gelebilmek için elektron düzenlerini, soy
gazlarınkine benzetme isteğidir. Soy gazların 8 değerlik
elektronuna sahip oldukları için elektron sayısı 8e tamamlanır.
Buna oktet kuralı denir.
ĠYONĠK BAĞLAR
Ġyonik bağlar, metaller ile ametaller arasında metallerin elektron
vermesi ametallerin elektron almasıyla oluĢan bağlanmadır.
Ġyonik
katılar(+)
belirli
bir kristal
yapı elektron alarak
Metaller elektron
vererek
değerlik,
ametaller
(-) değerlikoluştururlar.
alırlar. Bu Ģekilde oluĢan (+) ve (-) yükler birbirini
büyük bir kuvvetle çekerler. Bu çekim iyonik bağın oluĢumuna
Ġyonik
bileşikler
sıcaklığında
katı
sebep olur. Onun
içinbağlı
iyonik
bağlı oda
bileĢikleri
ayrıĢtırmak
zordur.
halde bulunurlar.
Elektron aktarımıyla
oluĢan bileĢiklerde, kaybedilen ve kazanılan
Ġyonik bileşikler katı halde elektriği iletmez.
elektron sayıları
eĢit olmalıdır.
Sıvı halde
ve çözeltileri elektriği iletirler.
Ġyonik katılar belirli bir kristal yapı
oluĢtururlar.
Ġyonik bağlı bileĢikler oda sıcaklığında katı
halde bulunurlar.
Ġyonik bileĢikler katı halde elektriği iletmez.
Sıvı halde ve çözeltileri elektriği iletirler.
KOVALENT BAĞLAR
Hidrojenin ametallerle ya da ametallerin kendi arlarında
elektronlarını ortaklaĢa kullanarak oluĢturulan bağa kovalent bağ
denir. Değerlik elektronları elementin simgesi çevresinde noktalarla
gösterilerek elektron ortaklaĢması gösterilir. Bu tür formüllere
elektron nokta formülleri denir.
Periyodik cetvelin A gruplarında değerlik elektron sayısı grup
numarasına eĢit olduğundan grup numarası, simge çevresine
konulacak elektron sayısını gösterir.
Ġki atom arasına konulan noktalar her iki atom için de sayılır ve
kararlı moleküller de atomların simgeleri çevresinde toplam nokta
sayısı 8 dir.
Moleküllerin elektron nokta formülleri yazılırken;
Molekülü oluĢturan atomların değerlik
elektronları belirlenir.
Yapacakları bağ sayıları saptanır, çok bağ
yapanlar merkez atomu olarak alınır.
Merkez atomu birden fazla ise merkez atomları
birbirine bağlanacak Ģekilde yazılır.
Değerlik elektronlar, atomların çevresine oktet
kuralına uyacak Ģekilde dağıtılır.
a.Apolar Kovalent Bağ:
Kutupsuz bağ, yani (+), (-) kutbu yoktur. Ġki hidrojen
atomu elektronları ortaklaĢa kullanarak bağ oluĢtururlar.
Ġki atom arasındaki bağ H-H Ģeklinde gösterilir. Flor
atomunun son yörüngesinde 7 elektronu vardır ve bir tane
yarı dolu orbitali vardır. 2 flor atomu arasında elektronlar
ortaklaĢa kullanılarak bir bağ oluĢur.
Oksijenin son yörüngesinde 6 elektronu vardır. 2 tane yarı
dolu orbitali vardır. Buna göre 2 tane bağ oluĢtururlar.
b.Polar Kovalent Bağlar: Farklı ametaller arasında
oluĢan bağa polar kovalent bağ denir. Elektronlar iki atom
arasında eĢit olarak paylaĢılmadığından kutuplaĢma
oluĢur. Hidrojen ve Flor elektron ortaklığı ile bileĢik
oluĢturmuĢ durumdadır. Florun elektron alması yani
elektronu kendisine çekme gücü hidrojenden daha fazla
olduğundan elektron kısmen de olsa Flor tarafındadır.
Dolayısıyla Flor kısmen (-), Hidrojen ise kısmen (+)
yüklenmiĢ olur. Bu olaya kutuplaĢma denir. Bu tür bağa
polar kovalent bağ denir.
Not: Bazı hallerde ortaklaĢılan her iki elektron da bir atom
tarafından verilir. Böyle bağlara koordine kovalent bağ
denir.
BĠR ATOMUN
YAPABĠLECEĞĠBAĞ SAYISI
Bir atomu yapabileceği bağ sayısı; o atomun sahip
olduğu veya çok az enerji ile sahip olabileceği yarı dolu
orbital sayısı kadardır. Bir alt yörüngeden bir üst
yörüngeye elektron uyarılarak yarı dolu orbital
oluĢturma çok enerji istediğinden bağ yapmaya
elveriĢli olamaz.
BAĞ ENERJĠLERĠ
Kimyasal bağ oluĢurken açığa çıkan enerji, bu bağları kırmak için
moleküle verilmesi gereken enerjiye eĢittir. Bu enerjiye bağ enerjisi
denir. Bağ enerjisi ne kadar büyükse oluĢan bileĢik o kadar
sağlamdır. Moleküllerde iki atom arasındaki bağ sayısı arttıkça
bağ uzunlukları azalır ve bağ enerjileri artar. Bağın iyon
karakteri arttıkça, iyonlar arasındaki çekme kuvvetleri artacağından
bağı koparmak daha çok enerji ister. Ġki atomlu moleküllerde 1 mol
XYnin ayrıĢması için gereken enerjiye molar bağ enerjisi denir.
Molekül Polarlığı, Molekül Geometrisi ve
HibritleĢme Ġki atomlu bir molekülün polar olup
olmadığını tahmin etmek kolaydır. Molekül aynı cins iki
atomdan meydana gelmiĢse atomlar arasındaki bağ ve
molekül apolardır. Ġki atomlu molekülde atomlar farklı ise
molekül ve bağlar polardır. Ġkiden fazla atom ihtiva eden
moleküllerinin polarlığını tahmin etmek oldukça zordur.
Molekülün içindeki bağlar polar olmasına rağmen,
molekülün kendisi polar
olmayabilir
HibritleĢme (melezleĢme): Bir atomun son
periyodundaki dolu ve yarı dolu orbitallerin kaynaĢarak
özdeĢ yeni orbitaller oluĢturması olayına hibritleĢme
denir. yeni oluĢan orbitallere hibrit orbitalleri denir.
Elektronlar merkez atoma en uzakta bulunacak Ģekilde
yerleĢirler.
Not: HibritleĢme yalnız yarı dolmuĢ orbitallerin değil,
dolu ve yarı dolu bütün değerlik orbitalleri arasında olur.
Ancak merkezi atomun yapabileceği bağ sayısı onun
sahip olabileceği yarı dolu orbital sayısı kadardır.
HibritleĢme, kimyasal bağ sırasında gerçekleĢir.
Serbest haldeki atomlarda söz konusu değildir. Hibrit
orbitalleri uzayda belirli Ģekilde yönlenirler ve bu durum
molekülün geometrik biçimini belirler.