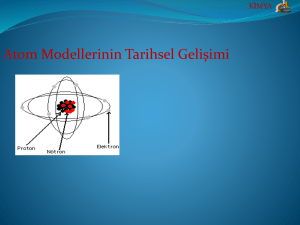
Atom Modellerinin Tarihi Gelişimi
Thomson Atom Modeli
(1902) üzümlü kek şeklindeki atom modeli;
Thomson atom altı parçacıklar üzerinde çalışma*lar yaparken icat ettiği katot tüpü yardımıyla 1887
yılında elektronu keşfinden sonra kendi atom modelini ortaya attı. Thomson’a göre Atom dışı tamamen
pozitif yüklü bir küre olup ve negatif yüklü olan elektronlar ise kek içerisindeki gömülü üzümler gibi bu
küre içerisine gömülmüş hâldedir.
Rutherford Atom Modeli:
(1911) güneş sistemine benzeyen atom modeli;
Thomson’m modeline pek inanmayan Rutherford ünlü alfa saçılması deneyi ile kimya tarihine nükleer
atom kavramım sokarak yeni çığır açmıştır. İnce altın levhayı radyoaktif atomların yayınladıkları alfa
ışınlarıyla bombardımana tabii tutan Lord Ernest Rutherford gözlemlerine ve deneylerinin sonuçlarına
dayanarak, atomun Thomson tarafından hayâl edilmiş “fon statik topluluk olamayacağına hükmetti. Ve
atomun yapısını, topta gezegenlerin Güneş’in etrafında gravitasyon kuvvetinin etkisiyle dolandıkları gibi
gibi elektronlum da pozitif yüklü bir çekirdeğin etrafında elektriksel çekim kuvvetinin etkisi alanda
dolanmakta olduğu dinamik bir model olarak açıkladı.
Bohr Atom Modeli :
(1913) kuvantum teorisinin sahneye çıkışı;
Rutherford atom modeli üzerinde kafa yoran Danishy;markalı fizikçi Niels Bohr, klasik fizik gereği
çekirdeğin etrafında dolanan elektronların ivmeli hareketlerinden dolayı, enerji kaybederek çekirdeğe
düşmeleri gerektiğini düşündü. Ama hiç de böyle olmamakta ve atom kararlılığını muhafaza etmektedir.
Bohr atomun bu karalılığını;
1. Elektron hareketlerinin ancak belirli yörüngeler (enerji seviyeleri) üzerinde mümkün olmasıyla,
2. Elektronun, bir yörüngeden bir başkasına geçişini ise belirli bir miktarda (bir kuvantum miktarında) bir
enerji kazanmasına (ya da kaybetmesine) bağlı olduğuna, ve
3. Bir atomda, elektronların daha da alana düşme*yecekleri bir en alt enerji düzeyinin var olmasıy*la
açıklamaktadır.
. edilir. Şimdi atom modellerini inceleyelim.
1.1.1. DALTON ATOM MODELİ
Sabit oranlar kanunu ve katlı oranlar kanunu olarak gördüğümüz bileşik-i terdeki kütlesel ilişkilere
bakarak 1803 yılında John Dalton, maddelerin çok çok küçük yapı taşlarının topluluğu halinde bulunduğu,
fikrini ileri sürdü.
Dalton atom teorisi olarak ortaya konulan temel özellikler şunlardır;
1. Maddelerin özelliklerini gösteren birim parçacıklar atomlar veya atom gruplarıdır.
2. Aynı cins elementlerin atomları birbirleriyle tamamen aynıdır.
www.herodevyapilir.com
3. Atomlar içi dolu kürelerdir.
4. Farklı cins atomlar farklı kütlelidir.
5. Maddenin en küçük yapıtaşı atomdur. Atomlar parçalanamaz.
6. Atomlar belli sayılarda birleşerek molekülleri oluştururlar.
Örneğin, 1 atom X ile l atom Y’den XY, l atom X ile 2 atom Y den XY2 bile*şiği oluşur. Oluşan bileşikler
ise standart özellikteki moleküller topluluğudur.
Atomla ilgili günümüzdeki bilgiler dikkate alındığında Dalton atom modelin*deki eksikliklere ek olarak üç
önemli yanlış hemen fark edilir.
1. Atomlar, içi dolu küreler değildir. Boşluklu yapıdadırlar.
2. Aynı cins elementlerin atomları tam olarak aynı değildir. Kütleleri farklı (İzotop) olanları vardır.
3. Maddelerin en küçük parçasının atom olduğu ve atomların parçala*namaz olduğu doğru değildir.
Radyoaktif olaylarda atomlar parçala*narak daha farklı kimyasal özellikte başka atomlara ayrışabilir;
pro*ton, nötron, elektron gibi parçacıklar saçabilirler.
1.2. THOMSON ATOM MODELİ
Dalton atom modelinde (-) yüklü elektronlardan ve (+) yüklü proton*lardan söz edilmemişti. Yapılan
de*neyler yardımıyla, katot ışınlarından elektronun, kanal ışınlarından proto*nun varlığı ortaya
konulmuştu. Bu bilgiler ışığında Thomson’un atomla İlgili fikirlerini aşağıdaki şekilde özetleyebiliriz.
1. Protonlar ve nötronlar yüklü par*çacıklardır. Bunlar yük bakımın*dan eşit, işaretçe zıttırlar. Pro*ton +
1 birim yüke; elektron ise -l birim yüke eşittir.
2. Nötr bir atomda proton sayısı elektron sayısına eşit olduğundan yük*ler toplamı sıfırdır.
3. Atom yarıçapı 10-8 cm olan bir küre şeklindedir. Söz konusu küre içerisinde proton ve elektronlar
atomda rast gele yerlerde bulunurlar. Elektronun küre içindeki dağılımı üzümün kek içindeki dağılımına
benzer.
4. Elektronların kütlesi ihmal edilebilecek kadar küçüktür. Bu nedenle atomun ağırlığını büyük ölçüde
protonlar teşkil eder.
Nötron denilen parçacıklardan bahsedilmemesi Thomson Atom teorisi*nin eksiklerinden biridir. Proton ve
elektronların atomda rastgele yerlere bulunduğu İddiası ise teorinin hatalı yönüdür.
www.herodevyapilir.com