Slayt 1 - WordPress.com
advertisement
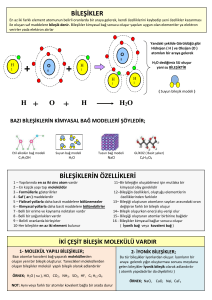
BİLEŞİKLER ve FORMÜLLERİ Bileşikler ve Formülleri • Bilinen yaklaşık 120 çeşit element vardır. Bu elementlerin yaklaşık % 90 ‘ı tabiatta bulunur. • Ancak bugün bilinen yaklaşık 30 milyon bileşik vardır. Buna göre günümüzdeki bileşik tanımını ve bileşikllerin özelliklerini belirtelim. Farklı elementlerin belirli oranlarda biraraya gelerek kendi özelliklerini kaybederek oluşturdukları yeni maddelere bileşik denir. • • • • • Bileşikler en az iki çeşit element içerirler. Bileşikteki elementlerin oranları bellidir. Bu nedenle her bileşiğin bir formülü vardır. Bileşiği oluşturan elementler kendi özelliklerini kaybederler. Bileşikler içerdikleri elementlerden farklı kimyasal özellikler gösterir. • Bileşikler kimyasal değişimler sonucunda farklı bileşiklere ya da elementlerine ayrılabilir. • Bileşikler, atomları arasında iyonik bağ bulunanlar iyon yapılı bileşikler, atomları arasında kovalent bağ olanlar ise molekül yapılı bileşikler olarak sınıflandırılır. * İyon yapılı bileşiklerin sulu çözeltileri elektrik akımını iletirken, molekül yapılı bileşiklerin sulu çözeltileri elektrik akımını iletmez. • * İyonik yapılı bileşikler suda iyonlarına ayrılarak çözünürler. Molekül yapılı bileşikler ise suda molekül halinde yani parçalanmadan çözünürler. 1. Bazı Bileşikler ve Kullanım Alanları a. Yemek Tuzu ( NaCl ) Beyaz kristal yapılı bir bileşiktir. İnsan dahil tüm canlıların besin kaynaklarından olan tuz, ticari bakımdan da önemli bir maddedir. Dünyanın her yerinde rastlanabilen sofra tuzu tarih boyunca önemli bir ihtiyaç ve ticaret maddesi olmuştur. Besin maddesi olması dışında tuz dericilikte, hayvan besiciliğinde, su yumuşatma sistemlerinde ve kimya sanayisinde yaygın olarak kullanılır. b. Su ( H2O ) Su, bilinen tüm yaşam formları için gerekli olan tatsız ve kokusuz bir maddedir. Su, canlıların yaşaması için hayati bir öneme sahiptir. Canlıların yapısındaki hemen tüm olayların mekanizmasında suyun hayati önemi vardır. Çok iyi bir çözücü olması nedeniyle endüstride de sayısız kullanım alanı vardır. c. Şeker ( C6H12O6 ) Besin maddelerinde bulunan ve vücudun temel ihtiyaçlarından olan maddedir. Hücreler onu bir enerji kaynağı ve metabolik reaksiyonlarda bir ara ürün olarak kullanırlar. d. Karbondioksit ( CO2 ) Karbondioksit, kovalent bağlı bir karbon ve iki oksijen atomundan oluşan moleküle sahip, normal koşullarda gaz halinde bulunan bir bileşiktir. Renk ve kokusu yoktur. Formülü CO2 şeklinde olup karbon içeren besin maddelerin metabolize edilmesi sonucu meydana gelen bir üründür. CO2 yangın söndürme aracında da kullanılır. Bugün birçok yerde bulunması mecburi olan bu araçların aslını basınçla doldurulmuş CO2 meydana getirir. e. Amonyak ( NH3 ) Amonyak, azot ( N ) ve hidrojenden ( H ) oluşan renksiz ve kötü kokulu bir gazdır. Kimyasal formülü NH3 ‘tür. Amonyak vücut için çok tehlikeli bir maddedir. 2-3 damlası insanı komaya sokabilir. Bundan dolayı kullanılırken çok dikkat edilmesi gerekir. f. Hidrojen Klorür ( HCl ) Hidrojen klorür ( HCl ), hidrojen ( H ) ve klor ( Cl ) elementlerinden oluşan, oda sıcaklığında ve oda basıncında gaz halinde bulunan bir bileşiktir. Hidrojen klorür ( Hidroklorik asit ) insan midesindeki, sindirimi sağlayan sularda da bulunur. Derişik hidroklorik asit ise deride yanıklara ve iltihaplara neden olur. Ayrıca seyreltik çözeltileri ( tuz ruhu ) temizlik maddesi olarak kullanılır. 2. Bileşik Formülleri Her bileşiğin atomları arasında belirli bir oran olduğundan, bu oranı belirten formülleri vardır. • Su bileşiğinin oluşması sırasında 1 tane O atomu farklı 2 tane H atomu ile bağ oluşturduğundan molekül formülü H2O olur. • Karbondioksit bileşiğinin oluşması için 1 tane C atomu farklı 2 tane O atomu ile bağ oluşturduğundan molekül formülü CO2 olur. • Amonyak bileşiğinin oluşması için 1 tane N atomu 3 farklı H atomu ile bağ oluşturduğundan molekül dormülü NH3 olur. • C2H5O6 bileşiğinde, molekülü oluşturan atomlar 2 tane C atomu, 6 tane H atomu ve 1 tane O atomudur. • Her bileşiğin formülüne yani içerdiği atom sayılarına göre sistematik bir adı ya da özel adı vardır. Çok bilinen ve kullanılan bazı bileşiklerin formülleri ve isimleri : KARIŞIMLAR • Günlük hayatımızda kullandığımız bir çok maddenin elementlerden ve bileşiklerden oluştuğunu biliyoruz. • Yiyecek ve içeceklerimizin ya da kullandığımız bir çok maddenin aslında elemnetleri ve bileşikleri içeren karışımlar olduğunu biliyor muydunuz ? … • Gerçekte içtiğimiz su, soluduğumuz hava, yediğimiz yemeklerin herbiri karışımdır. • Öyleyse karışımın genel bir tanımını yapalım ve karışımların özelliklerini belirtelim. Birden fazla maddenin rastgele oranlarda bir araya gelerek aralarında bir kimyasal bağ oluşturmadan biraraya gelerek meydana gelen maddelere karışım denir. • Karışımlar en az iki çeşit madde içerirler. • Karışımı oluşturan maddelerin oranları belirli değildir. • Bu nedenle karışımlar bir sembol ya da formül ile gösterilmezler. • Karışımı oluşturan maddeler kimyasal kimliklerini geğiştirmez. • Fiziksel yöntemlerle bileşenlerine ayrışırlar. ( Eleme, süzme, damıtma … ), Karışımlar görünümlerine göre heterojen ve homojen karışımlar olmaz üzere iki çeşittir. • 1. Heterojen Karışım Karışımı oluşturan maddeler, her yerine eşit oranda yayılmadıysa heterojen karışımdır. Heterojen karışımlar genel ifadesi ile adi karışım olarak adlandırılır. Kum, su içerisine atıldığına büyük çoğunluğu dibe çöker. Kum, su içerisinde her yere eşit miktarda dağılmadığından oluşan kum – su karışımı heterojendir. • 2. Homojen Karışımlar Karışımı oluşturan maddelerin, karışımın her tarafına eşit miktarda dağılmasıyla meydana gelen karışımlar homojen karışımdır. Homojen karışımların oluşumunda temel esas bir maddenin diğer madde içerisinde çözünmesidir. Bu nedenle homojen karışımların tamamı çözelti olarak adlandırılır. • Çay şekeri, su ile karıştırıldığında, şeker suyun her yerine eşit miktarda yayılır ve homojen bir karışım oluşur. • Günlük hayatta kullandığımız bir çok madde çözeltidir. Örneğin içtiğimiz gazoz ve sodalar, soluduğumuz hava, dişlerimizin dolgusu için kullanılan amalgam, makinelerdeki metal parçaların bir çoğu, serinlemek için kullandığımız kolonya ve bunlar gibi birçok madde çözeltidir. • Bir çözeltiyi oluşturan maddelerden miktarı çok oaln genellikle çözücü, miktarı az olan ise genellikle çözünen olarak adlandırılır. • Örneğin saf su içinde bir mşktar yemek tuzu çözündüğünde oluşan çözeltide saf su çözücü, yemek tuzu ise çözünendir. • Çözeltiler, kendisini oluşturan maddelerin fiziksel hâllerine göre katı, sıvı ya da gaz fazında bulunabilirler. Örneğin, farklı metallerin karışması ile oluşan çözeltilere alaşım denir va katı fazlıdırlar. • Örneğin ; yemek tuzunun suda çözünmesi ile oluşan tuzlu su sıvı fazdaki bir çözeltidir. • a. Çözünme Olayı Bir çözeltinin oluşması sırasında çözücü ve çözünen maddeler arasında bir etkileşim olur. Çözücünün tanecikleri, çözünen maddenin taneciklerinin etrafını kuşatırlar. Bu şekilde çözünen madde en küçük birimine kadar ayrılarak her yere eşit oranda dağılır. • Çözünme Olayının Türüne Göre Çözeltilerin Sınıflandırılması • ==> Moleküllü Çözeltiler • Çay şekeri suya eklendiğinde birbirine sıkıca bağlı olan şeker molekülleri yavaş yavaş su molekülleri tarafından sarılır. • Bu şekilde olay şeker moleküllerinin tamamı çözününceye kadar devam eder. • Şeker moleküllerinin yapısında bir değişim olmadan bir çözünme gerçeklerşmiştir. Oluşan bu tür çözeltiler moleküllü çözelti olarak tanımlanır. • ==> İyolu Çözeltiler • Yemek tuzu suya eklendiğinde düzenli yığınlar hâlinde zıt yüklü iyonlar birbirinden ayrılır. • Su molekülleri katyon ve anyonları ayrı ayrı sararak çözünme olayını gerçekleştirirler. • Çözünme tamamlandığında, sodyum ve klor iyonları çözeltinin her yerine eşit oranda yayılmış olur. • Oluşan bu tür çözeltiler iyonlu çözelti olarak tanımlanır. • => Moleküllü çözeltilerde iyon yoktur. Bu nedenle oluşan çözelti elektrik akımını iletmez. Öyleyse moleküllü çözeltiler, elektrolit olmayan çözeltiler olarak da tanımlanabilir. • => İyonlu çözeltiler bir elektrik devresine seri olarak bağlandığında akımın iletilmeye devam ettiği görülür. Öyleyse iyonlu çözeltiler, elektrolit çözeltiler ( elektrik akımını ileten çözeltiler ) olarak da tanımlanabilir. • b. Çözünme Hızına Etki Eden Faktörler • Bir miktar su içerisine çözünebilecek miktarda çay şekeri attığımızı düşünelim. • Su içerisinde çay şekeri nasıl daha çabuk çözünebilir ? • ===> Sıcaklığın Etkisi • Sıcaklık arttıkça çözücü ve çözünen madde taneciklerinin hareket hızları artar. Birim zamanda birbirleri ile daha çok temas ettiklerinden çözünme olayının hızı artar. • ===> Çözücü ve Çözünen Arasındaki Temas Yüzeyinin Etkisi • Çözünen madde tanecikleri daha küçük parçalar hâline getirilirse, çözücü madde ile daha fazla temas edeceğinden çözünme hızı artar. • Aynı şekilde bir çözelti karıştırılırsa birim zamanda meydana gelen temas artacağından çözünme hızı artar. • c. Çözeltideki Maddelerin Oranına Göre Çözeltilerin Sınıflandırılması • Çözeltiler, bir karışım türüdür ve karışımlarda maddelerin karışma oranları belirli değildir. • Bu nedenle aynı çözücü ve çözünenler kullanılarak farklı karışma oranlarında çözeltiler elde edilebilir. • ===> Bir miktar su ve az miktarda yemek tuzu kullanılarak bir çözelti elde ettiğimizi düşünelim. • Bu çözelti içerisine bir miktar daha yemek tuzu attığımızda onun da tamamen çözündüğünü varsayalım. Bu durumda oluşan ilk çözelti ile ikinci çözelti arasındaki fark nedir ? • ====> Derişik Çözeltiler • Aynı maddeler kullanılarak hazırlanan farklı iki çözeltiden birim hacmindeki çözünen madde miktarı çok olan çözeltiler derişik çözeltilerdir. • =====> Seyreltik Çözeltiler • Aynı maddeler kullanılarak hazırlanan farklı iki çözeltiden birim hacmindeki çözünen madde miktarı az olan çözeltiler seyreltik çözelitlerdir. • Örneğin ; şekildeki çözeltileri en seyreltik olandan en derişik olana doğru sıralayınız ? • • 1. Çözeltide; 150 gr suda → 80 gr şeker • 2. Çözeltide; 50 gr suda → 60 gr şeker 150 gr suda → 3 . 60 = 180 gr şeker • 3. Çözeltide; 100 gr suda → 50 gr şeker 150 gr suda → 1,5 . 50 = 75 gr şeker Eşit miktardaki çözücü içinde çözünen madde miktarı karşılaştırıldığında; 3. Çözelti > 1. Çözelti > 2. Çözelti • ===> Bir çözeltinin derişik ya da seyreltik olarak tanımlanması için hangi çözeltiyle karşılaştırıldığı önemlidir. • Yani derişiklik ya da seyreltiklik görecelidir. Örneğin bir fincan çayda iki çay kaşığı şeker çözünmüş bir çözelti, Bir fincan çayda bir çay kaşığı şeker çözünmüş bir çözeltiye göre derişiktir. Bir fincan çayda üç çay kaşığı şeker çözünmüş bir çözeltiye göre seyreltiktir. 1. Fincan ( Seyreltik ) 2. Fincan (1.sine görederişik2.sine seyreltik) 3. Fincan ( Derişik ) Çözeltilerin derişimlerini değiştirmek için aşağıdaki işlemler yapılabilir. Çözeltiyi derişik hâle getirmek için, • İçerisinde aynı maddeden bir miktar daha çözülebilir. • Çözelti ısıtılarak çözücünün bir kısmı buharlaştırılabilir. Çözeltiyi seyreltik hâle getirmek için, • Çözeltinin sıcaklığı değiştirilerek içerisindeki çözünen maddenin bir kısmı katı hâlde çöktürülebilir. • Çözeltiye bir miktar daha çözücü eklenebilir.