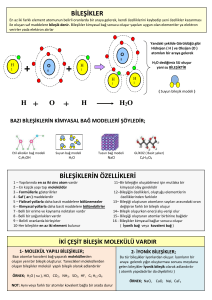
Günlük hayatta yiyecek ve
içeceklerimizin çoğunu, elementleri
veya bileşikleri birbirine karıştırarak
elde ederiz. Doğadaki maddelerin de
hemen hemen hepsi karışım halinde
bulunmaktadır.
Birden fazla maddenin rastgele
miktarlarda bir araya gelmesiyle oluşan
madde topluluğuna ‘karışım’ denir.
Şekerli su, tuzlu su, salata, çorba …
birer karışımdır.
Karışımların özellikleri:
Karışımlar yeni ve saf madde değildirler.
Kendini oluşturan maddenin özelliklerini
taşırlar.
Karışımı oluşturan maddelerin kimyasal
yapılarında değişme olmaz.
Fiziksel yolla ayrıştırılabilirler.
Belirli bir kimyasal formülleri yoktur.
Karışımlar görünümlerine göre 2’ye ayrılır:
Homojen karışımlar
( Adi karışımlar )
Heterojen karışımlar
( Çözeltiler )
HETEROJEN KARIŞIMLAR
Özellikleri her yerinde aynı olmayan ve
dışarıdan bakıldığında tek bir madde
gibi gözükmeyen karışımlardır.
Örnek: Salata, talaş-su karışımı gibi
HOMOJEN KARIŞIMLAR:
Özellikleri her yerinde aynı olan ve
dışarıdan bakıldığında tek bir madde
gibi gözüken karışımlardır.
Örnek: Şekerli su, tuzlu su gibi
Çözeltiler, homojen karışımlardır. Günlük
hayatta çözelti adını pek kullanmasak
bile çözeltilerle iç içe yaşarız.
Soluduğumuz hava, içtiğimiz
meşrubatlar, kullandığımız metal paralar
ve bunun gibi birçok madde birer
çözeltidir.
Çözeltileri oluşturan maddelerden
miktarı çok olan çözücü, az olan da
çözünen, olarak adlandırılır.
Örnek:Bir bardak suya bir kaşık şeker
eklenerek hazırlanan çözeltide; su
çözücü, şeker ise çözünendir.
Çözeltiler fiziksel hallerine bağlı olarak katı, sıvı
ve gaz halde bulunabilirler.
SIVI ÇÖZELTİLER
Sıvı-Katı: Burun damlası, şerbet(su+şeker),…
Sıvı-Sıvı: Sirke, kolonya(su+alkol),…
Sıvı-Gaz: Gazoz, deniz suyu(su+oksijen),…
Çözelti oluşurken çözücü ve çözünen
maddeler arasında bir etkileşim olur.
Çözünen maddenin tanecikleri çözücü
ile etkileşerek birbirinden ayrılır ve
çözücünün her tarafına dağılır. Böylece
çözücü ve çözünen maddeler en küçük
birimlerine kadar ayrılır.
Çözücü ve çözünen maddelerin birbiri
içinde iyonlarına veya moleküllerine
ayrılmasına ‘çözünme’ denir. Çözünme
sonrasında şekerli su moleküllerine,
tuzlu su iyonlarına ayrışır.
Elektrik iletkenliklerine göre çözeltiler 2 ye ayrılır.
Elektrolit çözeltiler
Elektrolit olmayan çözeltiler
Elektrolit çözeltiler: Çözündüğü zaman
iyonlarına ayrılan iyonik bileşiklerin suda
çözünmeleri ile oluşan çözeltilerdir. İyonlar yüklü
olduğu için elektrik akımını iletmiştir.
Elektrolit olmayan çözeltiler: çözündüğü
zaman iyonlarına ayrışmayan bu yüzden
de elektrik akımını iletmeyen
çözeltilerdir.
ÇÖZÜNME HIZINA ETKİ EDEN
ETMENLER
1.
2.
3.
SICAKLIK: Sıcaklığı arttırırsak çözücü
ve çözünen madde taneciklerinin
çarpışma hızı artacak ve madde daha
çabuk çözünecektir.
Sıcaklık artarsa çözünme hızı da artar.
MADDEYİ UFALAMAK: Ufalarsak
çözünme hızı da artar.
ÇÖZELTİYİ KARIŞTIRMAK: Çözeltiyi
karıştırmak da çözünme hızını arttırır.
Çözeltiler içerdikleri madde miktarına
göre 2’ye ayrılır
Derişik çözelti
-çözünen az
-çözücü fazla
Seyreltik çözelti
-çözünen fazla
-çözücü az