PERİYODİK SİSTEM
PERİYODİK SİSTEMİN TARİHÇESİ
1.PERİYODİK SİSTEMİN TARİHÇESİ:
Elementlerin deneysel olarak keşfedilme süreci, 1649 yılında Hennig Brand in fosforu bulmasıyla
başlamıştır. 1869 yılına kadar da toplam 63 element bulunmuştur. Bulunan element sayısındaki bu artışla birlikte
bilim insanları, elementlerin özelliklerini temel alarak sınıflandırma gereği duymuşlardır.
1829 da Alman kimyacı Johann Wolfgang Döbereiner (Yohan Volfkank Döberanynır) (1780-1849), fiziksel
ve kimyasal özellikleri birbirine benzer elementlerin üçlü gruplar (triadlar) oluşturduğunu görmüştür. Bu gruplardaki
elementlerin atom kütlelerinin düzenli olarak arttığını ve ortadaki elementin atom kütlesinin yaklaşık olarak diğer iki
elementin atom kütleleri toplamının ortalamasına eşit olduğunu saptamıştır.
Triadlar Kuralı:
Aynı grupta bulunan elementlerden, ortadaki elementin atomağırlığı yaklaşık olarak, gruptaki diğer iki
elementin atom ağırlıklarının ortalamasına eşittir.
7
Li
Na
39
K
23
7 + 39
= 23 ( ortadakine eşit )
2
[ (Ca, Sr, Ba) , (P, As, Sb) , (S, Se, Te) , (Cl, Br, I ) gibi… ]
Birbirine benzeyen kimyasal ve fiziksel özelliklerinden yola çıkarak elementleri sınıflandıran Fransız bilim
insanı A.E. Bequyer De Chancourtois (Dö Şankortua) tarafından ilk periyodik sistem oluşturuldu. De Chancourtois,
oksijenin atom kütlesini (16) dikkate alarak bir silindirin çevresini 16 birime bölmüştür. Bu silindir üzerinde düşey
sütunlara elementleri, kendi geliştirdiği kütle formülüne göre yerleştirmiştir.
1864 te İngiliz kimyacı John Newlands (Can Nivlınds) a göre elementler atom kütlelerinin artış sırasına
göre dizildiklerinde sekizinci element birinciye, dokuzuncu element ikinciye benziyor ve bu ilişki bu şekilde devam
ediyordu. Newlands, bu durumu müzik notalarındaki oktavlara benzetti. Elementler arasındaki bu ilişkiyi
“Oktav Kuralı” olarak tanımladı. Ancak bu teori aynı yıl asal gazların keşfiyle bozuldu.
Elementlerin modern sisteme en yakın sınıflandırılması 1869 yılında yapılan Alman kimyacı Julius Lothar
Meyer’in ( Julis Lother Mayer ) ( 1830-1895 ) ve özellikle Rus kimyacı Dimitri Mendeleyev’in çalışmalarına
dayanmaktadır. Lother Meyer, bilinen elementleri atom kütlelerine göre sıralamıştır. Mendeleyev ise elementlerin
atom kütlelerine göre sıralandığında düzenli olarak yinelenen özellikler gösterdiğini gözlemlemiştir. 63 elementi
artan atom kütlelerine göre ve özellikleri birbirine benzeyenler alt alta gelecek şekilde sıralanmıştır. Böylece ilk
periyodik sistemi oluşturmuştur. Ayrıca Mendeleyev o güne kadar bulunamayan elementlerin ( Ga , Sc ve Ge )
yerlerini boş bırakmış bu elementlerin ilerde bulunacağından söz etmiştir. Hatta muhtemel özelliklerini de çok yakın
olarak ön görmüştür. Medeleyev H’i bir kenara bırakarak tablosunu oluşturdu. Tablo oluşturulurken Ca-Ti
arasındaki elementten dolayı ilk sorun ortaya çıktı. ( Scandiyum 1879 yılında bulunmuştur ). Mendeleyev Sc
elementin yerini boş bırakarak elementleri sıralamaya devam etti.
Mendeleyev periyodik sistemi hazırlarken her element için bir kart belirlemiştir. Belirlediği kartları atom
kütlesi artışına göre yatay bir sıra halinde dizmiştir. Bir elementin özelliklerine benzer ikinci bir element geldiğinde
ikinci elementi birinci elementin altına yerleştirerek yeni bir sıra yapmıştır. Her 8 veya 18 elementte bir benzer
özelliklerin tekrarlandığını görmüştür. Tekrarlarda sisteme uymayan atlamaların olduğunu, bu atlamaların daha
sonra bulunacak elementlerle doldurulabileceğini öngörmüş ve söz konusu elementler için boşluklar bırakmıştır.
Daha sonraki yıllarda keşfedilen elementlerle tamamlanan bu tablo Periyodik Sistem adını almıştır.
Mendeleyev, elementleri periyodik sistemde sıralarken atom kütlelerinden çok elementlerin özelliklerini göz
önünde bulundurmuştur.
Mendeleyev’in periyodik sisteminin asıl başarısı, yeni elementlerin bulunabileceğini öngörmesinde
yatmaktadır.
Mendeleyev’in başlıca hatası, elementlerin özelliklerini belirleyen etkenin elementlerin kütleleri olduğunu
düşünmesiydi.
MOSELEY VE MODERN PERİYODİK YASA:
Atom çekirdeğindeki proton sayılarının tespiti ve atomun özelliklerinin proton sayısı veya elektronların bir
fonksiyonu olduğunun anlaşılması periyodik sistemin düzenlenmesinde dönüm noktası olmuştur.
Atom numaralarının öneminin farkına varan bilim insanı İngiliz fizikçi Henry Moseley’dir. (1887-1915).
Moseley X-ışınları ile yaptığı deneylerde çeşitli elementlerin atom numaralarını bulmuştur. Periyodik sistemde
elementlerin atom kütlesi yerine, atom numarasına göre gösterilmesini önerdi. Proton sayısının atom numarasını
belirlediği göz önüne alınırsa elementlerin kimyasal özelliklerinin atom numarası ile ilişkili olduğu söylenebilir.
Modern periyodik sistemde, elementler artan atom numaralarına göre yatay satırlar ve düşey sütunlar
halinde düzenlenmiştir.
atom kütlesi
55,847
elektronegatiflik
1,8
I.iyonlaşma enerjisi
182
atom numarası
elementin adı
+2, +3
değerlikler
Fe
26
Demir
MODERN PERİYODİK SİSTEM:
Periyodik sistemde her element için ayrılan kutucuklar, o kutucukta belirtilen elementin sembolünü, atom
numarasını ve çok kullanılan bazı bilgileri içerebilir.
Periyodik sistemdeki satırlarına periyot denir. Periyodik sistemde 7 periyot bulunur. İlk periyotta 2, ikinci ve
üçüncü periyotta 8, dördüncü ve beşinci periyotta 18 element vardır. Altıncı periyot 32 elementi içeren uzun bir
periyottur. Bu periyodun 14 elementi çizelgenin altına ayrıca yerleştirilmiştir. Bunlara Lantanitler denir. Yedinci
periyodun da 14 elementi sistemin altına yerleştirilen Aktinitler dir.
Sütunlarda yer alan elementler benzer dış katman elektron dizilimine sahiptir ve bu elementlerin kimyasal
özellikleri birbirine benzerdir. Periyodik sistemdeki sütunlara grup denir. Gruplar değerlik elektron sayısını temsil
eder. A ve B olmak üzere iki tür grup bulunmaktadır.
Periyodik cetvel periyotlar ve gruplar dışında dört ana bloğa ayrılmıştır. Bunlar s, p, d ve f bloklarıdır.
Temel elektron dizilişleri s ile biten elementler s bloğunda (He hariç) , p ile bitenler p bloğunda, d ile bitenler
d bloğunda ve f ile bitenler f bloğunda yer alır. s ve p bloklarındaki elementler A gruplarını ,d ve f bloklarındaki
elementler ise B gruplarını oluşturur.
Periyot ve grupların bulunmasında baş kuantum sayısı, değerlik orbitaller ve değerlik elektron sayısı
kullanılır. Temel elektron dizilişinde baş kuantum periyot numarasını, değerlik elektron sayısı ise grup numarasını
verir. Değerlik orbitaller grubun türünü, değerlik elektron sayısı ise grubun numarasını verir.
Bu günkü kullandığımız periyodik tabloda elementler, atom numaralarına göre sıralanırken kimyasal
özellikleri benzer olanlar aynı grupta gruplandırılmışlardır.
Her periyot bir alkali metal ile başlar (yalnız birinci periyot bir ametal olan hidrojenle başlar), bir soy gazla
biter.
1.periyot 1 numaralı Hidrojenle başlar, 2 numaralı Helyum ile biter.
2.periyot 3 numaralı Lityum ile başlar,10 numaralı Neon ile biter.
3.periyot 11 numaralı Sodyum ile başlar, 18 numaralı Argon ile biter.
4.periyot 19 numaralı Potasyum ile başlar, 36 numaralı Kripton ile biter.
5.periyot 37 numaralı Rubidyum ile başlar, 54 numaralı Ksenon ile biter.
6.periyot 55 numaralı Sezyum ile başlar, 86 numaralı Radon ile biter.
7.periyot 87 numaralı Fransiyum ile başlar, bu periyot henüz tamamlanmamıştır.
Aynı grupta bulunan elementlerin en dış kabuklarında aynı sayıda elektron bulunur. Bu nedenle aynı grupta
bulunan elementler benzer özellik gösterir. Ancak aynı özellik göstermezler. A grubu elementlerinin grup numarası
değerlik elektron sayısına eşittir. Atomların değerlik elektron sayıları, o atomun kimyasal tepkimelerindeki
2
6
davranışlarını belirler. Soy gazlarda, He:1s , diğer soy gazlar :np ile bittikleri için kararlı maddelerdir. Kimyasal
tepkimelere girme eğilimleri yoktur.
Periyodik Sistem ; metaller, ametaller, yarı metaller ve soy gazlar olmak üzere 4 ana bölümden oluşur.
B grubu elementlerine; Geçiş Elementleri denir. Lantanit ve Aktinitlere de ; İç Geçiş Metalleri denir.
ELEMENT ATOMLARININ ELEKTRON DİZİLİMİ VE GRUP İLİŞKİSİ:
Periyodik tabloda atomların yerini bulmak için; atomun katman elektron dağılımı yapılır.
Son katmandaki toplam elektron sayısına, değerlik elektron sayısı denir.
Değerlik elektron sayısı A grubu elementlerinde, grup numarasını verir.
Katman sayısı da periyot numarasını verir.
Değerlik elektron sayısına bakarak iyon yükü tespit edilir.
5B
10Ne
18Ar
20Ca
31Ga
36Kr
: 2) 3)
: 2) 8)
: 2) 8) 8)
: 2) 8) 8) 2)
: 2) 8) 18) 3)
: 2) 8)18) 8)
2. periyot 3A
2. periyot 8A
3. periyot 8A
4. periyot 2A
4. periyot 3A
4. periyot 8A
PERİYODİK ÖZELLİKLERİN DEĞİŞİMİ
1.ATOMLARIN BÜYÜKLÜĞÜ VE ATOM YARIÇAPI:
Elementlerin fiziksel ( erime ve kaynama noktaları, yoğunluk, iletkenlik vb.) ve kimyasal özellikleri ( elektron
alma ve verme ) atom yarıçaplarıyla ilgilidir. Fakat atomun yarıçapını belirlemek güçtür. Atomun yarıçapını
belirleyen elektron bulutunun yeri, atom kimyasal bağlı ise bulunabilir. Buna göre ölçülen atom yarıçapının ne tür
olduğu belirtilmelidir.
Deneysel ve gözlemsel atom yarıçapı birbirine bağlı atomların çekirdekleri arasındaki uzaklık ölçülerek
hesaplanır. Buna göre atom yarıçapı ile ilgili,
Kovalent yarıçap
Van der Waals yarıçap
İyon yarıçapı tanımlamaları yapılabilir.
Kovalent yarıçap:
Kovalent bağla bağlanmış iki özdeş atomun çekirdekleri arasındaki uzaklığın yarısı o atomun yarıçapını
verir. Kovalent bağlar tekli, ikili, üçlü olabildiklerinden üç farklı kovalent yarıçap hesaplanabilir. Bu şekilde
-12
hesaplanan Cl atomunun yarıçapı, 99 pm olarak hesaplanmıştır. ( 1 pm = 10 m )
Van der Waals yarıçapı:
Soy gazlar yüksek basınç ve düşük sıcaklıkta katı haldedir. Bu maddeleri katı halde bir arada tutan
kuvvetler london kuvvetleri ve Van der Waals kuvvetleridir.
Van der Waals yarıçap, birbiri ile temas halinde olan moleküller arasındaki uzaklığa denir. Hidrojenin
kovalent yarıçapı 37 pm, van der Waals yarıçapı ise 120 pm’dir.
İyon yarıçapı:
İyonik bağla bağlanmış iyonların çekirdekleri arasındaki uzaklıktan ölçülür. İyonlar eş değer büyüklükte
olmadığından iyon yarıçapı iyonlar arasındaki uzaklığın yarısı değildir. Uzaklık katyon ve anyon arasında uygun
şekilde bölüştürülerek ayrı hesaplanır.
Bir iyonik bileşiğin fiziksel ve kimyasal özellikleri iyonların yarıçapı (büyüklüğü) ile ilgilidir. Nötr bir atom iyon
haline geçtiğinde büyüklüğü de değişir.
Bir metal atomu, pozitif iyon (katyon) oluşturmak üzere bir ya da daha çok elektron kaybettiğinde,
çekirdekteki pozitif yük miktarı elektron sayısından daha fazla olur. Çekirdek, elektronları daha kuvvetli
çeker ve bunun sonucu olarak katyonlar, nötr atomlarından daha küçük hale gelirler.
Bir ametal, negatif iyon (anyon) oluşturmak üzere bir ya da daha çok elektron aldığında çekirdek yükü sabit
kalırken fazla elektron nedeniyle elektronlar arasındaki itme kuvveti artar ve bunun sonucu olarak anyonlar,
kendilerini oluşturan nötr atomlardan daha büyük hale gelirler.
Periyodik Sistemde Farklı Gruplardaki Elementlerin İyon Büyüklükleri:
Aynı grupta, yukarıdan aşağıya doğru inildikçe elementlerde atom yarı çapı ve iyon yarı çapı artmaktadır.
Farklı gruplardaki elementlerin iyon büyüklüklerini karşılaştırabilmek için iyonların izoelektronik (aynı elektron
dizilimine sahip) olmaları gerekmektedir.
İzoelektronik iyonlar için katyonların anyonlardan daha küçük olduğu söylenebilir. Her iki iyonun elektron
+1
sayıları eşit olmasına rağmen çekirdek yükleri farklıdır. 19K iyonu daha fazla proton içerdiğinden çekirdek,
elektronları daha güçlü çeker. Bu iyon yarıçapının daha küçük olmasına neden olur.
Çekirdek yükü arttıkça çap küçülür.
-1
17Cl
181 pm
Ar
174 pm
18
+
19K
133 pm
İzoelektronik katyonlar arasında iyon yükü arttıkça yarıçap küçülmektedir.
+3
13Al
+2
12Mg
izoelektronik
13Al
+3
<
+2
12Mg
<
+1
11Na
+1
11Na
İzoelektronik katyonlardan iyon yükü daha büyük olanın, iyon yarıçapı daha küçük olur.
İzoelektronik anyonlar arasında iyon yükü arttıkça yarıçap artmaktadır.
-2
16S
-1
17Cl
İzoelektronik
16S
-2
>
17Cl
-1
İzoelektronik anyonlarda ise iyon yükü arttıkça iyon yarıçapı da artar.
Atom çekirdeğindeki protonlarla (+ yükler) en son temel enerji düzeyindeki elektronlar (- yükler) arasında
elektrostatik çekim kuvveti vardır. Elektrostatik çekim kuvveti, yüklerle doğru, yükler arasındaki uzaklığın karesi ile
ters orantılıdır. Atom yarıçapı ise bu elektrostatik çekim kuvvetiyle ters orantılıdır.
Q1 . Q2
F α
r
2
Elementlerin atom yarıçapları karşılaştırılırken aşağıdaki iki kural sırasıyla uygulanır:
1.Genellikle temel enerji düzeyi sayısı(n, katman sayısı) büyük olan element atomlarının çapı büyüktür.
4Be
2
: 1s
2
12Mg : 1s
2
2s
2
2s
2p
6
2
3s
n=2
n=3
rMg > rBe
2.Temel enerji düzeyi sayısı eşitse atom numarası büyük olan element atomlarının çapı küçüktür.
11Na
2
: 1s
2
16S : 1s
2
6
2s
2
2s
2p
6
2p
1
3s
2
4
3s 3p
n=3
n=3
rNa > rS
NOT: Ga’ un yarıçapı Al’ dan düşüktür bunun sebebi, “d-blok büzülmesi” dir.
Bir atom elektron aldıkça çapı büyür. Elektron verdikçe çapı küçülür.
Madde
O
+2
O
O
-2
Çekirdek Yükü
Elektron sayısı
İyon yarıçapı (A)
8
6
0.44
8
8
0.73
8
10
1.40
Nötr atomların periyot ve grup boyunca çaplarının değişimi:
a)Aynı periyotta soldan sağa doğru atom yarıçapı ve hacmi azalır.
b)Aynı grupta yukarıdan aşağıya doğru atom yarıçapı ve hacmi büyür.
2.İYONLAŞMA ENERJİSİ:
Bir metalin iyi iletken olması atom çekirdeklerinin değerlik elektronlarına zayıf kuvvet uygulamasıdır. Bunun
sonucunda elektronlar, boş değerlik orbitallerinde rahatlıkla hareket eder ve iletkenlik sağlanmış olur. Metal atomu
çekirdeğinin elektronlara zayıf kuvvet uygulaması elektronların az bir enerjiyle atomdan uzaklaştırabileceğini yani,
iyon haline geçebileceğini gösterir.
Gaz durumundaki nötr bir atomdan, bir elektronun uzaklaştırılması için gereken enerjiye “İYONLAŞMA
ENERJİSİ” denir. Atomun iyonlaşma enerjisi gaz boşaltım tüplerine doldurulmuş gaz haldeki elementin
iyonlaştırılmasıyla hesaplanır. İyonlaşma enerjisinin deneysel olarak hesaplanmasında katot tüpü kullanılır. Havası
boşaltılan tüpün iki ucuna birer elektrot yerleştirilerek oluşturulur.
Gaz halindeki nötr bir atomdan bir elektron uzaklaştırmak için gerekli enerji BİRİNCİ İYONLAŞMA
ENERJİSİDİR ( İE1 ).
+1 yüklü iyondan ikinci elektronu uzaklaştırmak için gerekli enerji İKİNCİ İYONLAŞMA ENERJİSİDİR ( İE2 )
E1 < E 2 < E 3
Periyodik sistemin birinci grubunu oluşturan alkali metaller en düşük iyonlaşma enerjisine
sahipken soy gazlar en yüksek iyonlaşma enerjisine sahiptir.
İyonlaşma enerjisi, endotermik bir olaydır. Bir atomun her sonraki elektronunu koparmak daha
zordur.
İyonlaşma olayında önce enerjisi en yüksek olan elektron koparılır. Çünkü bu elektronu koparmak için
gereken enerji en küçüktür. Bir elektronu uzaklaştırmak için verilecek enerji, elektronun çekirdekten olan uzaklığına
bağlıdır. Bu nedenle aynı grupta yukarıdan aşağıya doğru inildikçe atom yarıçapı arttığı için iyonlaşma enerjisi
azalacaktır.
Elementlerin iyonlaşma enerjilerinin karşılaştırılmasında iki kural uygulanır.
1.Genellikle iyonlaşma enerjisi atom yarıçapıyla ters orantılıdır.
1
İyonlaşma enerjisi α
Atom yarıçapı
Bir elektron atom çekirdeğinden ne kadar uzaksa, o elektron için ;
Koparılması o kadar kolaydır.
Üzerindeki çekim kuvveti o kadar azdır
Potansiyel enerjisi o kadar yüksektir.
2. Genellikle iyonlaşma enerjisi değerlik elektronları sayısı ile doğru orantılıdır.
İyonlaşma enerjisi α Değerlik elektronları sayısı
Elementlerin art arda gelen iyonlaşma enerjilerinden küçük olanların sayısı elementin
değerlik elektronları sayısı (grubunu) verir.
+
Al(g)
Al
+
Al
Al
+2
(g)
+2
Al
Al
(g)
Al
-
İE1= 580 kJ/mol
-
İE2=1815 kJ/mol
-
İE3= 2740 kJ/mol
+ e
(g)
+ e
(g)
+ e
+3
(g)
+3
Al
(g)
+4
-
(g)
+ e
İE4=11,600 kJ/mol
I., II, III. İyonlaşma enerjilerindeki artışlar normaldir. Ancak 4. elektron kopartılırken ani bir sıçrama görülür.
Öyleyse kolay koparılan elektronlar değerlik elektronlardır. Değerlik elektron sayısı, A grubu elementlerinde grup
numarasını verir. Bu yöntemle periyot numarası bulunamaz. Dolayısıyla Al’un;
Değerlik elektron sayısı: 3
Grubu :3A
Kararlı bileşiklerindeki değerliği:+3
3.Aynı grupta, yörünge sayıları arttıkça, elektronun çekirdek tarafından çekimi azalacağından, iyonlaşma
enerjileri azalır.
8Agrubunda; Xe<Kr<Ar<Ne<He
1Agrubunda; Rb<K<Na<Li<H
7Agrubunda; F>Cl>Br>I>At
4. Aynı periyotta, değerlik elektron sayısı arttıkça iyonlaşma enerjisi genellikle artar.
1
2
Bu düzensizliğin sebebi, küresel simetridir. 3A grubu p , 2A grubu elementleri de s şeklinde biter.
Dolayısıyla 3A grubundan elektron koparmak daha kolaydır. Aynı durum 6A grubu ile 5A grubu arasında da vardır.
3.ELEKTRON İLGİSİ:
Yüksek elektron ilgisinin anlamı, elektronun atoma eklenmesi sonucu büyük enerjinin açığa çıkmasıdır.
Elektron ilgisi, fazladan bir elektronun bir otoma ne derece sıkı bağlandığının bir ölçüsüdür.
F ve Cl gibi periyodik sistemin 7 A gurubunda bulunan elementlerin dış katman p orbitallerinde 5 e
bulunur. 1 e aldıklarında asal gaz elektron dizilimine benzeyecekleri için elektron ilgileri büyüktür. Atoma yaklaşan
elektron atoma ait elektron bulutu tarafından itilirken çekirdek tarafından çekilir. Çekme itmeden büyük olursa enerji
açığa çıkar. Açığa çıkan enerji ne kadar büyük olursa elementin elektron ilgisi de o kadar büyüktür.
Gaz haldeki bir atomun bir atomun bir elektron alması sırasında oluşan enerji değişimine “ELEKTRON
İLGİSİ” denir. Elektron ilgisi pozitif veya negatif olabilir.
Genellikle ametallerin I. elektronu alma işi ekzotermik, II. ve daha sonraki elektronları alma işi
endotermik olarak gerçekleşir.
1. Periyodik tabloda, elektron ilgisi soldan sağa doğru gidildikçe genellikle artar. 7A’da maksimuma ulaşır.
(Metallerin ve soy gazların elektron ilgileri yok kabul edilir.)
2. Periyodik tabloda, aynı grupta, yörünge sayısı arttıkça; elektron ilgisi genellikle azalır. Ancak F < Cl dur.
3. 1A grubu elementleri metal oldukları halde elektron ilgileri vardır.
4.ELEKTRONEGATİFLİK:
Elektronegatiflik, bir atomun kimyasal bağdaki elektronları kendine doğru çekme yeteneğidir.
Elektronegatiflik bağdaki elektronların birbirine göre elektronları çekme eğiliminin bağıl büyüklüğünü gösteren bir
sayıdır.
Pauling’e göre elektronegatiflik tanımı; bir molekül içindeki bir atomun bağın elektronlarını kendine doğru
çekme eğilimidir.
Elektronegatifliğin Mulliken Tanımı:
Elementin iyonlaşma enerjisi ve elektron ilgisinin mutlak değerlerinin aritmetik aritmetik ortalaması olarak
tanımlamıştır.
k. [ İyonlaşma enerjisi + Elektron ilgisi ]
Elektronegatiflik =
2
Pauling Mulliken Tanımı:
Pauling F’un elektronegatifliği 4,0 kabul edilmiştir. Diğer elementlerin elektronegatifliği buna kıyasla tespit
edilmiştir.
Bir atomun iyonlaşma enerjisi ve elektron ilgisi yüksekse bu atom bileşik oluştururken elektron alır ya da
elektron ortaklaşması sırasında bağ elektronlarını daha çok kendisine çeker. İyonlaşma enerjisi ve elektron ilgisi
düşükse bu atom elektron alma yerine elektron verme eğilimi gösterir.
Periyotlarda soldan sağa gidildikçe iyonlaşma enerjisi ve elektron ilgisi arttığı için elektronegatiflik de artar.
Gruplarda ise yukarıdan aşağıya doğru inildikçe iyonlaşma enerjisi ve elektron ilgisi azaldığından elektronegatiflik
de azalır.
5.PERİYODİK SİSTEMDE METALİK VE AMETALİK ÖZELLİKLERİN DEĞİŞİMİ:
Metallerin değerlik elektron sayısı genellikle az ve dolayısıyla iyonlaşma enerjileri düşüktür. Bu sebeple H
hariç 1A grubu elementleri, 2A grubu elementleri, tüm B grubu elementleri, B hariç tüm 3A grubu elementleri, Sn,
Pb, Bi, Lantanitler ve Aktinitler metaldirler. Periyodik tabloda sağdan sola doğru gidildikçe, metalik özellik özellik
azalır. Ancak metalik özellikler birden bitip ametallik özellik başlamaz. Metallerle ametallerin kesişim noktasındaki
elementlere Yarı Metaller diyoruz. (Kesin olmamakla beraber bu elementler; B,Si,Ge,As,Sb,Te) 1A’da H, 4A’da C,
5A’da N ve P, 6A’da O, S, Se,7A’da F,Cl,Br,I ametaller grubunda incelenirler.
Metaller: Periyodik tabloda, hidrojen hariç tüm 1A grubu elementleri; tüm 2A grubu elementleri; tüm B grubu
elementleri; 3A da Al, Ga, In, Tl; 4A Sn, Pb; 5A da Bi, lantanitler ve aktinitler metaller sınıfında incelenirler.
Metallerin kendilerine özgü ortak özellikleri şunlardır:
1. Cıva hariç hepsi, oda şarlarında (25 °C) katı halde bulunurlar. (Hg’nın EN:-39 °C)
2. Metalik parlaklık gösterirler.
3. İşlene bilirler. (Tel ve levha haline getirilirler) .
4. Isı ve elektrik akımını iletirler. (Metallerde elektrik iletkenliği serbest elektronları sayesine gerçekleşir. Sıcaklığın
artırılması metalik iletkenliği azaltır).
5. Metaller buharlaştırılınca metalik özelliklerini kaybederler.
6. Yoğunlukları 6 dan küçük olan metallere hafif metaller, büyük olan metallere ağır metaller denir.
7. Kimyasal tepkimelerde, elektron vererek + yükle yüklenirler, yükseltgenirler, indirgendirler.
8. Elektron almazlar. Kendi aralarında bileşik oluşturmazlar. Ancak homojen olarak karışarak alaşımları
oluştururlar.
9. Periyodik tabloda metallerle a metallerin kesişim noktasında bulunan, metalik özelliklerle beraber bazı ametalik
özelliklerde gösteren elementlere, yarı metaller denir. Bu elementler: B, Si, Ge, Sb, Te, Po, At elementleridir.
10. Metaller genelde bazik özellik gösterirler, bu sebeple asitlerle tepkimeye girerler. Ancak; Zn, Al, Sn, Pb, Cr diye
bilinen elementler hem asit hem de bazlarla tepkimeye girerler. Bu metallere amfoter metaller denir.
11. Asitlerle tepkimeye girerek H2 gazı açığa çıkartan metallere aktif metaller denir.
12. Asitlerle tepkimeye girerek H2 gazı açığa çıkartamayan metallere pasif metaller denir.
Ametaller: Periyodik tabloda; 1A’da H, 4A’da C, 5A’da N ve P, 6A’da O,S ve Se , 7A’da F, Cl, Br, I ametaller
sınıfında incelenirler.
Ametallerin özellikleri:
1.Oda şarlarında (25 °C) katı, sıvı ve gaz hallerinde bulunurlar. (katı: C,P,S,I ; sıvı: Br ; gaz: N2, O2, F2, Cl2).
2.Mattırlar. Metalik parlaklık göstermezler.
3.Erime ve kaynama noktaları düşüktür, öz kütleleri küçüktür
4.Kırılgandırlar. Esnek değillerdir. Tel ve levha haline gelmezler.
5.Elektrik akımını iletmezler( Grafit hariç ). Metallerde elektrik akımı iletilirken, kimyasal değişiklik olmaz. Ancak
ametallerde elektrik iletkenliği sırasında kimyasal değişme olur.
6.Ametaller elementel halde iken moleküler halde bulunurlar. (H2, O2, N2…gibi)
7.İyonlaşma enerjileri ve elektron ilgileri yüksektir.
8.Elektronegatiflikleri yüksektir. Periyodik tabloda sağa ve yukarı doğru gidildikçe elektronegatiflikleri artar.
9.Metallerle tepkimelerinde, elektron alarak -yükle yüklenirler, indirgenirler, yükseltgendirler.
10.Kendi aralarında, kovalent bağlı bileşik oluştururlar. Flor dışındaki ametaller hem pozitif hem de negatif değerlik
alırlar. Flor tüm bileşiklerinde –1 değerlik alırlar.
11.CO, NO, N2O… gibi birkaç bileşik nötr oksit sınıfına girerler.
6.PERİYODİK SİSTEMDE ELEMENTLERİN ASİTLİK BAZLIK ÖZELLİKLERİNİN
DEĞİŞİMİ:
Elementlerin oksijenli bileşiklerine OKSİT denir. ( Na2O, K2O, CaO, ZnO, CO2, SO3, Cl2O7…).
*Metal oksitleri genellikle bazik özelliğe sahiptir ( Na2O, K2O, CaO, BaO )
Metal oksitleri su ile tepkime vererek bazik metal hidroksitlerini oluştururlar.
Na2O(k) + H2O(s)
2 NaOH(suda)
1A ve 2A grubu metal oksitlerinden oluşan metal hidroksitler KUVVETLİ BAZDIR. Suda %100 iyonlaşırlar.
+
NaOH(suda)
Na (suda) + OH (suda)
*Ametal oksitleri genellikle asidik özelliğe sahiptir ( CO2, N2O5, SO2, SO3, Cl2O7 ).
Ametal oksitleri su ile tepkime vererek asitleri oluştururlar.
CO2(g) + H2O(s)
H2CO3(suda)
Ametal oksitleri su ile tepkime verdiklerinde zayıf ya da kuvvetli asitleri oluştururlar.
BeO, Al2O3, Ga2O3, SnO2, PbO2 hem asit hem de baz özelliği gösterir. Bu tür özelliği olan oksitlere
AMFOTER OKSİTLER denir.
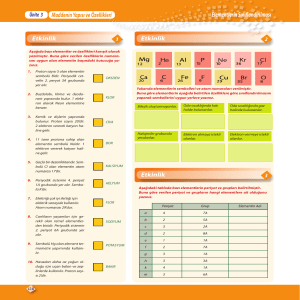
NaO – MgO – Al2O3 – SiO2 – P4O10 – SO3 – Cl2O7
Bazik oksit
Amfoter oksit
( 3.periyot elementlerinin oksitleri )
Asidik oksit
3.periyot elementlerinin oksitleri incelendiğinde, soldan sağa gidildikçe elementlerin metalik karakterlerinin
azaldığı; dolayısıyla, oksitlerin bazik özellikten asitliğe kademeli bir şekilde geçtiği görülmektedir.
Bir grup içinde ise, metalik karakter yukarıdan aşağıya doğru artar; dolayısıyla, element oksitlerinin bazik
karakteri de yukarıdan aşağıya doğru artar.
Aynı periyotta soldan sağa doğru gidildikçe element hidroksitlerinin bazlık gücü azalır. Aynı grupta
yukarıdan aşağıya doğru inildikçe element hidroksitlerinin bazlık gücü artar.