Biyofiziksel Kimya
Molekül Yapısı
• Molekül içinde yer alan her atom,özel bir bağlanma
yeteneği taşır ve başka atomlarla belirli
karakteristiğe sahip kimyasal bağ kurar.Atomların
bağlanma yeteneğini belirlemek için elle tutulur bir
değer (valanz değeri) belirlemek gerekir. Bazıları
başka elementler içinde yer alan yalnızca bir atomla
bağ kurabilir. Bu durumda bağlanma yeteneği ‘bir’
olarak değerlendirilir.Tek değerlidir.
• Başka bir elemenetin atomları iki farklı atomla birer
değerli bağ kurma yeteneğindeyse ‘iki değerli’
olarak kabul edilir. Bu şekilde daha yüksek
değerlere kadar derecelendirilir.Örneğin karbon
atomunun son orbitalinde bulunan eşleşmemiş
elektron çifti nedeni ile ‘iki değerli’ olarak kabul
edilmesi gerekir. Fakat karbon atomunun 4 hidrojen
atomunu bağlama kapasitesi olduğu bilinmektedir.
• Bu yüzden atomların sahip olduğu ‘değer’ yerine ‘oksidasyon
sayısı’ olarak belirlenmiştir.Şu kriterlere göre değerlendirilir;
• 1-Serbest elementlerin oksidasyon sayısı H2,O2,Fe,P4,Na
‘sıfır’dır.
• 2-Flor oksidasyon sayısı yerine ,tek bir bağlantı kurabilir,
değeri -1’dir. Alkali metaller oksidasyon sayısı yerine tek bir
değer taşırlar ve+1, toprak alkali metaller ise +2 değerlidir.
• 3- Metallerin taşıdığı Hidrojen atomunun oksidasyon sayısı -1
veya +1
• 4-Oksijen atomunun genel olarak değeri ise -2’dir.
• 5-Elektronötral olan moleküllerde formül değeri sıfır iken
iyonlaşan moleküllerde değer, doğrudan yüklü iyon değeri ile
belirtilir.
• Biyolojik yapılarda yer alan kimyasal bağların
yapısını tanımak adına, ilk olarak atom yapılarını
tanımak gerekir.
• İkinci adımda bağların çeşitliliği gelir.
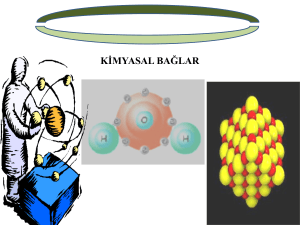
Kimyasal Bağlar
• Organizma içinde geçen kimyasal reaksiyonların
hepsinde, kovalent olan ve kovalent olmayan bağlar
söz konusudur.
• Kovalent bağların sahip olduğu enerji oldukça
yüksektir.
• Sonuçta, birbirleri ile temas kuran farklı atomlar
arasında kuvvetli bir yapı oluşur.
• Başka bir ifade ile kovalent bağlar,iç molekül yapısı
açısından stabiliteyi sağlar ve karakteristik yapıları
meydana getirir.
• Elektronların yeniden düzenlenmesi
sırasında kimyasal bağlar meydana gelir.
•
•
•
•
•
•
İyonik (elektrovalent) bağlar
Kovalent bağlar
Ko-ordinat (dative kovalent) bağlar
Hidrojen bağları
Metalik bağlar
Van der Waals kuvvetleri
• iki veya daha fazla atomun kimyasal bağlarla
birbirlerine bağlanmaları sonucunda
moleküller ortaya çıkarlar.
İyonik bağlar
Atomlar, elektron kazanarak ya da kaybederek
iyon adı verilen yüklü parçacıkları oluştururlar.
katyon
anyon
Bir iyonik bağ, zıt yüklü iyonlar arasındaki çekim
kuvvetidir.
Kovalent bağlar
Elektronegatiflikleri aynı ya da yakın olan iki ya da
daha fazla atom, tam bir elektron aktarımı olmaksızın
elektronları paylaşarak soygaz yapısına ulaşırlar.
Böylece atomlar arasında kovalent bağlar oluşur.
Bir organik molekül, moleküldeki kovalent bağlara
katılan atomların elektronegatifliklerine göre polar
veya nonpolar (apolar) olabilir.
• Stabil kimyasal bağ oluşturabilmek için sadece bir
elektron çifti ortaklığı değil, bazen iki hatta üç
elektron çiftinin ortaklığı gerekebilir.
• Bu durumda ikili ve üçlü bağlar ortaya çıkar.
• H-C=C-H
H-CΞC-H
Oktet kuralına göre, biyokimyada sık rastlayacağımız
atomlardan hidrojen tek, oksijen iki, azot üç, karbon ise dört
kovalent bağ yapabilmektedir.
Su molekülleri, dipol karakterde oluşları nedeniyle hem katı
halde hem de sıvı halde iken, birbirlerine hidrojen köprüsü
bağlarla bağlanma yeteneğindedirler
Hidrofilik (suyu seven) maddeler suda çözünürler. Bunlardan iyonik
olanlar yüklerine göre suyun pozitif veya negatif ucuyla etkileşir, polar
olanlar su ile hidrojen bağları yaparlar.
Non-polar bağların çoğunlukta olduğu maddeler hidrofobik (suyu
sevmeyen) maddelerdir, suda çözünmezler.
Oksijen Atomunun Yaşama dair
Önemi
• Oksijen atomu, çekirdekte sahip olduğu sekiz adet
proton nedeni ile elektron dağılımı asimetriktir. Yani
elektronlar daha belirgin olarak oksijen atomu
etrafındadır. Ortaya çıkan yapıya Dipol denir. Bu
durumda ortaya çıkan kutuplaşmada oksijen atomu
negatif, hidrojen atomları pozitif yüklü gibi hareket
ederler.
• Oksijen atomu 8 elektron taşır. İlk orbitalde 2, son
orbitalde 6 elektron bulundurur. Kararlı hale
gelebilmesi için son orbitalde 2 elektrona daha
ihtiyaç duyar. İşte bu iki elektronları da, birer
elektronu bulunan iki hidrojen atomundan karşılar.
Zayıf Kimyasal Bağların Etkisi
• Kovalent olmayan bağlardan ‘Hidrojen bağları’ nın
kurduğu köprüler ve polarite özelliği molekül içi ve
moleküller arası kimyasal bağları oluştururlar.
Özellikle proteinlerin tersiyer yapılarının
oluşumunda önemli rol oynarlar
• Hidrojen köprülerine sadece hidrojen atomları
katılır. Hidrojen atomları aynı zamanda N2, O2, F
gibi negatif karakterli atomlarla bağ
oluştururlar.Hidrojen atomunun oluşturduğu
kimyasal bağın kuvveti ortaklık kurduğu atomun
stabilitesine (kararlılığına) bağlıdır.
• Biyolojik bağlarda en önemli olan karbon atomu,
hidrojen köprülerinde yer almaz.Hidrojen atomları,
kovalent bağ oluşturmazsa sahip oldukları enerji
çok düşük düzeydedir
• Hidrojen köprülerinin enejisi 2-10 kcal/mol
ölçülmüştür.Fakat kovalent olarak bağlandığında bu
enerji 100 kcal/mol dolayındadır. Hidrojen
köprülerinin en fazla görüldüğü moleküller
proteinler ve nükleik asitlerdir.Sahip oldukları enerji
düşüktür fakat fazla sayıda oldukları için,
oluşturdukları yapının stabilitesini korurlar.
Metabolizmada Suyun Substrat ve Ürün olarak
Önemi
• Enzimler tarafından katalizlenen reaksiyonların
tümü sulu ortamda gerçekleşir. Hatta suda
çözünmeyen trigliseridleri (depo yağlar) parçalayan
lipaz enzimi sulu ortamda etkir.
• Hidrolaz ve Hidrataz enzimleri, suyun doğrudan
katılığı reaksiyonları katalizler.
• Hidrolazlar, kimyasal bağları suyun sayesinde
parçalar (Disakkaridaz,peptidaz gibi).
• Hidratazlar ise Çift bağ karbon atomunun
bulunduğu bir molekülde, bu bağa suyun girmesini
sağlar. Örneğin; çift bağlı bir karbon atomunun
bulunduğu molekülde, bu bağı parçalamadan
hidroksil (OH) grubunun bağlanmasını sağlar.
• Suyun son ürün olarak ortaya çıktığı en önemli
reaksiyonlar solunum zincirinde gözlenir. Hidrojen
ve oksijen atomlarından kuvvetli bir egzergonik
reaksiyon sonucu su meydana gelir. İnsanda bir gün
boyunca devam eden solunum zinciri sonucu 300
ml metabolik su meydana gelir. Bu miktar günlük
ihtiyacın % 20’sini karşılar.
Ozmotik ve Kolliodal Ozmotik Basıncın Biyolojik
Önemi
• Bir çözücü içinde çözünmüş maddenin, tanecik
sayısına bağlı olarak meydana getirdiği basınca
ozmotik basınç denir.
• Böyle bir ozmotik basıncın meydana gelmesi için
gerekli kural, birbirinden farklı konsantrasyonlara
sahip iki değişik çözeltinin bir semipermeabl (yarı
geçirgen) zar aracılığı ile ayrılmış olmasıdır. Bu
çözeltilerin içerdikleri moleküllerin yarıgeçirgen zar
üzerine uyguladıkları ozmotik basınç, sahip
oldukları çözünmüş tanecik sayısı ve ısı ile doğru
orantılı olarak değişir.
• Bir çözelti içeren kap, yarı geçirgen membranla
kapatılıp su içine daldırıldığında, su membrandan
geçer. Bu geçiş, zarın bir tarafındaki ozmotik basınç,
diğer taraftaki hidrostatik basınca eşit oluncaya
kadar devam eder. Fakat organizmada hücre zarları
bazı durumlarda suyun yanında, ozmotik etkili
tanecikleri de geçirmektedir. Oluşan ozmotik
basıncın kuvveti doğrudan membranın
geçirgenliğine bağlıdır
• Özetlersek, ozmotik basınç çözülmüş tanecik
sayısına bağlı olarak değişir. Suda ayrışmayan yani
’Dissosiye’ olmayan maddelerde ozmotik basınç
molariteye eşittir.
• mmol/l = mosmol/l ‘dir.
• Çözeltilerin osmoloriteleri hesaplanırken, asıl sorun
farklı tuzlardan oluşan çözeltilerin farklı
dissosiasyon kat sayısına sahip olmalarıdır.
• Pratikte, çözünen tuzların tam olarak dissosiye
olduğu ve her bir iyonun tek başına ozmotik
aktivitesi olduğu kabul edilmektedir.
İzotonik Çözeltinin Canlıdaki
Anlamı
• 0,3 molar çözelti İzotonik çözelti olarak kabul edilir.
Bu yoğunlukta olan bütün çözeltiler, canli
organizmada membralara zarar vermez. Yani
fizyolojik sıvıların osmolarite değeridir.
• Glikoz molekülü iyonlara ayrışmadığı için 0,3 molar
çözeltisi 0,3 osmolara denktir. Fakat NaCl çözeltisi,
Na ve Cl olmak üzere iki iyona ayrışır. Bu nedenle
osmolaritesi 0,3x2= 0,6 osmolardır. Çünkü ozmotik
basınç hesaplanmasında tanecik sayısı esas alınır.
Buna göre 0,3 molar NaSO4 çözeltisi 0,3x3 = 0,9
osmolar olarak bulunur.
Kolloid Ozmotik Basınç
• Kolloid-ozmotik basınç,ozmotik basıncın özel bir
şeklidir. Bu basıncı oluşturan moleküller yüksek
ağırlıkta olan makro moleküllerdir. İntravasal
boşlukta protein konsantrasyonu, interstisyel
boşluktan daha yüksektir. Damar endotel hücreleri,
proteinleri geçirmez, fakat düşük molekül ağırlıklı
maddeleri geçirir. Bu sayede kısa zamanda
intravasal ve inerstisyel bölgelerin basınç dengesi
sağlanır. Oldukça önemli oranda basınç yaratan kan
proteinleri, yine damar içindeki hidrostatik basınç
tarafından dengelenir
• Kan plazmasında, herhangi bir hastalıkta kolloid
ozmotik basınç azalırsa, kan sıvısı dokular arasına
sızarak ödem oluşturur.
• Kan damarlarında kolloid ozmotik basınç oluşturan
en önemli protein albumindir. Moleküler ağırlığı
düşük olmasına rağmen en yüksek miktardaki
proteindir.
Diffüzyon ve Aktif Transport
• Biomembranlar tipik semipermeabl özelliktedir ve
iki sulu fazı birbirinden ayırırlar. Bu sayede sıvı
fazlarda çözünmüş maddelerin
konsantrasyonlarının sabit kalmasını sağlarlar.
Gerektiğinde membranın bir yanından öteki tarafa
madde geçişini sağlayan transport mekanizmaları
vardır.
• Bunlardan biri diffüzyon olayıdır:
• Membranın iki tarafında bulunan farklı
konsantrasyondaki iki maddeden düşük molekül
ağırlıklı olan, konsantrasyon farkının yarattığı
kuvvetle diğer tarafa geçer. Moleküler hareket az
yoğundan, çok yoğuna doğru gerçekleşir. Bu sayede
‘Elektrokimyasal Konsantrasyon Farkı’ ndan söz
edilir. Biyolojik membranlarda potansiyel enerji
farkı yaratan bu enerjinin değeri -60 mVolttur. Bu
enerji sayesinde sinirsel implus iletiminde önemli
rol oynar.
Konu ile İlgili Problemler ve
Çözümleri
• Soru 1.
• 500 ml suda çözünen 5g NaCl ve 10g Glikozun
ozmoloritesi nedir?
• Glikozun MA=180g, NaCl=58.45g
• {5/58.45x2+10/180}x2=0.42 osm/L
• 50g Glikoz izotonik çözelti oluşturabilmesi için kaç
ml suda çözünmelidir?
• 180x0.3=54g/L çözünürse izotonik olur
• 54g
1000ml
• 20g
?ml
• -------------------------• 20x1000/54= 370 ml suda çözünmelidir
• 50g NaCl ve 15g glikoz kaç ml suda çözünürse
izotonik çözelti olur?
• 180x0.3=54g glikoz ve
• 15x1000/54=277.7ml
• 58.45x0.3/2= 8.76 NaCl
• 50x1000/8.76=5707.7ml
Canlı Hücrede Aktif Transport
• Biyolojik membranlarda molekül ağırlığı 120’ye
kadar olan hidrofilik (suyu seven) moleküller örneğin; gliserin,üre,laktik asit gibi- diffüzyon yolu
ile membranı geçerler. Fakat glikoz gibi moleküller
diffüzyon yolu ile geçiş yapamazlar.
• Büyük moleküllerin hücre içine taşınması, enerji
kullanılan aktif transport sistemleri ile sağlanır.
• Hücre zarı dış yüzeyinde bulunan taşıyıcı moleküller,
taşıyacakları makro molekülü geri dönüşlü olmak
üzere (reversible) kendine bağlar.
• Oluşan Taşıyıcı+ Substrat kompleksi sitoplazmaya
ulaştığında serbest bırakılır. Tekrar membran
yüzeyine dönen transport proteini yeni maddelerin
hücre içine taşınması için tekrar tekrar kullanılır.
pH Değerleri
• pH değeri (H+) hidrojen iyonu konsantrasyonunun
negatif logaritmasıdır.
• pH= -log[H+] olarak yazılır.
• pH değerinin anlamını kavramak için önce zayıf ve
kuvvetli asitler arasındaki bağlantıyı anlamak
gerekir
• Bir asitin ‘Kuvvetli’ olduğunu belirtmek için su
içinde hidrojen iyonlarını serbest bırakması gerekir.
Yani sulu ortamda tamamen dissosiye olmalıdır.
Ortamda ne kadar yüksek oranda hidrojen iyonu
bulunursa asitlik o oranda artar.
• Örneğin 0,1 N HCl çözeltisinde 0,1 mol/l H+ iyonu
konsantrasyonu vardır. pH= 1 ‘dir. Çünkü pH 10
üzeri –
1 = 1 olarak ifade edilir.
• Aynı sulu ortamda bulunan kuvvetli asit,
zayıf asidin tuzunu dissosiasyona zorlar ve
kendisi tuz oluşturma eğilimindedir.
• Örneğin; Na- asetat ile aynı ortama
bulunan HCl asit, NaCl oluşturma
eğiliminedir. Aynı zamanda daha zayıf asit
olan asetik asit ortaya çıkar. Bu olay teorik
olarak tamamen NaCl meydana gelene
kadar devam eder.
• Na(CH3-COO)+HCl→NaCl+CH3COOH
• Zayıf asitlerin tuzları, kuvvetli asitle aynı ortamda
bulunduğunda, tampon özelliği gösterirler. Biyolojik
ortamlara H+ iyonu konsantrasyonunu göreceli
olarak sabit tutmaya yararlar.
• Kanın fizyolojik pH değeri 7,36’dır. Eğer kan pH’sı
7,6 nın üzerine çıkar veya 6,9 un altına inerse
hastalık belirtileri meydana gelir
Biyolojik Tampon Sistemler
• Kan plazması ve ekstrasellüler sıvının pH= 7,36
değerinde sabit kalmasını sağlayan tampon
sistemler bulunur.
• Bu sistemlerin etkinlik değeri aşağıdadır
• Bikarbonat Sistemi [HCO3]/ [H2 CO3]
25
mmol/l %52 oranında etkili
• Hemoglobin Sistemi [Hb]/ [HbO 2]
15
mmol/l %31 oranında etkili
• Proteinat Sistemi [Proteinat -] / [Proteinat +] 7
mmol/l %15 oranında etkili
• Fosfat Sistemi
[HPO4-] / [H2PO4 +]
1
mmol/l %2 oranında etkili
• Klinik olarak [HCO3]/ [H2 CO3] değerinin
belirlenmesi asit-baz dengesi hakkına önemli bilgi
verir. Çünkü karbonik asit yapısında uçucu gaz olan
karbondioksit içerir ve gerektiği zaman
akciğerlerden atılarak kanın pH değeri kontrol
altında tutulur. Kanda fazla olan karbonik asit
Karbonik Asit Dehidraz enzimi aracılığı ile su ve
karbondioksite parçalanır.
• H2CO3↔H2O+CO2
• Solunum esnasında oksi hemoglobin oluşur ve asit
karakteri gösterir. Dokulara giderek oksijeni bırakır
ve daha zayıf karakterde redüklenmiş hemoglobine
dönüşür. Bu haliyle dokularda metabolizma sonucu
ortaya çıkan H+ iyonunu kendine bağlayarak pH
düşmesini, dolaysıyla asidoz tehlikesini engeller.
• Serum proteinleri ve hemoglobin yapısında bulunan
amino asitlerin amino grupları ve karboksil grupları
hidrojen iyonu alıp-verebilirler. Ortamda fazla
miktarda bulunan hidrojen iyonları amino grubuna
bağlanabilir. Eğer ortamda hidrojen iyon sayısı
yetersizse, amino asidin karbosil grubu ortama
hidrojen iyonu salarak pH değerini etkiler
• Fosfat tampon sistemi, kan plazmasındaki organik
fosfatın hirodjen iyonu bağlaması sayesinde çalışır.
Eğer asit ortam söz konusu ise, fazla hidrojen
iyonları dihidrojen fosfat şeklinde bağlanır.
Asit-Baz Dengesinin Bozulduğu Durumlar
• 1)Metabolik Asidoz:Organik asitlerin sentezinde
veya organizmaya girişinde bir artış
görülmesi.Örneğin beta hidroksi butirik asit,asetik
asit veya laktik asidin artması gibi.
• Kronik böbrek hastalıklarında böbrek yoluyla yeteri
kadar hidrojen iyonu uzaklaştırılamaması
durumunda
• Gastrointestinal kanalda bikarbonat içeriinin
kaybedilmesi durumunda,örneğin kuvvetli ishal
durumunda
• 2)Metabolik Alkoloz
• Kuvvetli kusma nedeni ile H iyonunu kaybı
• Herhangi bir nedenle büyük boyutta potasyum
kaybı (hücre içine K yerine H girdiği için kandaki H
düzeyi düşer)
• Tedavi amaçlı olarak fazla miktarda HCO3
(bikarbonat) verilmesi sebepler arasında sayılabilir.
• 3)Respiratorik Asidoz
• Alveolar hipoventilasyon (kom,ani dolaşım şoku)
• Solunum yetersizliğinin kronik hal alması, kronik
bronşit,akciğer amfizemi,astma bronşial
• Solunum merkezinin anestezik ilaçla baskı altına
alınması
• 4)Respiratorik alkoloz
• Alveolar hiperventilasyon,ateş yükselmesi
• Dekompanze karaciğer sirozu,nefrotik sendrom,
• Akciğer kapillarında oksijen diffüzyon yetersizliği
• 5)Eksperimentel (Deneysel) Asidoz
• Deneysel olarak alkali yetersizliği NH4Cl ve CaCl2
verilerek yaratılır.NH4 iyonu karaciğerde kısa
zamanda üreye çevrilir.Ca ise bağırsakta gaita ile
uzaklaştırılır.Fakat klorit iyonları uzaklaştırılmak için
NaHCO3 kullanılması gerekir.Bu şekilde organizma
sürekli olarak baz kaybeder ve asidoz gelişir.