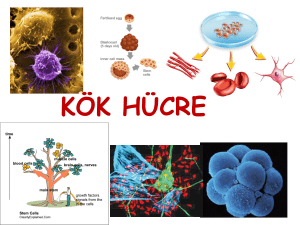
Şahin Aral - Erciyes Üniversitesi Eczacılık Fakültesi
advertisement

T.C ERCİYES ÜNİVERSİTESİ ECZACILIK FAKÜLTESİ KORDON KANININ LÖSEMİ TEDAVİSİNDE KULLANIMI Hazırlayan Şahin ARAL Danışman Yrd. Doç. Dr. Nalan İMAMOĞLU Eczacılık Fakültesi Bitirme Ödevi Haziran 2010 KAYSERİ T.C ERCİYES ÜNİVERSİTESİ ECZACILIK FAKÜLTESİ KORDON KANININ LÖSEMİ TEDAVİSİNDE KULLANIMI Hazırlayan Şahin ARAL Danışman Yrd. Doç. Dr. Nalan İMAMOĞLU Eczacılık Fakültesi Bitirme Ödevi Haziran 2010 KAYSERİ II Yrd. Doç. Dr. Nalan İMAMOĞLU danışmanlığında Şahin ARAL tarafından hazırlanan “Kordon kanının lösemi tedavisinde kullanımı” konulu bu çalışma, jürimiz tarafından Erciyes Üniversitesi Eczacılık Fakültesi’nde Bitirme Ödevi olarak kabul edilmiştir. …./…./2010 JÜRİ İmza Yrd. Doç. Dr. Nalan İMAMOĞLU (Danışman) Prof. Dr. Müberra KOŞAR Yrd. Doç. Dr. M. Betül AYCAN ONAY: Bu bitirme ödevinin kabulü Fakülte Yönetim Kurulunun ……..…………….. tarih ve ………………… sayılı kararı ile onaylanmıştır. …./…./…… Fakülte Dekanı Prof. Dr. Müberra KOŞAR III TEŞEKKÜR “Kordon Kanı ve Lösemi Tedavisinde Kullanımı” konulu bitirme ödevi çalışmasının seçiminde, yürütülmesinde, sonuçlandırılmasında ve sonuçlarının değerlendirilmesinde maddi ve manevi destek ve yardımlarını esirgemeyen değerli hocam Sayın Yrd. Doç. Dr. Nalan İMAMOĞLU’NA, Tez çalışmam boyunca bana verdiği manevi destek, göstermiş olduğu sabır ve anlayıştan dolayı nişanlım Servet UYKUR’a, Bu çalışmam sırasında maddi ve manevi her türlü desteği benden esirgemeyen, her durumda benim yanımda olan başta annem olmak üzere tüm aileme teşekkür ederim. IV KORDON KANININ LÖSEMİ TEDAVİSİNDE KULLANIMI ÖZET Kök hücrelerin en temel özellikleri sürekli kendilerini yenilemeleriyle beraber birçok hücre ve doku tiplerine farklılaşabilme kapasiteleridir. Kordon kanı insan hematopoetik kök hücre transplantasyonu için kemik iliğine alternatif bir kaynaktır. Daha çok çocuklarda, aynı zamanda yetişkinlerde otolog ya da allojenik nakil için HLA tipi uygun kemik iliği bulunamadığında tercih edilir. Kordon kanının bu şekilde kullanımı, otolog ya da allojenik nakiller için kordon kanı bankalarının kurulmasıyla sonuçlanmıştır. Bu çalışmada; kök hücre ve farklılaşması hakkında bilgi edinme, kordon kanı kök hücresi ve lösemi tedavisinde kullanımı, kök hücre transplantasyonu için etik sorunlar ve yasal boyutu incelenmiştir. Her ne kadar günümüzdeki gelişmeler, kordon kanı kök hücresinin kullanımını yaygın hale getirmese de, ilerleyen zamanlarda kök hücre transplantasyonun önemi daha da artacaktır. ANAHTAR KELİMELER: Kök hücre, kordon kanı, kök hücre farklılaşması, lösemi. V USAGE OF CORD BLOOD OF LEUKEMIA TREATMENT ABSTRACT The most basic characteristics of stem cell are the capacity to transform into many different types of cells and tissues and continuously renovating itself. Cord blood is an alternative source which can be used in place of bone marrow (medulla osslum) in human hematopoietic stem cell transplantation. It is mostly preferred for children and at the same time for adults when suitable HLA type bone marrow couldn’t be found for autologous or allogenic transplantations. The usage of cord blood for this manner ended up with the foundation of cord blood banks for autologous or allogenic transplantations. In this study; getting information about stem cell and its transformation, cord blood stem cell and its use in leucemia treatment, ethical problems for stem cell transplantation and its legal extent are examined. Although contemporary progress couldn’t make the use of cord blood widespread, the importance of stem cell transplantation will increase in coming days. KEY WORDS: Stem cells, cord blood, stem cell transformation, leucemia. VI İÇİNDEKİLER İÇ KAPAK………………………………………………………………………………………I KABUL VE ONAY SAYFASI .................................................................................................. II TEŞEKKÜR .............................................................................................................................. III ÖZET ......................................................................................................................................... IV ABSTRACT ................................................................................................................................. V İÇİNDEKİLER ......................................................................................................................... VI KISALTMALAR ................................................................................................................... VIII TABLO, ŞEKİL VE RESİM LİSTESİ ..................................................................................... X 1. GİRİŞ VE AMAÇ .................................................................................................................. 1 2. GENEL BİLGİLER ............................................................................................................... 3 2.1. KÖK HÜCRE TARİHÇESİ VE TANIMI ................................................................ 3 2.2. KÖK HÜCRELERİN BULUNDUĞU YERLER VE KÖK HÜCRE TİPLERİ ... 5 2.2.1. Farklılaşabilme Yeteneklerine Göre Kök Hücreler ......................................... 5 2.2.2. Bulunduğu Yerlere Ve Elde Edildiği Kaynaklara Göre Kök Hücreler ......... 7 2.3. KORDON KANI ....................................................................................................... 10 2.3.1. Kordon Kanının Elde Edilişi ............................................................................ 12 2.3.2. Kordon Kanının Saklanması ............................................................................ 15 2.3.3. Kordon Kanı Kök Hücresi ............................................................................... 16 2.3.5. Birden Fazla Kordon Kanının Birlikte Kullanımı ......................................... 17 2.4. KORDON KANI KÖK HÜCRESİNİN FARKLILAŞMASI ................................ 17 2.4.1. Hematopoietik Kök Hücrelerin Genetik Profilleri......................................... 17 2.4.2. Kök Hücre Proliferasyon ve Farklılaşmasında Rol Oynayan Genler .......... 18 2.4.3. Kök Hücrelerinde Bölünme Şekilleri .............................................................. 19 2.5. KORDON KANININ HASTALIK TEDAVİSİNDE KULLANIMI .................... 21 2.5.1. Kordon Kanının Doku Rejenerasyonunda Kullanılması .............................. 21 2.5.2. Tedavisinde Kordon Kanı Kullanılan Hastalıklar ......................................... 23 VII 2.6. KAN KANSERİ (LÖSEMİ) ..................................................................................... 26 2.6.1. Akut Lösemiler .................................................................................................. 26 2.6.2. Kronik Lösemiler .............................................................................................. 27 2.6.3. Lösemilerde Tedavi ........................................................................................... 28 2.7. KÖK HÜCRE ÇALIŞMALARINDA ETİK SORUNLAR VE YASAL BOYUT 29 2.7.1. Kök Hücre Araştırmalarına İlişkin Etik Sorunlar ........................................ 29 2.7.2. Kök Hücre Araştırmalarında Yasal Boyut ..................................................... 32 3. TARTIŞMA VE SONUÇ .................................................................................................... 36 4. KAYNAKLAR ..................................................................................................................... 44 ÖZGEÇMİŞ VIII KISALTMALAR AL : Akut Lösemi ALL : Akut Lenfoid Lösemi AML : Akut Myeloid Lösemi CFU : Koloni Oluşturan Birim EGE : Avrupa Etik Grubu GVHH : Graft Versus Host Hastalığı HKHT : Hematopoetik Kök Hücre Transplantasyonu HKH : Hematopoetik Kök Hücre HLA : İnsan Lökosit Antijenleri HPH : Hematopoietik Progenitör Hücre INF : İnterferon IVF : İn-Vitro Fertilizasyon JMML : Juvenil Miyelomonositik Lösemi KH : Kök Hücre KİT : Kemik İliği Transplantasyonu KKGH : Konağa Karşı Graft Hastalığı KKKHT : Kordon Kanı Kök Hücre Transplantasyonu KKT : Kordon Kanı Transplantasyou KL : Kronik Lösemi KLL : Kronik Lenfoid Lösemi KML : Kronik Myeloid Lösemi LTC-IC : Uzun Dönem Kemik İliği Kültürünü Başlatan Hücreler PH : Progenitör Hücre PCR : Polimeraz Zincirleme Tepkimesi SCF : Stem Cell Factory (Kök Hücre Faktörü) IX TGF : Dönüştürme Büyüme Faktörü T-KİT : T-hücre deplesyonu sonrası kemik iliği transplantasyonu X TABLO, ŞEKİL VE RESİM LİSTESİ Sayfa No Tablo 2.1. Toplanan kordon kanı volümü ve hücre sayısına etki eden obstetrik faktörler .........14 Tablo 2.2. Akraba dışı kök hücre kaynağı olarak kemik iliği ile kordon kanının karşılaştırılması. .......................................................................................................16 Şekil 2.1. Çeşitli kök hücre tipleri ................................................................................................ 7 Şekil 2.2. Kök Hücre Kaynakları ................................................................................................. 8 Şekil 2.3. Kordon Kanının Hazırlanması ....................................................................................13 Resim 2.1. Kordon Kanı Alınması ............................................................................................ 12 Resim 2.2. Kordon Kanının Saklanması .....................................................................................15 1. GİRİŞ VE AMAÇ Yakın zamana kadar doğumdan sonra kullanılmayıp atılan kordon kanı, son zamanlarda hematopoetik kök hücre (HKH) kaynağı olarak transplantasyon amaçlı kullanılabilir hale gelmiştir. Ayrıca, içerdiği diğer kök hücreler ile değişik amaçlı tedavilerde de kullanılmaya başlamıştır. Hematopoetik Kök Hücre Transplantasyonu (HKHT), günümüzde özellikle lösemi ve lenfoma gibi malign hastalıklar ile immün yetmezlikler ve talasemi gibi malign olmayan çeşitli hastalıkların tedavisinde sıklıkla ve başarı ile uygulanan bir tedavi yöntemidir (1, 2). HKHT için HKH’ler çoğunlukla “Kemik İliği” veya “Periferik Kan”dan elde edilirken “Kordon Kanı” üçüncü bir kök hücre kaynağını oluşturmaktadır. Allojenik transplantasyonlar için en uygun donör, doku tipi tam uygun olan kardeş veya aile içi bireydir. Buna karşın tam uygun bir aile içi donör bulunma olasılığı sadece % 2530’dur. Bu nedenle allojenik HKHT gereken durumların çoğunda, aile dışı gönüllü donör adaylarının arasından doku tipi uygun olan bir vericinin bulunması gerekmektedir. Bu amaçla “kemik iliği donör kayıt sistemi” geliştirilmiştir. Ancak bu kayıt sistemi ile ilgili HKHT işlemleri, zaman alıcı, masraflı ve kök hücre toplanması da donör için ağrı vericidir. Bu nedenlerle, allojenik transplantasyonlarda kök hücre kaynağı olarak kemik iliği veya periferik kanın kullanılmasına alternatif olarak kordon kanının kullanılması gündeme gelmiştir. Kordon kanının doğumdan sonra atılması yerine HKHT amacı ile kullanılabileceği belirtilmiş ve bu alandaki çalışmalar yoğunlaşmıştır. 2 Çalışmamızda kök hücrelerin özellikleri, hangi şekillerde diğer organ ve dokulara farklılaştığı ve bu farklılaşmada rol alan etmenler araştırılmıştır. Ayrıca, kök hücre kaynaklarına bir alternatif olarak kordon kanının lösemi tedavisinde kullanımı ve bu alanda son yıllarda yapılan çalışmalar incelenmiştir. 2. GENEL BİLGİLER 2.1. KÖK HÜCRE TARİHÇESİ VE TANIMI Tarih boyunca insanoğlu kök hücre ve transplantasyon düşüncesi üzerine yoğunlaşmıştır. Mitolojide, ateşi Olympos dağındaki, tanrılardan çalarak insanlığa hediye eden ve bunun üzerine Zeus tarafından cezalandırılan Prometheus’un hikâyesi de buna bir örnektir. Zeus tarafından Kafkas (Kaf) dağında bir kayaya bağlanan ve karaciğeri her gün bir kartal tarafından yenilmesi şeklinde bir cezaya çarptırılan Prometheus’un karaciğeri her gün kendisini yenilemiştir. Bu hikâyede anlatılan karaciğer hücrelerinin rejenerasyon yeteneği kök hücre kavramını ortaya atan ilk hikâyedir. (3, 4). Bunları takibende; — 1959-IVF yöntemi ile ilk hayvan (tavşan) üretildi. — 1968-Edwards ve Bavister ilk insan ovumunu in vitro olarak fertilize ettiler. —1978-İlk IVF bebek İngiltere’de doğdu. — 1981-Evans ve Kaufman fare embriyonik kök hücrelerini elde ettiler. — 1996-Rhesus maymunlarının embriyonik kök hücreleri elde edildi. — 1998-Thomson ve arkadaşları ilk insan embriyonik kök hücresini elde ettiler. —2000-İnsan embriyonik kök hücresinin pluripotent olduğu anlaşıldı (5). 4 __ 2001: Amerika Birleşik Devletleri Başkanı Bush, kök hücre çalışmalarına kısıtlı bir bütçe ayrılmasına ve sadece o güne kadar tüp bebek yöntemlerinden artan embriyolarla çalışma yapılmasına izin verdi (6). — 2004: Güney Koreli bilim adamları 30 insan embriyosunu klonlamış ve blastosist aşamasına kadar getirmiş, ancak bu embriyolardan sadece bir tanesinden kök hücre elde edebilmişlerdir (6). Ülkemizde ise, kök hücre tedavisi üzerine ilk çalışmalar 1950-1960’lı yıllarda, Aygün ve arkadaşları tarafından yapılmıştır. Aygün ve arkadaşları, hayvanlarda fetal ve kordon kanı greftleri ile çeşitli hastalıkların tedavisi konusunda araştırmalar yapmıştır. Yine aynı grup tarafından 1967 yılında embriyonel karsinoma hücrelerinin kültür ortamında çoğaltılması bu alandaki ilk önemli gelişmedir. Bu hücrelerin farklılaşması; embriyoid cisimcikler olarak adlandırılan embriyo benzeri oluşumların meydana gelmesi ile sonuçlanmıştır (4). Bir canlının yaşamı ile ilgili bütün bilgiler hücrelerindeki DNA moleküllerinde şifrelenmiştir. Ancak bu şifreli bilgilerin kullanılabilir hale gelmesi halen tam olarak açıklanamamıştır. Zigotun şekillenmesinden başlayarak trilyonlarca hücreye ulaşan ve aynı zamanda farklılaşarak yeni özellikler kazanan hücrelerin bölünmelerindeki programlanma dikkat çekmektedir (3, 4). Vücudumuzda yaşlanan ve ölen hücrelerin yerlerine yenileri oluşturulmaktadır. Bununla birlikte, yabancı antijenlerle savaşmak için vücut özel savunma hücreleri üretmektedir. Gözümüzdeki hücreler görme, pankreastaki hücreler salgı, akciğerdeki hücreler solunum için farklılaşmaktadır. Canlı vücudundaki bütün hücrelerin ilk ana hücresine “kök hücre” adı verilir. Bu hücrelerde farklı hücrelere dönüşebilirler (3). Kök hücreleri, kendini yenileme özelliğine sahip, özelleşmiş hücrelere farklılaşabilen, vücut içinde veya laboratuar ortamında uygun şartlar sağlandığında birçok farklı hücre tipine dönüşebilen farklılaşmamış hücrelerdir (7). Kök hücreleri diğer hücrelerden ayıran iki özellik bulunmaktadır. Bunlar; 1) Bölünüp, çoğalabilme (proliferasyon) ve kendini yenileyebilme (rejenerasyon): Tekli hücrelerden elden edilen embriyonik kök hücrelerinin 300-400 döngü boyunca çoğalabildikleri gösterilmiştir. Sonuçta meydana gelen hücrelerin özelleşmediği ve bu nedenle de bu hücrelerin uzun dönemde kendilerini yenileyebilme yeteneğine sahip 5 oldukları bildirilmiştir. Hücrelerin bölünme kapasitelerini kromozomların uç kısmında bulunan ve “telomer” denilen DNA zincirleri belirler. Telomerler ne kadar uzunsa hücreler o kadar çok bölünebilirler. Telomerlerin uzun kalmasını sağlayan “telomeraz enzimi ” dir. Bir hücrede telomeraz enzimi ne kadar aktif ise telomer uzunluğu da o kadar korunabilir. Kök hücreler çok yoğun telomeraz enzim aktivitesinden dolayı çok sayıda bölünebilirler (5). 2) Farklılaşabilme: İnsan ve memeli hayvanlardaki kök hücreleri birden fazla hücre tipine farklılaşabilirler (8). 2.2. KÖK HÜCRELERİN BULUNDUĞU YERLER VE KÖK HÜCRE TİPLERİ Kök hücreler farklılaşabilme yeteneklerine, bulunduğu yerler ve elde edildikleri kaynaklara göre sınıflandırılırlar. 2.2.1. Farklılaşabilme Yeteneklerine Göre Kök Hücreler 1. Totipotent Bu hücreler, tam bir bireyi oluşturabilecek kapasiteye sahip olup, sınırsız farklılaşma yeteneğine sahiptirler. Bu hücreler embriyo, embriyo sonrası tüm doku ve organlar ile embriyo dışı membranların ve organların kaynağını oluşturan kök hücre türleri olarak tanımlanmaktadırlar (8, 9). Bu terim embriyonun beşinci gününe kadarki tüm blastomerler için geçerlidir (erken embriyonik dönem). Döllenmiş yumurta tek bir hücre olmakla birlikte, vücut sistemlerini meydana getirecek bütün hücreler bu tek hücreden çoğalırlar. Bu döllenmiş yumurta hücresine totipotent hücre denir. Totipotent kelime anlamı olarak, “her şey olabilme potansiyeline sahip” anlamına gelmektedir. Döllenmeden birkaç saat sonra bu totipotent hücre iki eşit parçaya bölünür. Bu iki totipotent hücreden birisi alınıp uterusa implante edilirse, canlı gelişimi devam eder. Genetik olarak aynı olan tek yumurta ikizleri de bu şekilde oluşmaktadır. Bu olayda, iki totipotent hücre bilinmeyen sebeplerle birbirinden ayrılıp, her ikisi de tek başına gelişebilmektedir (3, 5, 8). 6 2. Pluripotent Embriyonik gelişimde üç germ tabakasından köken alan ve yaklaşık iki yüz çeşit hücreye dönüşebilen hücrelerdir. Pluripotent hücreler, organizmada birçok dokunun oluşmasına kaynaklık etmesine rağmen, yeni bir birey oluşturamazlar (9, 10). Döllenmenin beşinci gününden itibaren ve birkaç hücre bölünmesinden sonra totipotent hücreler farklılaşmaya başlayarak blastosist denilen içi boş bir küreye dönüşürler. Blastosistte iki tip hücre vardır; biri dış tabaka (ektoderm), diğeri ise iç tabaka (endoderm)dir. Blastosistin dış tabakasından (throphoblast), yavrunun beslenmesi ve solunumunu sağlayacak plasenta ve koruyucu chorion kesesi gelişir. Blastosistin iç hücre tabakasından (nodus embriyonalis) göz, kalp, beyin, kaslar, kemikler vs gibi doku ve organlar gelişir. Ancak bunun için endoderm ve ektodermin birlikte çalışması gereklidir. Tek başına endodermden hiçbir canlı gelişemez. Blastosistin iç tabakasındaki hücre kümesi pluripotent’dir. Buradaki hücreler çeşitli doku ve hücre tiplerine dönüşebilirler. Pluripotent hücreler totipotent olmadığından plasenta oluşamaz ve dolayısı ile de canlı gelişimi olmaz. Blastosistin iç hücre tabakasından köken alan pluripotent kök hücrelerine embriyonik kök hücreleri (embriyonic stem cell) de denilmektedir ( 3, 5, 8). 3. Multipotent Pluripotent hücrelerden daha sınırlı sayıda hücre tipine dönüşebilen ve tek bir yönde farklılaşmak üzere programlanmış hücrelerdir (9, 10). Pluripotent kök hücreleri (Erişkin kök hücreler), biraz daha özelleşmiş olan multipotent kök hücrelerine dönüşürler. Kademe kademe farklılaşmalar geçiren pluripotent hücreler, daha özel hücreler haline gelirler. Örneğin; kan hücrelerini oluşturacak kök hücreleri; oksijen taşıyarak solunumda gerekli olan alyuvarlar, hastalık etkenleri ile savaşan akyuvarlar ve pıhtılaşmayı sağlayan trombositler gibi birbirinden farklı özelliklere sahip üç ana grupta farklılaşırlar. Deri kök hücreleri çeşitli tipteki deri hücrelerini, kas kök hücreleri de farklı tipteki kas dokularını meydana getirirler. İşte, bu özelliklere sahip kök hücrelerine multipotent kök hücreler denir. Sonuçta bir tek döllenmiş yumurtadan milyarlarca farklı hücre oluşur. Pluripotent kök hücreleri erken gelişim döneminde bulunur. Buna karşın multipotent kök hücreleri çocuklarda ve yetişkinlerde bulunabilmektedir. Örneğin insanın kemik iliğinde bulunan kan kök hücreleri hayati öneme sahiptir. Ömür boyu bu 7 kök hücreleri çeşitli tipteki kan hücrelerine dönüşerek hayatın devamlılığını sağlarlar (3, 5, 8). Çeşitli kök hücre tipleri Şekil 2.1.’de gösterilmiştir. Şekil 2.1. Çeşitli kök hücre tipleri 2.2.2. Bulunduğu Yerlere Ve Elde Edildiği Kaynaklara Göre Kök Hücreler Kök hücreler, bulunduğu ve elde edildiği kaynaklara göre; A. Embriyonik kök hücreleri B. Embriyonik olmayan kök hücreleri 1- Erişkin kök hücreleri a) Hematopoetik kök hücreleri 8 I. Kemik iliği kök hücreleri II. Periferik kan kök hücreleri III. Kordon kanı kök hücreleri b) Stromal kök hücreleri c) Organlardaki kök hücreler 2- Fetüs kök hücreleri 3- Kadavra kök hücreleri olarak sınıflandırılırlar (8). Kök hücrelerin kaynaklarına göre sınıflandırılmaları Şekil 2.2.’de gösterilmiştir (8). Şekil 2.2. Kök Hücre Kaynakları A. Embriyonik Kök Hücreleri Erken dönemdeki memeli embriyosundaki kök hücrelerden elde edilmektedirler. Bu hücreler in vitro ortamda sınırsız ve farklılaşmadan çoğalma kapasitesine sahiptir ve pluripotenttirler. Embriyonik kök hücrelerin vücuttaki tüm dokulara kaynaklık edebileceği, sadece farelerde tam olarak gösterilebilmiştir (8, 11). Birçok çalışmada insan embriyonik kök hücrelerinin in vitro ortamda farklılaştıkları gösterilmiştir. İnsan 9 embriyonik kök hücrelerinin, embriyonik doku gelişimindeki üç farklı tabakaya ait hücrelere kaynaklık ettiği bildirilmiş ve embriyonik cisimler adı verilen hücre topluluklarını meydana getirdikleri gözlenmiştir (8, 11). Embriyonik kök hücre serileri, sürekli çoğalabildikleri ve pluripotent özellikte olduklarından vücuttaki herhangi bir hücre tipi için yenilenebilir bir kaynak oluşturmaktadırlar. Embriyonik kök hücreleri, diğer vücut hücrelerine kıyasla çok yüksek bir çekirdek-sitoplâzma hacmine sahiptir ve belirgin bir pronükleus yapısı içerir. Bu hücreler, destek hücreleri üzerindeki kültürlerde üç boyutlu koloni oluştururlar. Embriyonik kök hücrelerin bir diğer önemli özelliği de, kanser hücrelerine benzer bölünebilme özelliğine sahip olmalarıdır. Ancak bu hücrelerden farklı olarak normal bir karyotip yapısına sahiptirler. Embriyonik kök hücreleri, ileri moleküler tanımlama teknikleri kullanılarak gösterilebilirler (11). B. Embriyonik Olmayan Kök Hücreler 1. Erişkin Kök Hücreler Dokuya özgün kök hücre, postnatal kök hücre olarak da bilinir. Erişkin kök hücrelerinin embriyonik kök hücrelerinde olduğu gibi her çeşit dokuya kaynaklık edebileceği konusunda tam bir görüş birliği bulunmamaktadır. Erişkin kök hücreleri, bir doku veya organdaki farklılaşmış hücreler arasında bulunan farklılaşmamış hücrelerdir. Bu hücreler kendilerini yenileyebilir ve içinde bulunduğu doku veya organın özelleşmiş hücre tiplerine farklılaşabilirler. Somatik kök hücre de denilen erişkin kök hücrelerinin esas görevleri, bulundukları dokuyu tamir etmek ve dokunun devamlılığını sağlamaktır (12). HKH’lerinin kemik iliğinde sürekli olarak kendilerini yenileyebilme ve kanda bulunan diğer hücre türlerine farklılaşabilme yetenekleri, bunları temel erişkin kök hücresi sınıfına sokmaktadır. Daha sonraları kemik iliği stromal hücreleri denilen ikinci bir grup keşfedildi. Kemik iliği ve kanda bulunan kök hücrelerinin, kan hücreleri dışında kas, sinir, kemik, karaciğer ve damar hücrelerine de dönüşebildiği gösterilmiştir. Bu kemik iliği stromal hücrelerine mezenkimal kök hücre de denir. HKH’leri, erişkin insanlardan izole edilebilen az sayıdaki kök hücrelerden biridir. Esas itibariyle, kemik iliğinde yerleşik olan HKH’leri normalde fetüsün karaciğerinde, dalağında, göbek kordonunda, plasentada ve erişkin periferik kanında bulunurlar. 10 Bugün için HKH’lerle ilişkili araştırmalar: i) Kemik iliği, ii) Periferik kan ve iii) Kordon kanı kök hücreleri üzerinde yoğunlaşmışlardır.(12, 13). Bu hücrelerin, in vitro ortamda kemik, kıkırdak, adiposit, miyosit ve kardiyomiyositlere farklılaştıkları gösterilmiştir (12, 14). Kemik iliği stromal hücrelerinin, miyojenik farklılaşma ve erişkin organize kontraktil protein oluşturduğu ve alıcı kardiyomiyositler ile gap junctionlar aracılığı ile ilişki kurduğu gösterilmiştir (12, 15). Kemik iliği stromal hücrelerinin miyositler dışında endotel ve düz kas hücrelerine de farklılaştığı bildirilmiştir (12, 16). 2. Fötal Kök Hücreler Bu hücreler ilk olarak 1998 yılında Gearhart ve arkadaşlarının çalışmaları sonucunda, 59 haftalık fetusun gonadal kıvrım ve mezenter bölgesindeki primordiyal germ hücrelerinin kültürlerinden elde edilmiştir. Fetustan elde edilen kök hücrelerin, araştırma veya tedavide kullanımın etik açıdan ciddi sorunlar doğurabileceği bildirilmektedir. Ancak, kendiliğinden düşük yapmış kişilerde bu hücrelerin bağışlanarak araştırma ve tedavi amacıyla kullanılabileceği belirtilmektedir. Fetuslardan elde edilen kök hücreler oldukça sınırlıdır (nöral kök hücreleri, HKH’ler ve pankreas öncül hücreleri) (11). Günümüzde çeşitli kalıtsal hastalıklar fetal kaynaklı kök hücre nakilleri ile tedavi edilmektedir (17). 3. Kadavra Kök Hücreleri Araştırıcılar bu tip hücrelerden elde edilen yeni hücrelerin çoğalma hızlarının ölen kişilerin yaşıyla ters orantılı olduğunu bildirmektedir (11). 2.3. KORDON KANI Göbek kordonu anne karnındaki bebeğin besin ve oksijen ihtiyacını karşılayan ve bebeği plasenta aracılığıyla anneye bağlayan dokudur. Kordon kanı doğumdan sonra bu dokunun ve plasentanın içinde kalan kandır (18). 11 Kordon kanı, HKH’lerin nakledilmesi için bir kaynak olarak kabul edilmektedir (18). Hem intrauterin dönemde hem de doğumda HKH fetal dolaşımda bulunur, fakat doğumdan birkaç saat sonra eritrosit, lökosit ve trombosit gibi tüm kan hücrelerinin öncüllerini sağlayan kemik iliğine göç ederler (19). Fetal dolaşıma ek olarak HKH plasenta ve göbek kordonu içinde bulunan kanda da bulunurlar. Yaklaşık 100 ml civarında olan bu kan doğum sonrasında plasenta ile atılır. Kordon kanı, doğum sırasında anneye ya da bebeğe herhangi bir risk getirmeyecek şekilde kolayca toplanabilir. Göbek kordon kanında bulunan HKH, vericinin kendisi için tam HLA uyumuna sahip iken, kardeşler ve diğer akrabaların kullanımı için de HLA uyumu olasılığı çok yüksektir. Kemik iliği ve periferik kandan elde edilen HKH nakli, her zaman HLA’sı tam uygun verici bulunamaması ve yüksek toksisite gibi nedenlerle sınırlı başarıya sahiptir. Endotel hasarına bağlı hepatik ven oklüzyonu, idiopatik pnömoni, trombotik mikroanjiyopati, hemolitik üremik sendrom gibi erken komplikasyonlar, bunun yanında akut ve kronik konağa karşı graft hastalığı (KKGH), aplastik dönemde enfeksiyon riski ve farklı organ sistemlerini etkileyen erken ve geç komplikasyonlar toksisiteyi oluştururlar (20). Kordon kanı HKH’sinin biyolojik ve immünolojik özellikleri kemik iliği ve periferik kan HKH’sinden farklıdır. Bu farklar nedeniyle KKGH riskinin, kemik iliği ve periferik kandan elde edilen HKH’sine göre daha az olduğu ileri sürülmektedir (19, 20). Kordon kanındaki lenfositler zayıf fenotipe sahiptirler. Yüksek düzeyde boş HLA sınıf 2 molekülleri içerirler (21). Kordon kanı mononüklear hücrelerinde NK ve T lenfositlerin fonksiyonlarında önemli rolü olan IL– 12 ekspresyonun periferik kan hücrelerine göre daha az olduğu gösterilmiştir (22). Kordon kanı HKH’sinin bir başka özelliği de, kemik iliği hücrelerine göre nekroz ve apoptosis aracılığıyla oluşturduğu sitotoksisitenin fazla olmasıdır. Bu özelliklerin kök hücre transplantasyonları üzerine önemli etkileri olacağı ileri sürülmüştür. Çünkü kordon kanı, artmış lösemiye karşı greft etkisine sahip olabilir ve malign kan hastalıkları tedavisinde bu özellik önemlidir (23). CD34 antijeni, HKH’nin bir belirleyicisidir. CD34+ hücre sayısı kemik iliğinde %1–3 oranındayken, kordon kanında %0,2-1’dir (18). HKH’nin içindeki bir grupta CD38 antijeni olmayan daha ilkel bir hücre grubu vardır (CD34+/CD38-). Bu hücrelerin oranı ise kordon kanında, kemik iliğinden daha fazladır (sırasıyla %4, %1) (20). Diğer olgunlaşmamış HKH sayısı kordon kanında, kemik iliği ve periferik kandan daha fazladır. Kordon kanı HKH’sinin kemik iliğindekilerden bir başka önemli farkı, kordon kanı hücrelerinin kemik iliğine 12 göre in vitro ve in vivo proliferasyon ve ekspansiyon yeteneklerinin fazla olmasıdır (20). Kordon kanının kemik iliği ve periferik kana göre miktarının göreceli olarak az olması, vücut ağırlığı fazla olan yetişkinlerde greftin başarısız olmasına neden olmaktadır. Bununla birlikte, ex vivo koşullarda kültürde çoğaltılarak transplantasyonlarının bir avantaj sağlayabileceği belirtilmektedir (19, 20, 24, 25). 2.3.1. Kordon Kanının Elde Edilişi Kordon kanının doğru bir şekilde toplanması kaliteli materyal elde edebilmek için ilk basamaktır (Resim 2.1.). Kordon kanının toplanması, kordon kanı bankaları arasında ve aynı bankalara bağlı değişik birimler arasında farklılık gösterir. Temel olarak kullanılan iki yöntem vardır (26). Resim 2.1.Kordon Kanı Alınması a. İntrauterin Yöntem Doğum odasında, henüz plasenta ayrılmadan bu konuda deneyimli ebe-hemşire ya da kadın doğum hekimi tarafından yapılır. Göbek kordonu, kesildikten ve bebek ayrıldıktan sonra önce betadin sonra %70 alkol ile temizlenir. Maternal taraftan umbilikal vene girilerek, kan bankası tarafından sağlanan, içinde 25-35 ml CPD (sitrat fosfat solüsyonu) bulunan, steril, 350 ml’lik kan torbasında toplanır. Kan bankalanacağı yere gitmeden önce + 4°C’de 24-48 saat bekletilebilir (26). 13 b. Ekstrauterin Yöntem Plasenta doğurtulur. Hemen kanın toplanacağı steril alana alınır. Burada kan bankası personeli plasentayı umblikal kordonun aşağı sarkmasını sağlayacak deliği olan özel bir kaba alır ve kordon aynı şekilde betadin ve %70 alkolle temizlendikten sonra tüm işlemler intrauterin yöntemde olduğu şekilde yapılır (26). Kordon kanının intrauterin veya ekstrauterin yöntemle elde edildikten sonra, bankalama aşamasına kadar olan süreç Şekil 2.3.’de verilmiştir. Şekil 2.3. Kordon Kanının Hazırlanması İntrauterin toplama yöntemini daha üstün bulan araştırmacılar olduğu gibi (26), iki yöntem arasında fark olmadığını ileri süren araştırmacılar (27) da vardır. İntrauterin yöntemi savunanlar elde edilen volüm, total hücre sayısı ve koloni oluşturan birim(CFU) sayısını ekstrauterin yöntemden daha fazla bulmuşlardır. Ayrıca, plasentanın ayrılmasından sonra plasenta arkasında oluşan pıhtının ve geçen sürenin, kan volümünde ve elde edilen hücre sayısında azalmaya neden olduğunu ileri sürmüşlerdir (26). Bunun yanında ekstrauterin yöntemi savunanlar ise, total hücre sayısı ve kan volümünün intrauterin yönteme göre daha iyi olduğunu, ayrıca bakteriyel kontaminasyon riskinin de intrauterin yöntemde daha fazla olduğunu ileri sürmektedirler (27). Aynı plasentadan plasenta çıkmadan ve çıktıktan sonra yapılan bir 14 çalışmada ise, intrauterin olarak alınan kanda total çekirdekli hücre sayısı ve CFU miktarı daha yüksek bulunmuş ve bu sonuçlar da intrauterin yöntemin daha iyi olduğu yönünde yorumlanmıştır (28). Doğumun sezeryan ya da normal doğum şeklinde olmasının, toplanan kan volümünü herhangi bir şekilde etkilemediği bildirilmektedir (26, 28). Sonuç olarak, hangi yöntemin daha iyi olduğu konusunda kesin bir görüş birliği olmamakla beraber, kanı toplayan elemanın tecrübeli ve bu konuda eğitim almış olmasının oldukça önemli olduğu belirtilmektedir (26, 27). Kordon Kanı Toplama İşleminde Dikkat Edilmesi Gereken Diğer Faktörler Kan toplama işlemi sırasında ailenin isteği ve yazılı onay formu gereklidir. Bununla birlikte, gebelik haftası 35’in altında ise, annede ateş, yenidoğanda kalıtsal hastalık şüphesi varsa, anne ve babanın yaşam şekli ya da serolojisi viral hastalık riskleri açısından pozitif ise ve doğan fetusta malformasyon tespit edilirse toplama işleminin iptal edilmesi gerektiği bildirilmektedir (20). Toplanan kanın miktarının obstetrik faktörlerden de etkilendiği gösterilmiştir (Tablo 2.1) (25). Bunların içinde en önemlisi kordonun klemplenme zamanıdır. Kordonun en geç 20 saniye içinde klemplenmesi durumunda, elde edilen kan volümü ve total hücre sayısının arttığı gösterilmiştir (20, 25, 26, 37). Bununla birlikte, yalnızca kordon kanı toplanması amacıyla kordonun hemen klempe edilmesi etik açıdan önerilmemekte, zamanlama kadın doğum uzmanına bırakılmaktadır. Her ne kadar göbek kordonunun erken klemplenmesinin fetusta anemiye yol açabileceği ileri sürülse de (29); şu ana kadar kordon kanı toplanan 2000’den fazla fetusta bildirilen herhangi bir komplikasyonun olmadığı ve işlemin yenidoğan açısından güvenli olarak kabul edildiği bildirilmektedir (26). Tablo 2.1. Toplanan kordon kanı volümü ve hücre sayısına etki eden obstetrik faktörler Obstetrik Faktör Etkisi Gebeliğin Haftası Total hücre ve CD34+ hücreler artar Bebeğin büyüklüğü Total hücre ve CD34+ hücreler, CFU artar Kordon bağlanma zamanı Volüm, total hücre sayısı azalır Travay süresinin uzaması Parite Total hücre, granülosit, hematopoetik progenitör, CD34+ hücre sayısı azalır Total hücre sayısı 15 2.3.2. Kordon Kanının Saklanması Kordon kanı toplandıktan ve viral testler yapıldıktan hemen sonra dondurularak bankalanırken, sonraki dönemlerde özellikle kanın bankada daha az yer kaplamasını sağlamak amacı ile volüm azaltıcı işlemler yapılmaya başlanmıştır (Resim 2.2.) (30-33). Resim 2.2. Kordon Kanının Saklanması Kan bankasına işlenmek üzere gelen kan ilk aşamada volümü ve total hücre sayısı açısından değerlendirilmektedir. Kan volümü, 40-60 ml’nin altında olan kanlar kabul edilmemekte ve atılmaktadır (20, 26, 27, 32). Bu atılma oranı kan bankalarına göre %34-52,6 arasında değişir (20, 27). Bu yüksek oran kan toplama basamağının önemini bir kez daha ortaya koymaktadır. Bazı merkezler volümü düşük kanları atmayıp, klinik araştırmalar için saklamaktadırlar (27). Kanın kabul edilmesinde, volümün yanında çekirdekli hücre sayısının da önemli olduğu belirtilmektedir. Minimum 5 × 108 total çekirdekli hücre olması gerekmektedir. Volümü azaltmak için kordon kanı Percoll ya da Ficoll solüsyonu ile yoğunluk farkına göre ayrıştırma, %3 jelatin sedimantasyon ya da hidroksietil (HES) sedimentasyon yöntemlerinden biriyle işlenir (20, 25, 26, 30). Son yıllarda hepsi kan torbası açılarak yapılan, bu nedenle bakteriyel kontaminasyon riski fazla olan bu yöntemlere alternatif olarak, 3 torba kapalı sistem volüm azaltma yöntemi geliştirilmiştir (Optipress) (32). Kordon kan volümü bu şekilde kırmızı hücre ve fibrin kısımları atılarak 25 ml’ye kadar düşürülebilir. Volümü azaltılan kordon kanı dondurulmadan önce, total hücre ve CD34+ hücre sayımı, canlılık, HLA tiplemesi, serolojik testler ve bakteri kültürü (aerob ve anaerob) için örnek alınır. Kordon kanı ile gelen anne kanında serolojik tarama yapılır (Hbs Ag, anti 16 HIV 1,2, Anti HCV, anti HTLV I ve II, Anti CMV Ig M ve Ig G, antitoksoplazma Ig M ve Ig G, TPHA). Bu serolojik testlerin doğumdan sonra altıncı ayda enfeksiyon antikor pozitifleşme penceresi dikkate alındığında tekrarlanması önerilir (20). HLA tiplendirmesi HLA sınıf A, B ve DR için serolojik yöntemlerle ve son yıllarda PCR kullanılarak yapılmaktadır (34). Tüm bu işlemlerin ardından, DMSO solüsyonu ile işlemden geçirilerek kontrollü hızla dondurulan kan –135°C’de sıvı azot içinde saklanır. 2.3.3. Kordon Kanı Kök Hücresi Kordon kanı kök hücrelerinin erişkin kemik iliği kök hücrelerine göre daha immatür olmasının HKHT açısından bazı teorik avantajları vardır. Kordon kanı, kök hücrelerin daha immatür olan alt grubu (in vivo long-term repopulating stem cells) açısından erişkin kemik iliğine göre daha zengindir. Bu özellikteki kordon kanı kök hücreleri; in vitro olarak daha büyük hematopoetik koloniler oluştururlar, büyüme faktörü gereksinimleri daha farklıdır, in vitro kültürlerde daha fazla ekspanse olabilirler ve daha uzun telomeraza sahiptirler. Kordon kanı kök hücrelerinin in vitro olarak bu özelliklere sahip olması, teorik olarak kemik iliğine göre daha az sayıdaki kök hücre miktarı ile hematopoetik engraftmanın gerçekleşebilirliğini desteklemektedir (35). Kök hücre kaynağı olarak kordon kanı ve kemik iliğinin karşılaştırılması Tablo 2.2.’de verilmiştir (36). Tablo 2.2. Akraba dışı kök hücre kaynağı olarak kemik iliği ile kordon kanının karşılaştırılması. Kök hücre ve lenfosit içeriği HLA-DRBt tiplendirme oranı Uygun verici bulma süresi Sanal-reel oranı Nadir haplotip içermesi Engrafmanı etkileyen Harvest ve uygulama Donör lenfosit infüzyonu Viral bulaşma riski Kalıtsal hastalık riski Vericiye risk GVHH riski Engrafman Posttransplant CMV riski Posttransplant HHV–6 enfeksiyon riski Nüks riski KEMİK İLİĞİ Daha fazla %16–56 3 ay %30 %2–10 HLA uyumu Zor + + + Daha fazla Daha hızlı Daha az Daha az Daha az KORDON KANI Daha az %80 1 aydan az %1’den az %20 Hücre sayısı Kolay + Daha az Daha yavaş Daha fazla Daha fazla Daha fazla 17 2.3.4. Kordon Kanının “Ex Vivo” Ekspansiyonu Kordon kanında sınırlı miktarda kök hücrenin bulunması bu önemli kök hücre kaynağının erişkinler için kullanımını sınırlamaktadır (37, 38). Ayrıca çocuk hastalarda kullanıldığında bile nötrofil ve trombosit engraftmanı kemik iliği transplantasyonuna göre daha geç olmaktadır (39-42). Kordon kanı kök hücrelerinin ex vivo ekspansiyonu ile bu güçlüklerin üstesinden gelinmesi ve erişkin hastalar için de daha rahat kullanılabilirliği hedeflenmektedir. Teorik olarak hastaya kordon kanı ile verilecek kök hücre ve progenitör hücrelerin sayısının in vitro ortamda arttırılması ile hematopoetik engraftman hızlandırılabilir, enfeksiyon riski azaltılabilir ve erişkin hastalar için daha güvenle kullanılabilir. Bu nedenlerle başlatılmış preklinik çalışmalarda kordon kanındaki kök hücrelerin ex vivo olarak ekspansiyonunun sağlanabildiği gösterilmiş ve bunun klinik açıdan önemi sorgulanmaya başlanmıştır (43). 2.3.5. Birden Fazla Kordon Kanının Birlikte Kullanımı Kordon kanı transplantasyonunda HKH sayısını arttırmanın bir yolu birden fazla kordon kanını bir arada kullanmaktır. Böylece, önceleri sadece çocuklar için kullanılabilen kordon kanı transplantasyonunun erişkinlerde de kullanılması gündeme gelmiştir. 2.4. KORDON KANI KÖK HÜCRESİNİN FARKLILAŞMASI Kordon kanı kök hücresi in vitro ve in vivo koşullarda, genetik profillerine göre çeşitli yöntemler kullanılarak çeşitli doku ve organlara farklılaşması sağlanmaktadır. 2.4.1. Hematopoietik Kök Hücrelerin Genetik Profilleri HKH’yi tanımak için kullanılan en iyi belirleyici CD34’dür. Ancak bu özelliği taşıyan hücreler arasında, istirahatteki kök hücreler ile bir miktar farklılaşma gösteren kök hücreler birlikte yer almaktadır. HKH içerisinde CD34+/CD38- niteliği taşıyanlar erken aşamaya ait farklılaşma göstermemiş hücrelerdir. Erken kök hücreleri saflaştırmak için ilave olarak Thy–1(CD90), HLA-DR, CD133, c-kit(CD117) veya Rhodamin-123 gibi diğer zayıf fenotipik özellikler de kullanılmaktadır. Ancak bu fenotipik özelliklerin farklılaşma potansiyeli ve proliferasyon durumu ile ilişkisi henüz tam aydınlatılmış 18 değildir. Kök hücre araştırmalarında bir standart oluşturması açısından CD34+/CD38/lin- olan CD34+ hücrelerin %1–10 unu oluşturan, olgunlaşmamış erken HKH havuzu, CD34+/CD38+/lin++ olan hematopoietik progenitör hücrelerden(HPH) ayrı olarak incelenmesi tercih edilmektedir. Farklı hematopoietik dokularda bulunan HKH’lerin transplantasyon başarısı hem deneysel hem de klinik olarak iyi araştırılmış bir konudur. Farklı dokularda bulunan kök hücrelerin, proliferatif kapasitelerinin ve ikincil olarak telomer uzunluklarının farklı olduğunun gösterilmesi, bu hücrelerin genetik farklılıkları olacağını düşündürmektedir (44). 2.4.2. Kök Hücre Proliferasyon ve Farklılaşmasında Rol Oynayan Genler Kök hücrelerin farklılaşmasında genetik profillerinin önemli olduğu ortaya atılmıştır. Georgantas ve arkadaşları, insan kordon kanı, kemik iliği ve mobilize edilmiş periferik kök hücrelerinde HKH ve HPH gruplarında gen ekspresyon profilini incelediler. Böylece ilk kez farklı dokulardaki erken dönem ve farklılaşmaya başlamış HKH’lerde artmış veya baskılanmış genler gösterilmiş oldu. Bu araştırmada erken HKH’lerde incelenen 45102 genden 4746 sının tüm dokulardaki kök hücreler için ortak olduğu, mobilize periferik kanının fazla olarak 254, kemik iliğinin 394, kordon kanının ise 3686 gen içerdiği gözlenmiştir. Ortak olan genlerin sınıflandırılması sonucunda büyük kısmının henüz tanımlanmamış genlerden oluştuğu görülmektedir. Aynı araştırmada erken dönem HKH’lerde geç dönem HPH’lere oranla artmış olan gen ekspresyonlarına bakıldığında artış gösteren genlerde her doku için ortak olan ancak 81 gen bulunmuştur. Dokuya özgü farklı genlerde ise kemik iliği en çok gen ekspresyon artışı göstermektedir (n:926), onu kordon kanı (n:575) ve ardından mobilize periferik kan (n:314) izlemektedir. Burada erken aşamadaki HKH’lerde daha yüksek ekspresyon gösteren genlerin sinyal ileti, transkripsiyon, DNA yapı genleri olduğu gözlenmiştir. Yine önemli bir oranda tiplendirilmeyen genler de bulunmaktadır. Erken ve geç aşamadaki HKH’ler kıyaslandığında erken kök hücrelerde azalmış olarak eksprese edilen gen sayısı bakımından en çok azalmış gene kemik iliğinde (n:769), daha sonra kordon kanında (n:489) ve en az mobilize periferik kanda (n:230) rastlanılmaktadır. Burada farklılaşma ile artan gen ekspresyonlarının sinyal ileti yolu, hücre döngüsü, protein biyosentezi, transkripsiyon, DNA yapısı ve tamir genleri sınıfında olduğu görülmektedir. Yine burada da çok büyük oranda sınıflandırılmamış gene rastlanılmaktadır. Bu araştırmada, 19 daha önce HKH’leri CD38 ve lin ekspresyonuna göre ayırmadan yapılan çalışmalarda saptanan hematopoezde rol oynayan, KIT, FLT3, GATA–2, GATA–3, p27, HoxA5 ve HoxA2 ile kök hücreye ait belirleyiciler olarak kabul edilen CD34 ve MDR2 genlerinin erken HKH’lerde saptandığı ancak CD38 ve myeloperoksidaz geninin eksprese edilmediği görülmüştür. Bu bulgu hücre ayrıştırmasında kullanılan akım sitometrik yöntemin etkinliğini de kanıtlamaktadır. Benzer şekilde hem insan hem de farelerde microarray ile gen ekspresyon profilini inceleyen araştırmaların meta analizi yapıldığında erken HKH’lerde artmış ekspresyon gözlenen genler HLF, HERMES, CD110(MPL), ROBO4, HOXB6, GATA3, SOCS–2, SPTBN1, MDS1, KLF4, TRAIL, GBP2, DKFZP434J214, CEBPB’dir. Bunların işlevsel önemi zamanla ortaya çıkacaktır (44). 2.4.3. Kök Hücrelerinde Bölünme Şekilleri Kök hücreler, farklılaşmış hücreleri oluşturmak için iki çeşit bölünme yaparlar. 1) Asimetrik bölünme (invariyant ya da değişmez bölünme); 2) Simetrik bölünme (düzenleyici bölünme) Asimetrik bölünmede, kök hücre ikiye bölünerek bir kök hücre ve bir de ilerde farklılaşacak olan progenitor hücre (PH) oluşturur. Bu bölünmeye bu nedenle simetrik olmayan bölünme denir. Çünkü simetrik bölünmenin Kök hücre → Kök hücre + Kök hücre şeklinde olması gerekir. Asimetrik bölünme, Kök hücre → Kök hücre + Progenitör hücre şeklinde gerçekleşir. Progenitör hücreler ileride bölünerek farklılaşmış hücrelere dönüşebilirler. Tek hücreli canlılarda ve omurgasızlarda, örneğin Drosophila yumurtalıklarında, asimetrik bölünme örnekleri görülmüştür (5). Simetrik bölünmede ise, Kök hücre → Kök hücre + Kök hücre ya da Kök hücre → Progenitör hücre + Progenitör hücre olacak şekilde bölünür. Kök hücre + Kök hücre mi, Progenitör hücre + Progenitör hücre mi olacağı tesadüfîdir; fakat uygun ortalama alınırsa, bölünmeler sonucunda eşit sayıda kök hücre ve progenitör hücre oluştuğu görülür. Buna rağmen bu ikinci tip bölünmelerin sonucunda dokuda kök hücre ve progenitör hücre sayıları eşit değildir; buna “popülasyon asimetrisi” denir. Ortalama olarak eşit sayıda kök hücre ve progenitör hücre oluşmuşken dokuda kök hücre ve progenitör hücre sayılarının farklı oluşunun nedeni, doku gereksinimlerine göre kök 20 hücre ve progenitör hücre bölünme hızlarının değişebilmesidir. Genellikle dokularda progenitör hücrelerin sayısı kök hücrelerden çok daha fazladır. Memelilerin kendini yenileyebilen dokularının çoğu ikinci tip bölünme yapar ve popülasyon asimetrisi gösterir. Çok farklı olsalar da, bu iki bölünmede de geri kontrol (feedback) ve hücrelerarası etkileşim mekanizmaları söz konusudur. Hücre populasyonlarının simetrik olmayışı çeşitli fizyolojik gereksinimlere yanıtı kolaylaştırır; bir yaralanmadan sonra kan ya da epidermis hücreleri gerektiğinde, daha çabuk oluşturulabilir (5). Bölünmelerdeki Kontrol Mekanizmaları 1-İç kontrol mekanizmaları Asimetrik hücre bölünmesinden meydana gelen iki hücreden her biri, ötekinden farklı bir gelişme gücü taşır. Bu güç iki şekilde sağlanır; hücre kaderini belirleyici öğelerin iki hücreye eşit olmayan dağılımı, ya da çevreden gelen farklılaştırıcı etkilerdir. Yapısal proteinler ve özellikle hücre iskeleti (sito-skeleton), hücre kaderini belirleyici öğelerin bölüşülmesinde önemli rol oynarlar. Drosophila duyu organı öncül hücresinin asimetrik bölünmesi, birçok gen grubunca kontrol edilir; bunlardan biri İnsc gen grubudur. Kök hücrenin asimetrik bölünmesini “spektrozom” denen bir hücre cisimciği sağlar. Spektrozom hücre zarına bağlı hücre iskeleti proteinlerinden “spektrin”leri ve düzenleyici protein “siklin A” yı içerir. Spektrozom, mitoz mekiğine bağlanarak kök hücre bölünmesini yönlendirir. Spektrozom ayrıca kök hücrenin kaderini belirlemede önemi olan moleküllerin yerini belirler ve onların progenitör hücrelere dönüşmesini sağlar (5). 2-Dış kontrol mekanizmaları Kök hücrelerin çoğalmasını ve farklılaşmasını düzenleyen salgılar çok çeşitlidir. Bunlardan ikisi TGF-β’lar ve Wnt’ler. Wnt’ler, β-kateninleri içeren karmaşık bir yolla DNA kopyalanmasını etkinleştirir. Embriyondaki sinir kök hücre farklılaşması TGF-β grubundan en az iki madde ile olur. Örneğin kan yapımı ve melanin sentezi için kök hücre faktörü (SCF) ile onun bağlandığı tirozin kinaz gereklidir (5). 21 2.5. KORDON KANININ HASTALIK TEDAVİSİNDE KULLANIMI Kordon kanı kök hücreleriyle tedavi başlıca üç şekilde olur: * Birincisinde, kordon kanı üzerinde hiçbir işlem yapılmadan hastaya doğrudan nakil edilebilir (kordon kanı transplantasyonu). Kordon kanı kök hücreleri, enjekte edilen doku içerisinde etraftan gelen kimyasal ve fiziksel sinyaller sonucu özelleşmiş hücrelere dönüşerek hasta dokuyu yenilemeye başlarlar. * İkincisinde, kordon kanı kök hücreleri gen terapisi için araç olarak kullanılır. Kök hücrelerinin DNA dizilerine yeni genler yerleştirildikten sonra hastaya nakledilir. * Üçüncü metod da ise, kök hücrelerin özelleşmiş dokuya veya organa dönüşme safhası labaratuvar ortamında gerçekleştirilir ve bu hazır doku veya organ hastaya nakledilir. 2.5.1. Kordon Kanının Doku Rejenerasyonunda Kullanılması Kemik iliği veya kordon kanından elde elde edilen HKH’lerinin sistemik veya lokal olarak uygulanması sonucunda; solid organ dokularına, spesifik hücrelerin rejenerasyonuna ve dolayısı ile de doku tamirine katkıda bulunduğu bildirilmektedir (45). HKH’lerinin hangi biyolojik mekanizmalar ile nonhematopoietik hücrelerin yeniden oluşumuna katkıda bulunduğu halen tartışmalı olmakla birlikte bu konuda birkaç hipotez öne sürülmüştür (46, 47). Bu konudaki en geçerli olan hipotezler şu şekilde özetlenebilir: 1) Dolaşımda solid organ-spesifik dokulara farklılaşmaya proglamlanmış farklı kök hücrelerin bulunması, 2) Gerçek pluripotent kök hücre özelliğindeki hücrelerin tüm yaşam boyu varlığını sürdürmesi, 3) Hematopoietik dokudan köken alan hücrelerin nonhematopoietik bir ortamda nükleer yeniden programlanma sonucu farklı dokulara farklılaşabilmesi (transdiferansiyasyon), 4) HKH’lerin organ-spesifik doku hücreleri ile füzyonu. Kordon kanının doku rejenerasyonunda kullanımı ve kordon kanından elde edilen HKH’lerin solid organ-spesifik dokulara farklılaşması ile ilgili veriler aşağıda özet halinde verilmiştir (47). 1. Karaciğer Doku Hasarı Karaciğerin intrensek kök hücre havuzunu hepatik oval hücrelerin oluşturduğu kabul edilmektedir. İlginç olarak da bu oval hücreler yüzeylerinde HKH’lere benzer şekilde 22 CD34, CD90 ve c-kit gibi antijenler eksprese etmektedirler (48). Bu bulgu kordon kanındaki veya diğer kaynaklardaki HKH’lerin doğrudan veya endojen karaciğer kök hücre havuzunu aktive ederek dolaylı olarak hepatositleri yeniden oluşturma potansiyeline sahip olduklarını desteklemektedir. Gerçekleştirilmiş olan hayvan deneylerinde kimyasal olarak karaciğer hasarı oluşturulmuş NOD/SCID farelere verilen insan kordon kanı hücreleri ile hasarlı karaciğer dokusunda hepatosit jenerasyonunun sağlandığı ve ölüm oranının azaltıldığı bildirilmiştir (35). 2. Tip I Diabet Otoimmün tip I diabeti olan NOD fareleri ile yapılan hayvan deneylerinde bu farelere prediabetik dönemde insan kordon kanı hücreleri verilmiştir. Sonuç olarak kordon kanı verilen farelerde verilmeyen farelere göre kan şekerinin belirgin olarak daha düşük seyrettiği ve yaşam sürelerinin daha uzun olduğu gösterilmiştir (49). 3. Santral Sinir Sistemi Hastalıkları Parkinson ve Huntington hastalıkları gibi nöro-dejeneratif hastalıklarda fötal dokuları kullanarak hücresel tedaviler denenmiştir. Ancak fötal dokuların kullanılmasındaki etik sorunların yanı sıra, teknik güçlükler ve özellikle elde edilen klinik açıdan yetersiz sonuçlar nedeni ile araştırmalar son zamanlarda erişkin kök hücre tedavilerine yönelmiştir. Parkinson hastalığı olan deneysel fare modelleri ile gerçekleştirilen araştırmalarda, bu farelere immünosüpresyon uygulanmadan intravenöz yolla insan HKH’leri verilmiştir (50). Hücresel tedevi uygulanan ve uygulanmayan farelerin karşılaştırılmasında kordon kanı hücreleri alan farelerde Parkinson hastalığı bulgularının ortaya çıkışı ve bu hastalığa bağlı ölümlerin süresi geçikmiştir. Yine aynı araştırma grubu, Alzheimer amyloid prekürsör proteininini (APP) fazla eksprese eden ve santral sinir sistemi hastalığı geliştirerek erken dönemde ölen transjenik farelere insan kordon kanı hücrelerini sistemik olarak vermişlerdir (35). Kordon kanı hücreleri verilen fareler verilmeyenlere göre daha uzun yaşamışlardır. Serebral inmede kordon kanı hücrelerinin etkisini araştırmak üzere düzenlenmiş olan deneysel fare modelinde kordon kanı hücreleri verilen farelerde 4 hafta sonrasında davranışsal performansın daha iyi olduğu ve inme volümünün de daha az olduğu gösterilmiştir (51). 23 2.5.2. Tedavisinde Kordon Kanı Kullanılan Hastalıklar Akut ve kronik lösemiler, myelodisplastik sendromlar, kök hücre bozuklukları, myeloproliferatif, lenfoproliferatif ile fagosit bozukluklar, lipozomal depo hastalıkları, konjenital (kalıtsal) bağışıklık sistemi hastalıkları gibi bozukluklar için de kök hücre tedavileri kullanılmaktadır. Bu bakımdan kök hücre teknolojisi, bir hücrenin ölmesi ya da görevini yapamaması sonucu gelişen hastalıkları (Diyabet, Parkinson, Alzheimer vb), yanmış vücut dokularının onarımını, organ nakillerini, bağışıklık sistemiyle ilişkili hastalıkların, kimi kanser türlerinin ve kalp kaslarının yenilenmesi gibi daha birçok hastalığın tedavisi için umut verici olmaktadır (35, 49, 50,). Günümüzde aşağıda listelenen pek çok hastalığın tedavisinde kordon kanı kök hücrelerinden yararlanılabilmektedir (5). Kanser Hastalıkları • Acute Lymphoblastic Leukemia (ALL) • Acute Myelogenous Leukemia (AML) • Burkitt's lymphoma • Chronic Myelogenous Leukemia (CML) • Juvenile chronic myelogenous leukemia (JCML) • Juvenile myelomonocytic leukemia (JMML) • Chronic lymphocytic leukemia (CLL) • Liposarcoma • Myelodysplastic syndrome (MDS) • Chronic myelomonocytic leukemia (CMML) • Refractory anemia with excess blasts in transformation (RAEB-t) • Neuroblastoma • Non-Hodgkin's lymphoma • Refractory Hodgkin's disease • Retinoblastoma 24 Bağışıklık Yetersizlikleri • Chronic granulomatous disease • Common variable immune deficiency (CVID) • Omenn's syndrome • Severe combined immune deficiency (SCID and SCID-ADA) • Reticular dysgenesis • Thymic dysplasia • Wiskott-Aldrich syndrome • X-linked lymphoproliferative disease Doğuştan Gelen Metabolik Düzensizlikler • Adrenoleukodystrophy • Bare lymphocyte syndrome (MHC-II complex) • Batten disease (inherited neuronal ceroid lipofuscinosis) • Familial erythrophagocytic/hemophagocytic lymphohistiocytosis • Gunther disease • Hunter syndrome • Hurler syndrome • Krabbe disease (globoid cell leukodystrophy) • Langerhans cell histiocytosis • Lesch-Nyhan disease • Leukocyte adhesion deficiency • Maroteaux-Lamy syndrome • Osteopetrosis • Tay-Sachs disease • Diabetis 25 Kalıtsal Kan Hastalıkları • Amegakaryocytic thrombocytopenia (AMT) • Evans syndrome • Kostmann's syndrome • Sickle cell anemia • ß-thalassemia (Cooley's anemia) Kemik İliği Hastalıkları • Severe aplastic anemia • Blackfan-Diamond anemia • Dyskeratosis congenita • Fanconi anemia • Myelofibrosis Araştırılan Tedaviler • Organ Yenileme: Zarar gören organların kök hücre yardımıyla eski haline dönüştürülmesi amaçlanmaktadır. Örneğin, insanlar üzerinde yapılan bir araştırmada, kalp krizi geçiren hastalara kök hücre tedavisi uygulandığında, verilen bu hücrelerin kalbin hasarlı kısmına yerleşerek kalp kası haline geldiği ve kalp fonksiyonlarını düzelttiği gösterilmiştir. Benzer şekilde, sinir kesisi veya harabiyetine bağlı felç sonrasında, kök hücrelerin alana enjeksiyonu ile kesi hattında yeni sinir hücrelerinin geliştiği gösterilmiştir. Aynı işlemin böbrek, karaciğer, pankreas, kemik kırıkları için de uygulanabileceği belirtilmektedir (5). • Organ Yapımı: Laboratuar ortamında kök hücrelerden üretilecek böbrek, karaciğer, akciğer-kalp ve kornea gibi organlar ile bu organların nakli yapılacağı kişilerde doku uyumu tam olan bir organ oluşturulması düşünülmektedir. 26 2.6. KAN KANSERİ (LÖSEMİ) Lösemiler, köken aldıkları hücre grubuna, semptomlarına, ortaya çıkış ve ilerleme hızlarına ve klinik seyirlerine göre gruplara ayrılırlar. Lösemiler ortaya çıkış hızlarına göre akut ve kronik olmak üzere 2 ana gruba ayrılırlar. 1. Akut Lösemiler A. Akut Lenfoid Lösemi(ALL) B. Akut Myeloid Lösemi(AML) 2. Kronik Lösemiler A. Kronik Lenfoid Lösemi(KLL) B. Kronik Myeloid Lösemi(KML) C. Juvenil Miyelomonositik Lösemi(JMML) 2.6.1. Akut Lösemiler Akut lösemiler (AL), hematopoetik dokuların malign, ilerleyici ve tedavi edilmedikleri takdirde genellikle 6 ay içinde ölümle sonuçlanan bir hastalık grubudur. Hastalık sitopatolojik olarak, kemik iliği ve periferik kanda iri, olgunlaşmamış ve anormal hücrelerin bol miktarda bulunması ile karakterizedir (52). Geliştikleri hücre grubuna göre lenfoid veya myeloid olarak 2 alt gruba ayrılırlar. A. Akut Lenfoid Lösemi (ALL) Normalde lenfosit adı verilen olgun kan hücresi tipine dönüşmesi gereken lenfoblast isimli olgunlaşmamış kan hücrelerin artması ile karakterizedir. Bu lenfoblastların sayıları çok miktarda artar ve genelde lenf düğümlerinde birikerek şişliklere neden olurlar. ALL, en sık gözlenen çocukluk çağı kanseridir ve 15 yaş altındaki çocuklarda gözlenen lösemilerin %80 i ALL’dir. Bazen yetişkinlerde de görülebilmekle birlikte, 50 yaşın üzerinde ALL son derece nadirdir (53). B. Akut Myeloid Lösemi (AML) Myeloblast adı verilen ve normal kan hücrelerine (kırmızı kan hücrelerine, trombositlere) dönüşmesi gereken anemi (kansızlık - kırmızı kan hücresi üretiminde 27 azalma) ve sık enfeksiyona yakalanma (beyaz kan hücresi üretiminde azalma) durumu ortaya çıkabilir. Ergenlik çağında ve 20’li yaşlarda saptanan lösemilerin %50’sini, yetişkinlerdeki lösemilerin de %20’sini AML oluşturur (54). AML’de lösemik hücreler myeloblast ve premyeloblast basamağından daha ileri olgunlaşamadıkları için, farklılaşmamış ya da çok az farklılaşmış immatür hücreler şeklinde kendilerini gösterirler. Bu anormal hücreler kemik iliğini infiltre ederek diğer hücrelerin yerini alır, kemik iliğinin normal yapısını tamamen bozabilir. Hastaların %10’unda lökosit sayısı normal iken, %80-90’ında periferik yaymada blastlar görülür (52, 54). Blast oranı prognozu belirleyen en önemli faktördür (52). AL’ler her yaşta görülebilen hastalık olup, çocuklarda 1-14 yaşlar arası ölümcüldür ve kendini ALL tipinde gösterirken, erişkinlerde ise daha sık olarak AML tipinde görülmektedir. Yaş ilerledikçe AML sıklığı artarken ALL sıklığı azalır. Kan tabloları ise, beyaz küre sayısı olguların % 80-90’ında artmış olup 20000/mm3’ den fazladır (52). 2.6.2. Kronik Lösemiler Kronik lösemi, görünüşte olgun ancak normal olgun kan hücrelerinin yaptıklarını yapamayan kan hücrelerinin aşırı üretimi ile karakterizedir. Kronik lösemi daha yavaş ilerler ve sonuçları daha az dramatiktir. Üç alt gruba ayrılır (55). A. Kronik Lenfoid Lösemi (KLL) Olgun görünüşe sahip lenfositlerin kemik iliğinde aşırı üretimi ile kendini gösterir. Bu anormal hücreler tam olarak olgunlaşmış normal lenfositler gibi görülürler, ancak normal lenfositler gibi vücudumuzu enfeksiyonlara karşı koruyamazlar. KLL’ de, kanser hücreleri kemik iliğinde, kanda ve lenf nodlarında bulunurlar ve lenf düğümlerinde şişmeler meydana gelir. KLL tüm lösemilerin %30’unu oluşturur. 30 yaşın altında nadiren görülürler, ancak görülme sıklığı yaşla birlikte artar ve en sık olarak 60-70 yaş arasında gözlenir (56). B. Kronik Myeloid Lösemi (KML) Bu lösemi, olgun görünüşlü ancak fonksiyon kaybı bulunan myeloid hücrelerin (beyaz kan hücreleri gibi) aşırı üretimi ile kendini gösterir. Bu aşırı üretim hiç normal hücre kalmayana kadar devam eder. KML hastası olanlarda sıklıkla Philadelphia kromozomu 28 denilen kromozom anomalisi ortaya çıkar. Bu kromozom anomalisinde bu hastalığa neden olan bir enzimin üretilmesine neden olan bir genin olduğu düşünülmektedir. KML yetişkinlerde gözlenen lösemilerin %20-30’unu meydana getirir ve 25-60 yaşları arasında gözlenir. Bazı hastalarda kök hücre nakli ile bu hastalık tedavi edilebilir. Kemoterapötik veya küratif tedavi şekilleri mevcuttur (55). C. Juvenil Miyelomonositik Lösemi(JMML) JMML 2 yaşın altında ve sıklıkla erkek çocuklarda görülen, çocukluk çağı lösemilerinin %2-3’ünü kapsayan klonal bir hastalıktır. Myelodisplastik Sendromlar (MDS) arasında sayılır. Bu hastalarda “Philadelphia kromozomu” bulunmaz. Tanıda, hepatosplenomegali, lenfadenopati, solukluk, ateş ve döküntü klinik kriterler olarak kabul edilir. Laboratuarda, “Philadelphia kromozomu” olmaması, >1 x 109/ l monosit sayısı ve kemik iliğinde >%20 blast şarttır. Sitogenetik anomali olarak monozomi 7/del(7q) sıktır (%6-33). Prognozu kötüdür. Agresif bir klinik gidiş gösterir ve medyan sürvi süresi <12 aydır. Tedavi çok zordur. Relaps oranı ~%50’dir. Tek küratif tedavi allojenik KHT’dir ve hastaların ~%50’si iyileşir (57, 58). 2.6.3. Lösemilerde Tedavi Lösemilerin tedavisi, destekleyici tedavi, kemoterapi, kemik iliği nakli ve kök hücre nakli gibi tedavi yaklaşımlarından oluşur. 1) Destekleyici Tedavi: Eritrosit, trombosit süspansiyonları verilmesi, hastaların izolasyonu, enfeksiyonlara karşı proflaksi ve tedavi, hiperlökositoz ve tümör lizis sendromu karşısında uygun tedavi, hasta ve ailesine psiko-sosyal destek verilmesi, ilaç yan etkilerinin tedavisi gibi yaklaşımları içerir (52). 2) Kemoterapi: Anti-lösemik ilaçlar kullanılır. Tedavi şeması; İndüksiyon (remisyon sağlama), idame (sağlanan remisyonun devamlılığı), konsolidasyon (remisyonu sağlamlaştırma) tedavilerinden oluşmaktadır (52). 3) Relaps (Nüks): Nüks etmiş hastalarda (hastalığın yeniden belirmesi) sağ kalım oranı yeni tanı almış hastalara göre oldukça düşüktür. Nüks tedavisi için genellikle daha önce verilmiş olan tedavi protokolünden daha yoğun bir protokol seçilir (52). 29 4) Kemik İliği Transplantasyonu (KİT): Önce yoğun kemoterapi ve vücut ışınlaması ile lösemik hücrelerin tümü yok edilmeye çalışılır. İliğin reddini önleyici, immunosüpresyonu da sağlayan ön tedaviden sonra otolog veya allojenik şeklinde ilik nakli yapılır (52). 5) Allojeneik Hematopoietik Kök Hücre Nakli (AHKHN): Lösemilerde hala küratif yaklaşım olarak güncelliğini korumaktadır. Özellikle erken kronik faz ve iyi risk grubundaki hastalarda uzun dönem hastalıksız ve toplam sağkalım görülmektedir (59). Ancak kök hücre transplantasyonuna eşlik eden uzun dönem morbitide ve mortalite nedeniyle transplantasyonla ilişkili ölümü etkileyen faktörleri iyi tanımlamak gerekir. Genç hastalarda (< 45 yaş), erken kronik faz ve HLA-uygun kardeş vericisi olanlarda AHKHN iyi seçenek olarak görülmektedir. Lösemilerin eradikasyonunda graft versus lösemi etkisinin rolü bilinmesinden sonra (59-61), günümüzde transplantasyona eşlik eden toksisiteyi azaltmak için azaltılmış yoğunlukta hazırlık rejimleri ile allojeneik transplantasyona doğru eğilim gözlenmektedir. 2.7. KÖK HÜCRE ÇALIŞMALARINDA ETİK SORUNLAR VE YASAL BOYUT 2.7.1. Kök Hücre Araştırmalarına İlişkin Etik Sorunlar Kök hücre araştırmalarındaki etik sorunların temelinde, kök hücrenin elde edildiği kaynağın (erişkinler, kordon kanı, fötal doku ve embriyonik doku) farklı olması yer almaktadır. Embriyonik kök hücreler, tedavi amaçlı kullanım açısından en iyi kaynak olarak düşünülse de, bu durumun bilimsel çalışmalar sonucunda değişebileceği bildirilmektedir. Şu an için in vitro fertilizasyon süreçleri sonucunda oluşan artık/fazlalık embriyoların veya düşükler yoluyla ortaya çıkan fetüslerin, kök hücre elde etmek amacıyla kullanılıp kullanılamayacağı sorgulanmaktadır. Bu soruya olumlu yanıt verilmesi halinde ise sadece kök hücre araştırması amacıyla kullanılmak üzere embriyo üretiminin yaratabileceği etik sorunlar gündeme gelmektedir. Bununla birlikte, erişkinlerden kök hücre elde edilmesi ve üzerinde araştırma yapılmasına ilişkin etik sorunlarında olduğu bildirilmektedir (62). European Group on Ethics (EGE), kök hücre araştırmalarında kadın haklarının önemine de dikkat çekmekte ve kadınların hassas bir konumu olduğunu vurgulamaktadır. Çünkü embriyonik ve fötal dokunun en yakın 30 kaynağı olmaları nedeniyle kadınların baskı ve risk altında kalabileceği belirtilmiştir (62). A. Embriyolardan Elde Edilen Kök Hücrelerin Kullanımına İlişkin Etik Sorunlar Embriyoların kök hücre elde edilmesi için kullanılmasına ilişkin en temel etik sorunlarından biri, embriyoya birbirinden farklı ahlaki statülerin atfedilebiliyor olmasıdır. Embriyodan kök hücre elde edilmesi için uygulanan süreçte embriyonun “hayatı” sona ermektedir; bu nedenle, embriyonun oluşumundan itibaren erişkin bir insan gibi saygı görmesi gerektiğini düşünenler için embriyo üzerinde kök hücre araştırması yapılması kabul edilemez bir uygulama olmaktadır. Diğer taraftan, anne rahminde olmayan bir embriyonun artık büyüme ve erişkin bir kişi haline gelme potansiyelinin bulunmadığını ileri süren diğer bakış açısına göre, embriyonik kök hücre araştırmaları en azından kuramsal boyutta bir etik sorunu barındırmamaktadır. Bu nedenle, embriyoların kök hücre elde edilmesi amacıyla kullanımına ilişkin benimsenmiş bir görüşten bahsetmek güçtür (62). Embriyoya atfedilen ahlaki değer ya da statü, dinlerin sunduğu bakış açılarından önemli ölçüde etkilenmektedir. Özellikle Batılı kaynaklarda yer alan ve kürtajı -hatta kimi zaman in vitro fertilizasyon uygulamalarını da- ahlaki açıdan kabul edilemez bulan din temelli görüşler, doğal olarak embriyonik kök hücre araştırmalarına da olumsuz bakmakta ve erişkin kök hücrelerine ilişkin araştırmalara ağırlık verilmesi gerektiğini savunmaktadırlar. Ayrıca, kişilerin kendi değer yargıları doğrultusunda insan embriyosuna farklı düzeyde değer atfedebilmesi de mümkün olmaktadır. Ancak, bu durum, konuya ilişkin etik tartışmaların da kolaylıkla çıkmaza saplanmasına yol açabilmektedir. Öyle ki embriyonun söz konusu statüsüne ilişkin herkesin üzerinde uzlaşmaya varacağı bir fikir birliği sağlanmasının çok güç olduğuna dikkat çeken bazı yazarlar, bu sorun yerine embriyoya ilişkin diğer noktalara odaklanılması ve embriyonik kök hücre araştırmalarının bu doğrultuda savunulması yönünde bir yaklaşımı benimsemiştir. Bu yaklaşımda belki de en önemli nokta, in vitro fertilizasyon uygulamaları sonucunda veya düşükler nedeniyle ortaya çıkan fazlalık embriyo ya da fetüs materyalinin ziyan edilmesi yerine insanlığın yararına olacak bir şekilde kullanılmasının daha iyi olacağı iddiasıdır. John Harris ve arkadaşları, bu yaklaşımı “israfın önlenmesi ilkesi” başlığı altında savunmaktadırlar. Kök hücre araştırmalarının Parkinson hastalığı, diabetes 31 mellitus vs. gibi insan sağlığı ve yaşamı için çok ciddi sorun teşkil eden pek çok hastalığın tedavisinde umut vadeden bir konumda olması da, insanlığın faydasını temel alarak embriyonik kök hücre araştırmalarını savunan bu bakış açısını desteklemektedir. Ek olarak, kök hücre çalışmaları sayesinde ileride “kişiye özel üretilmiş” (tailormade) organ veya dokuların kullanıma girmesi gibi olasılıklar da bulunmaktadır. Bu gibi olasılıkların daha somut hale gelmesi durumunda, kök hücre çalışmalarının özellikle canlı vericiden organ nakline ilişkin etik sorunları ortadan kaldırabilecek tedavi seçenekleri sunabileceği de düşünülmektedir (62). Embriyonik kök hücre çalışmalarındaki bir sonraki basamak olarak da nitelenebilecek olan “sadece kök hücre elde edilmesi amacıyla embriyo üretilmesi” fikri, şu an için çözümü daha güç bir sorun olarak gözükmektedir. İsrafın önlenmesine ilişkin ilke de, sadece araştırma amaçlı olarak embriyo üretilmesi fikrinin savunulmasında geçersiz hale gelmektedir. Bu konuya ilişkin kesin bir değerlendirme yapılmasının ne derece güç olduğu, kısaca “Oviedo Sözleşmesi” olarak da bilinen Sözleşmenin 18’inci maddesinde belirtilen ifadede de görülmektedir. Embriyo üzerinde araştırmayı yasaklamadığı, söz konusu maddesinin ilk paragrafından da anlaşılan bu sözleşme, sadece araştırma amacıyla embriyo üretilmesi fikrine ise son derece katı bir bakış açısı ile yaklaşmış ve kesin bir biçimde yasak getirmiştir. Bu nedenle, kimi ülkeler sözleşmeyi imzalamama yoluna giderek (bazı ülkeler sözleşmenin embriyo üzerinde araştırmayı tümden yasaklamıyor olması nedeniyle, bazı ülkeler ise tam tersi nedenden, yani araştırma amaçlı embriyo üretilmesine izin verilmiyor olması nedeniyle) kendi düzenlemelerini oluşturmayı seçmiştir. Gelecekte kök hücre çalışmalarında elde edilecek olan sonuçlar doğrultusunda konuya ilişkin bakış açısının değişebileceği de belirtilmiştir (62). B. Erişkinlerden Elde Edilen Kök Hücrelerin Kullanımına İlişkin Etik Sorunlar Embriyoların ahlaki statüsüne ilişkin belirsizlik nedeniyle yaşanan sorunlara kıyasla, erişkinlerden kök hücre elde edilmesi ve bu hücreler ile araştırma yapılmasının etik açıdan daha az sorun içerdiği düşünülebilir. Ancak, erişkinlerden kök hücre alınması söz konusu olduğunda da biyomedikal araştırmalara ilişkin temel etik ilkelerin geçerli olması gerektiği unutulmamalıdır. İnsan gönüllüler ile yapılan tüm araştırmalarda olduğu gibi bu alanda da aydınlatılmış onam ilk ve en önemli koşuldur. Bu nedenle potansiyel gönüllülerin doğru ve yeterli bir biçimde bilgilendirilmeleri ve gönüllülüklerinin sağlanması esastır. Ek olarak, bireylerin mahremiyetine saygı 32 çerçevesinde gönüllülerin kişisel bilgilerinin gizliliğinin sağlanması ve kişilerin izinleri doğrultusunda, uygun bir biçimde kullanılmasının zorunlu olduğu da unutulmamalıdır. Bir başka deyişle, embriyo kökenli olmayan kök hücre araştırmalarında da araştırma etiğinin tüm gereklerinin yerine getirilmesi gerektiği bildirilmektedir (62). C. Kök Hücre Çalışmalarında Hayvanların Kullanımına İlişkin Etik Sorunlar Kök hücre çalışmaları başladığından bu yana çalışmaların büyük bir bölümü, deney hayvanları ile gerçekleştirilmektedir. Buna karşın; etik tartışmaların merkezinde daha çok insanlar yer almış ve insanların yaşayabileceği olası sorunlara odaklanılmıştır. Bu durum, hayvanların bu araştırmalardaki konumuna ilişkin yeterince duyarlı davranılmadığını düşündürmektedir. Bu nedenle, konunun yalnızca insana odaklı olmayan daha geniş bir perspektifte ele alınması gerekmektedir. Çünkü hayvanlar ile gerçekleştirilen çalışmalar, bilim dünyasına katkı yapmakla kalmamış; düşük başarı oranına karşın yüksek genetik bozukluklarla sonuçlanan çalışmaların büyük bir bölümü deney hayvanları ile gerçekleştirildiğinden, söz konusu uygulamaların - şimdilik insanda tedavi amaçlı olarak dahi kullanımının kısıtlanmasına da hizmet etmiştir (62). Diğer taraftan, uzun vadede kök hücre çalışmalarının “deney hayvanı kullanım etiğine” temel oluşturan 3R ilkelerinden (Replacement, Reduction, Refinement – yerine koyma, azaltma ve arındırma) en azından ikisinin uygulanabilmesini sağlama olasılığı da bulunmaktadır. Tedavi amaçlı klonlama tekniği ile insan embriyonik kök hücreleri elde edilmesi yönteminin yaygın olarak kullanımına geçilmesi durumunda, çeşitli hastalıkların tedavisinde, hastanın doğrudan kendi hücrelerinden yararlanılacak olması; bu uygulamalar için deney hayvanlarının kullanımını büyük ölçüde engelleyebileceği (yerine koyma ilkesi) gibi, hayvan kullanımını gerektiren durumlarda, kullanılacak hayvan sayının daha aza indirgenmesini de (azaltma ilkesi) olanaklı hale getirebilecektir (62). 2.7.2. Kök Hücre Araştırmalarında Yasal Boyut Ülkelerin yasal düzenlemelerinde, kök hücre araştırmaları için birbirinden farklı yaklaşımlar gözlenmektedir. Kimi ülkeler, araştırmalar ile ilgili oldukça sınırlayıcı bir yaklaşım içerisinde iken kimi ülkeler ise, görece daha az sınırlayıcı yasal düzenlemelere yer vermiştir. Kimi ülkeler de kök hücre araştırmalarına çok daha serbest bir alan yaratacak yasal düzenlemelere sahiptir. Kök hücre araştırmalarının felsefi ve etik açıdan tartışıldığı biyoetik gibi pek çok alanda embriyonik kök hücre araştırmaları ile erişkin 33 kök hücre araştırmaları ayrımı önem taşımaktadır. Aynı ayrımın hukuk açısından da önem taşıdığını belirtmek gerekir. Kök hücre araştırmaları ile ilgili yasal düzenlemelerin oluşturulmasında “embriyonun statüsü” nedeniyle embriyonik kök hücre araştırmaları ile ilgili tartışmaların yoğunluğu dikkat çekicidir. Bu durum, Avrupa Birliği ülkelerinin yasal düzenlemelerinde de kendini göstermektedir (63). A. Avrupa Birliğinde Durum Embriyoların araştırma amaçlı kullanımında, bu uygulamanın yasaklanması ya da belirli ilkeler çerçevesinde serbest bırakılması, üye ülkelerin kararına bırakılmıştır. Bu bağlamda, Birlik üyeleri embriyoya tanıdıkları statü çerçevesinde, konu ile ilgili farklı yaklaşımları içeren yasal düzenlemelere sahiptir (64). Avrupa Birliği Komisyonu’nda embriyo üzerindeki araştırmaların sınırının nerede olduğu ve koşullarının neler olması gerektiği konusunda henüz bir görüş birliği yoktur. Ancak bu alandaki hızlı gelişmeler, yakın zamanda üye ülkelerdeki uygulamalar arasında bir uyum çalışması yapılmasını gündeme getirmesi beklenmektedir. Avrupa Birliği’ne üye ülkeler arasında, embriyoyu bir laboratuar ürünü olarak gören bir eğilim yoktur. Ancak embriyoya, gelişimine paralel olarak daha çok koruma sağlanmaktadır. Başka bir deyişle, Avrupa Birliği’ne üye ülkeler arasında embriyoya, genellikle döllenme anından itibaren “yaşama hakkı” tanınmamakla beraber; belli koşulların sağlanması durumunda “bir insan olarak gelişme potansiyeline sahip” olarak görülmekte ve bu bağlamda embriyoya bir “değer” yüklenmektedir. Yalnızca araştırma amacı ile embriyo oluşturulmasını planlayan araştırmaların yasaklanması konusunda bir bir düşünce bulunmaktadır. Avrupa Birliği’nde embriyo araştırmalarının öjenik, yani genetik seçicilik yönünde kullanılması yasaklanmıştır. EGE embriyo araştırmalarına izin verilen ülkelerde her araştırma talebinin ayrıntılı olarak, şeffaf şekilde, tek tek inceleneceği etkin bir toplumsal kontrol düzeninin olması gerektiğini vurgulamaktadır (65). Avrupa Birliği Ülkelerindeki yasal durum aşağıdaki gibi özetlenebilir: 1. Üremeye yardımcı teknoloji uygulamaları sırasında elde edilen fazla embriyolardan (supernumerary embryo) kök hücre elde edilmesine bazı koşullarda izin veren ülkeler (Finlandiya, Hollanda, İngiltere, İsveç, Yunanistan) (Belçika, Danimarka, Fransa, İspanya da bu eğilimi taşıyan yasa taslakları bulunmaktadır) 34 2. Üremeye yardımcı teknoloji uygulamaları sırasında elde edilen fazla embriyolardan (supernumerary embryo) kök hücre elde edilmesini yasaklayan ülkeler (Almanya, Avusturya, Danimarka, Fransa, İrlanda) 3. Embriyo üzerinde araştırma yapılmasını yasaklayan ülkeler (Polonya, Slovak Cumhuriyeti) 4. Embriyo üzerindeki araştırmalara sınırlı olarak izin veren ülkeler (İzlanda, Letonya, Litvanya, Macaristan) 5. Embriyo araştırmaları ve insan kök hücreleri ile ilgili yasal düzenlemesi bulunmayan ülkeler (Belçika, Çek Cumhuriyeti, İtalya, Kıbrıs Rum Kesimi, Lüksemburg, Malta, Portekiz) 6. Kök hücre elde etmek için insan embriyosu oluşturulmasına izin veren ülkeler (İngiltere) (62). B. Türkiye’de Yasal Durum Türk hukukunda kök hücre ile ilgili uygulamaları düzenleyen yasa düzeyinde bir düzenleme bulunmamaktadır. Kök hücre araştırmaları konusunda, Türkiye’deki yasal çerçeveyi belirlemek için genel içerikli hükümlerden hareket edilmesi ve Sağlık Bakanlığı’nın konu ile ilgili olarak 2005 yılında yayımladığı bir Genelge ve 2006 yılında yayımladığı Kılavuzun incelenmesi gerekmektedir. Kök hücre araştırmaları ile erişkin kök hücre araştırmaları arasındaki ayrım, Türk hukuku açısından da önem taşımaktadır. Türkiye’de konu ile ilgili olarak Sağlık Bakanlığının yayımladığı Genelgede ve Kılavuzda da bu ayrıma yer verilmiştir. Bu nedenle, Türkiye’de kök hücre araştırmalarının yasal boyutunun tartışılmasında bu ayrımdan hareket edilmesi, konu ile ilgili tespitleri kolaylaştıracaktır (62). 1. Erişkin Kök Hücreleri Araştırmaları Ülkemizde erişkin kök hücre araştırmalarının yapılmasını düzenleyen herhangi bir yasal düzenleme bulunmadığı gibi, erişkin kök hücre araştırmalarının yapılmasını engelleyen herhangi bir düzenleme veya hüküm de mevcut değildir. Erişkin kök hücre çalışmalarının yapılabilmesi için tıbbi araştırmalar için gereken koşulların yanında Sağlık Bakanlığı’nın 2006 yılında yayımladığı Embriyonik Olmayan Kök Hücre Çalışmaları Kılavuzunda yer alan kurallara da uyulması gerekir. Söz konusu Kılavuz, klinik amaçlı ve embriyonik olmayan kök hücre çalışmalarını (deneysel tedavi 35 girişimlerini) düzenlemektedir. Kılavuzda, bu çalışmaların yapılabileceği yerler ve bu çalışmaların yapılabilmesi için alınması gereken onaylar konularına yer vermiştir. Kılavuzda, kök hücre çalışmalarının yapılabileceği yerlerin belirlenmesi ve hazırlanan çalışmaların değerlendirilmesi için bir merkezi kurulun (Kök Hücre Nakilleri Bilimsel Danışma Kurulu) kurulması öngörülmektedir. Bununla beraber kök hücre çalışması yapmaya izin verilmiş merkezlerde kö khücre çalışmalarını değerlendirmek amacı ile etik kurulların oluşturulması da öngörülmektedir (62). 2. Embriyonik Kök Hücre Çalışmaları Türk hukukunda embriyonik kök hücre çalışmaları konusunda herhangi bir düzenleme bulunmamaktadır. Ancak, Sağlık Bakanlığının 2005 tarihli “Embriyonik Kök Hücreler Genelgesinde” embriyonik kök hücre ile ilgili araştırmaların durdurulması kararı bildirilmiştir. Bu bağlamda, konu ile ilgili çalışmalar sonuçlanana kadar embriyonik kök hücre çalışmaları durdurulmuştur. Embriyonik kök hücre çalışmalarının ülkemizdeki yasal çerçevesinin belirlenmesinde ve oluşturulmasında aşağıda sıralanan önemli konuların yasal açıdan belirlenmesi gereklidir. • Ana rahmi içerisindeki döllenmiş insan yumurtasının (embriyo/fetüsün) konumu, • Ana rahmi dışındaki embriyoların araştırma amaçlı kullanılabilmesi, • Doğal olmayan yöntemler ile araştırma amaçlı embriyoların oluşturulması (66). 3. TARTIŞMA VE SONUÇ Son yıllarda çok önemli gelişmelerin olduğu ve büyük başarıların yaşandığı pediatrik hematoloji – onkoloji alanında, kök hücre nakli, “şifa sağlayıcı” özelliği de göz önüne alındığında, en önemli tedavi yöntemlerinden biri olarak ön plana çıkmaktadır. Değişik uygulama alanları ve yöntemleri kök hücre naklini daha da araştırmaya açık ve gelecek için ümit verici hale getirmektedir. IBMTR ve EBMTR gibi kuruluşların veri toplama ve değerlendirmeleri, verici bankalarının hızla genişlemesi ve integrasyonu önemli katkılar sağlamıştır. Son yıllarda kemik iliği yerine periferik kök hücre, kordon kanı vb uygulamaları da önemli aşamalar sağlamıştır. Ülkemizde de bu amaçla uzun yıllardır hem erişkin hem de çocukta önemli çalışmalar yapılmakta ve dünya düzeyinde önemli sonuçlar alınmaktadır. Geçmişi 1970’lere dayanan pediatrik kök hücre naklini halen 13 merkez uygulamaktadır ve bugün artık dünya standartlarında sağ kalım oranlarına ulaşılmıştır. Kaufman ve arkadaşlarının yaptığı bir çalışmada kordon kanı kök hücrelerinin hematopoetik öncül hücrelere farklılaşabileceği gösterilmiştir (67). Brüstle ve arkadaşları kordon kanı kök hücresi kaynaklı nöral öncül hücreleri, fetal sıçanın ventriküllerine implante etmişlerdir (68). Bu çalışmayla, tamamen in vitro ortamda üretilen sinir öncül hücrelerinin hücre göçüne ve farklılaşmasına rehberlik eden 37 çevresel sinyallere cevap verebildiği ve merkezi sinir sistemindeki nöronal ve gliyal hücre serilerini tekrardan yerine koyma potansiyeline sahip olduklarını gösterilmiştir. Bu açıdan değerlendirildiğinde KKKHT’nun erişkin merkezi sinir sistemindeki birincil ve ikincil demiyelinizasyon rahatsızlıklarının tedavisinde pratik bir yaklaşım olabileceği ifade edilmiştir (68). Çocukluk çağında akut lösemilerin kemoterapi protokollerinde ve sonuçlarında önemli gelişmeler kaydedilmiştir. Yoğun induksiyon, konsolidasyon ve idame tedaviler ile survi artmıştır. Ancak lösemilerin bazı alt grupları ile kötü prognostik faktörü olanlarda; nüks gösterenlerde sonuçlar kötüdür. Bu nedenle, alternatif bir tedavi şekli olan KKT gündeme gelmiştir. İlk kez, 8 farklı bebekten elde edilen kordon kanının nakledilmesiyle bir lösemi hastasının tedavi edilme girişimi gerçekleştirilmiştir. Hasta 16 yasında bir erkek olup, GVHH gelişmedi, fakat engrafman sadece geçici bir sure gerçekleşmiş ve hastanın kendi kemik iliği yeniden faaliyete geçmiştir. Daha sonra, ALL için uygulanan konvansiyonel tedavi ile hasta başarılı bir şekilde tedavi edilmiştir (69). 1988-1996 yılları arasında 45 merkezde gerçekleştirilmiş 78 aile içi ve 65 aile dışı olmak üzere toplam 143 KKKHT’nun sonuçları yayımlanmıştır. Sonuçta, özellikle aile içi nakiller için kordon kanının, pediatrik ve eriksin hastalar için alternatif bir kök hücre kaynağı olduğu öngörülmüştür (40). İtalya ‘da gerçekleştirilen, 11 aile içi (HLA-uyumlu kardeşten) ve 12 aile dışı olmak üzere toplam 23 KKKHT ile 23 tam uyumlu KİT’in karşılaştırmalı sonuçları yayımlanmıştır. Uygulama sonucunda, GVHH oranlarında azalmanın yanında, birçok parametre yönünden KKKHT’nın KİT ile karşılaştırılabilir olduğu sonucuna varılmıştır (70). Çocukluk cağındaki 95 AML hastasına gerçekleştirilen KKKHT sonuçları yayımlanmıştır. Oldukça kötü prognozlu AML’li çocuklar için şayet HLA uyumlu verici ya da kardeş bulmada güçlük söz konusu ise, KKKHT’larının tedavide yeri olduğu vurgulanmıştır (71). Ooi ve arkadaşları 18 erişkin AML’li hastaya aile dışı KKT sonuçlarını yayımlamışlardır. 14 hastanın nakil sonrası 185-1332 gün arasında hastalıksız olarak yaşamlarını sürdürdüğü ve 2 yılık hastalıksız yaşam oranının %76 olduğu bildirilmiştir. 38 Bu sonuçlar, erişkin AML’li hastaların aile içi ve dışı uygun kemik iliği vericisi bulunamadığında KKKHT’nin aday olabileceğini göstermektedir (72). “Avrupa Kordon Kanı Transplantasyon Kayıt Sistemi (Eurocord)” kayıtlarına göre 2000 yılı itibariyle aile içi bireylerden kordon kanı kullanılarak toplam 138 çocuğa KKKHT uygulanmıştır (37). Bunların 114’ü doku tipi tam uygun olup 24’ünde 1-3 antijen uygunsuzluğu vardır. Bu hastalarda kullanılan hazırlama rejimleri yaşa ve primer hastalığa bağlı olarak değişim göstermekle birlikte GVHH profilaksisi olarak genellikle sadece siklosporin (CsA) kullanılmıştır. Median yaşı 5 yıl (0-14 yaş aralığı) olan bu hasta grubunun median izlem süresi 41 aydır. İki yıllık yaşam oranı malinitelerde %46, aplastik anemilerde %76, hemoglobinopatilerde %100 (%35’inde thalasemik geri dönüş), ve metabolik hastalıklarda %79 olarak bulunmuştur. Transplantasyon sonrası nötrofil engraftmanı %83± 4 olguda median 26 günde (8-60 gün) gelişmiştir. Akut GVHH %20 ve kronik GVHH %6 hastada gelişmiştir. Bu hasta grubu içindeki ileri evre lösemi hastalardaki en önemli mortalite nedenini relaps oluşturmaktadır (39, 40). Çocuk hastalara doku tipi tam uygun kardeşlerden uygulanan KKT ile KİT sonuçları GVHH riski, hematopoetik engraftman zamanı ve yaşam şansları açısından karşılaştırmak için “Eurocord kordon kanı transplantasyon kayıt sistemi” ile “uluslararası kemik iliği transplantasyon kayıt sistemi”nin verileri kullanılarak karşılaştırmalı bir çalışma yapılmıştır (39). Bu çalışmada 1990-1997 yılları arasında çocuk hastalara tam uygun kardeşlerden yapılan 113 KKT ile 2052 KİT sonuçları karşılaştırılmıştır. Bu çalışmadaki KKT uygulanan hastaların KİT uygulanan hastalara göre daha küçük yaşta (median 5 ve 8 yıl, p<0.001), daha düşük ağırlıkta (median 17 ve 26 kg, p<0.001), daha yüksek oranda donör ile ABO kan grubu uygunsuzluğu olduğu (%25 ve %15, p<0.001) ve GVHH için daha az sıklıkta MTX kullandıkları (%28 ve %65, p<0.001) izlenmiş. Bu hastalara verilen median çekirdekli hücre miktarı KKT’de KİT’e göre çok daha düşüktür (0.47 x 108/kg ve 3,5 x 108/kg, p<0.001). Yapılan multivaryasyon analizine göre KKT uygulanan hastalarda akut GVHH oranının (rölatif risk,0.41;P = 0.001) ve kronik GVHH oranının (rölatif risk, 0.35; P = 0.02) KİT’e göre daha düşük olduğu gösterilmiş. KKT uygulananlarda ilk 1 ay içindeki nötrofil engraftmanın (rölatif risk, 0.40; p<0.001) ve trombosit engrafmanının (rölatif risk, 0.20; p<0.001) KİT’e göre daha geçikmiş olduğu fakat genel (overall) yaşam oranının her iki grupta benzer olduğu (P = 0.43) görülmüştür. Özet olarak, bu en kapsamlı çalışmada tam uygun kardeşlerden uygulanan KKT’larında GVHH riskinin KİT’e göre daha düşük olduğu, nötrofil ve 39 trombosit engraftmanının daha geç olduğu ve yaşam oranlarının çok benzer olduğu gösterilip kordon kanının kemik iliğine alternatif bir kök hücre kaynağı olarak kabul edilebileceği sonucuna varılmıştır. Türkiye’de günümüze kadar 12 merkezden toplam 284 lösemi olgusuna transplantasyon yapılmıştır. İbni Sina Hastanesi Kan ve Kemik İliği Transplantasyon Ünitesinde 148 lösemi allojenik hematopoetik kök hücre nakli olgusunda transplantasyon sonrası 5 yıllık hastalıksız sağ kalım %53±6 ve toplam sağ kalım ise %59±6’dır. Aynı merkezden yayımlanan bir çalışmada ise allojenik hematopoetik kök hücre nakli ile hem interferon hem de imitanibe göre daha fazla sayıda hastada moleküler yanıtların kısa sürede elde edildiğidir (56). “Eurocord” kayıtlarına göre 2000 yılı itibariyle aile dışı bireylerden kordon kanı kullanılarak toplam 291 çocuğa KKT uygulanmıştır. Bu hastaların çoğunluğunu akut lösemi hastaları (ALL=107 ve AML=50), doğuştan metabolizma hastalıkları (n=61) ve kemik iliği yetmezlikleri (n=28) oluşturmaktadır. Donör ile doku tipi sadece 50 hastada tam uygun, %83 hastada ise 1-4 antijen uygunsuzdur. Median yaşı 5 yıl (0.2-15 yıl arasında) olan bu hastalara verilen median çekirdekli hücre sayısı 4.5 x 107/kg (0.636.0) olup hastaların median izlem süresi 21 aydır (1-64 ay). Bu hastaların KKT sonrası hastalıksız yaşam oranı malign hastalıklarda %36, kemik iliği yetmezliklerinde %21 ve doğuştan metabolizma hastalıklarında %51’dir. Nötrofil engraftmanı transplant sonrası 60’ncı günde olguların %82’sinde median 29 günde (10-60 gün) gelişmiş ve akut GVHH insidansı %39 bulunmuştur (37). Akut lösemili çocuk hastalara aile dışı donörlerden (unrelated) uygulanan KKT ve KİT sonuçlarını karşılaştırmak amacı ile çok merkezli, retrospektik bir çalışma yapılmıştır. Bu çalışmada akut lösemili toplam 541 çocuğa uygulanan 99 KKT, 180 T-hücre deplesyonu sonrası kemik iliği transplantasyonu (T-KİT) ve 262 KİT sonuçları hasta, hastalık ve transplantasyona ait değişkenler göz önüne alınarak karşılaştırılmıştır. Bu 3 grup arasında doku uygunluğu belirgin farklılık göstermektedir; doku tipi uygunsuzluğu kordon kanı transplantasyonlaının %92’si, T-KİT’lerin %43’ü ve KİT’lerin ise sadece %18’inde vardır. Risk faktörleri göz önüne alınmadan bu 3 grup karşılaştırıldığında 2yıllık hastalıksız yaşam KKT, T-KİT ve KİT gruplarında sırası ile %31, %37 ve %43 oranında bulunmuştur. Ancak prognostik değişkenlere göre hesaplandığında 3 grup arasında hastalıksız yaşam açısından belirgin bir fark izlenmemiştir. Tüm değişkenler 40 göz önüne alındığında KKT’de KİT’e göre hematopoietik engraftmanın daha geç olduğu (HR=0.37; p<0.001), transplanta bağlı mortalitenin daha yüksek olduğu (HR=2.13; p<0.01) ve akut GVHH’nın daha az olduğu (HR=0.50; p<0.001) görülmüştür. T-hücre deplesyonu uygulanmış KİT alıcılarında ise deplesyon uygulanmamış KİT alıcılarına göre akut GVHH’nın daha az (HR=0.25; p<0.0001) ve relaps riskinin ilk 100 gün içinde daha fazla (HR=1.96; p<0.02) olduğu izlenmiştir. Kronik GVHH T-KİT ve KKT sonrası daha az (p<0.0001 ve p<0.002) olarak gelişmiş ve mortalite genelde T-KİT grubunda daha yüksek oranda izlenmiştir (p<0.07). Özet olarak, prognostik değişkenler göz önüne alındığında bu 3 grubun uzun dönemde birbirlerine hiçbir üstünlüğü yoktur. KKT sonrası engraftmandaki geçikme ve transplanta bağlı mortalite oranında artma, KİT sonrası daha yüksek oranda gelişen GVHH ile dengelenmektedir. Sonuç olarak bu kapsamlı çalışma, kordon kanının tam uygun kemik iliği bulunamayan akut lösemili çocuklar için çok uygun bir kök hücre kaynağını oluşturacağını göstermektedir. Bu çalışmanın desteklediği, KKT sonrası GVHH riskinin daha az olmasına karşın lösemi hastaları için artmış bir relaps riskinin olmadığı bulgusu ileride daha fazla transplant sayısı ile yapılacak karşılaştırmalı çalışmalar ile de desteklenirse kordon kanının immün sistemin immatür olmasına karşın içerdiği normal fonksiyona sahip NK hücreleri veya diğer hücreler ile antilösemik etkiyi gösterbildiği kanıtlanmış olacaktır (41). Juvenil Myelomonositik Lösemi konusunda, yakın zamanda yapılan bir çalışmada, HLA uygun akraba vericiden veya akraba dışı tam uyumlu veya 1 antijen uyumsuz vericiden yapılan allojenik hematopoetik kök hücre naklinde lösemisiz yaşam %50 civarındadır. >4 yaş ve kız hasta daha kötüdür. Son yıllarda, MUD da kardeş nakilleri kadar başarılıdır. Monozomi 7(+) olanlar daha kötü prognozludur ve genelde %50 hasta da relaps gelişir (57). Yakın zamanda yapılan bir başka çalışmada da aile dışı bireylerden yapılan tam uygun KİT’ler ile 0-3 antijen uygunsuz KKT’ler uygun-çift (matched-pair) analizi yapılarak karşılaştırılmış ve çocuk hastalar için uygun bir seçenek olduğu sonucuna varılmıştır (42). “Eurocord” kayıtlarına göre 2000 yılı itibariyle aile dışı bireylerden kordon kanı kullanılarak toplam 108 erişkin hastaya KKT uygulanmıştır. Median yaşı 26 yıl (15-53 yıl) ve median ağırlığı 60 kg (35-110 kg) olan bu hasta grubuna median 1.7 x 107/kg 41 (0.2-6.0) çekirdekli hücre verilmiş ve median 20 ay (0.6-60 ay) takip edilmiştir. Bu hastaların 32’si ALL, 23’ü AML, 37’si KML, 12’si MDS ve 4 ‘ü non-Hodgkin lenfoma tanısı ile izlenmekte ve KKT’u öncesi 20’sine otolog KİT uygulanmış fakat başarısız olmuştur. Sadece 6 hastaya doku tipi tam uygun kordon kanı verilmiştir, diğerleri 1-3 antijen uygunsuzdur. Bir yıllık yaşam oranı, tüm hastalar için %27 olup kronik faz KML ve 1-2’nci tam remisyondaki akut lösemi hastaları için %39 ve ileri evredekiler için %17’dir. Nötrofil engraftmanı transplant sonrası ilk 60 günde olguların %81’inde median 32 günde (13-60 gün) gerçekleşmiştir. Verilen çekirdekli hücre sayısının 1.7 x 107/kg’dan daha fazla olması nötrofil engraftmanını çok olumlu olarak etkilemiştir (p = 0.01). Akut GVHH insidansı %38 olarak bulunmuştur ve en sık ölüm nedenlerini enfeksiyon ve GVHH oluşturmuştur. Relaps oranı düşük olmakla birlikte izlem süresi çok kısadır. Sonuç olarak, kordon kanının doku tipi tam uygun kemik iliği donörü olmayan erişkin hastalar için de uygun bir seçenek oluşturduğu kabul edilmektedir. Ancak transplanta bağlı mortaliteyi etkileyen en önemli faktörün (p = 0.004) verilen çekirdekli hücre miktarının (< 2.0 x 107/kg) olması, kordon kanının erişkinler için kullanımı kısıtladığı düşünülmektedir. Bu engeli aşabilmek için kordon kanının ex vivo ekspansiyonu veya birden fazla farklı kordon kanının bir arada verilmesi gündeme gelmiş ve klinik çalışmalar başlamıştır (37). Günümüzde kordon kanı hücrelerinin ex vivo ekspansiyonun klinik önemini araştırmak için yapılmış olan toplam 3 çalışmanın ön bulguları yayınlanmıştır (35). Bu çalışmaların en kapsamlısı olan Kurtzberg ve arkadaşlarının yaptığı çalışmada toplam 28 hastaya myeloablatif tedaviden sonra kordon kanının yarısı herhangi bir işlem uygulanmadan verilirken diğer yarısı PIXY, Flt-3L ve EPO gibi büyüme faktörleri ile toplam 12 gün ex vivo ekspansiyon uygulandıktan sonra verilmiştir. Sonuç olarak ex vivo ekspansiyon uygulanmış kordon kanının iyi tolere edildiği fakat myeloid, eritroid ve trombosit engraftmanı açısından tarihsel kontrollere göre belirgin bir farkın olmadığı bulunmuştur. Sadece bir çalışmada ex vivo ekspansiyonun trombosit engraftmanını biraz hızlandırdığını destekler bulgular elde edilmiştir (35). Sonuç olarak günümüzde kordon kanının ex vivo ekspansiyonunun klinik olarak olumlu etkilerinin olduğunu destekler yeterli hiçbir veri olmamasına karşın zaman içinde bazı olumlu gelişmelerin sağlanması umut edilmekte ve çalışmalar sürmektedir (73). Bu nedenlerle kordon kanının toplanması, volüm azaltılması, dondurulup saklanması ve çözülerek 42 verilmesinde kullanılan tekniklerin, kordon kanında en fazla hücre elde etmeyi sağlayacak şekilde geliştirilmesinin pratik anlamda çok önemi vardır. Kordon kanının Ex-Vivo ekspansiyonuna alternatif olarak birden fazla kordon kanının birlikte kullanımı düşünülmüştür. Bu yaklaşım ilk olarak 1972 yılında denenmiş ve akut lenfoblastik lösemili bir hastaya 8 farklı kordon kanı bir arada verilmiştir. Bu uygulama sonrasında sadece bir kordon kanı ile engraftman sağlanabilmiş fakat kalıcı olmayıp kısa sürede rejeksiyon gelişmiştir. Daha sonra hematolojik malinitesi veya solid tümörü olan 7 hastaya 2 ila 12 kordon kanı bir arada verilmiştir. Bu çalışmalar ile eş zamanlı olarak çoklu kordon kanı transplantasyonunda hayvan deneyleri de gerçekleştirilmiş ve sonuç olarak birden fazla kordon kanı ünitesinin bir arada kullanılması ile yapılan transplantasyonlardan sonra farelerde daha yüksek oranda başarı sağlandığı ve koyunlarda ise uzun dönemde sadece bir kordon kanının diğerlerine baskın olarak engraftman sağladığı gösterilmiştir. (74). Yakın zaman içinde, hematolojik hastalarda birden fazla kordon kanını bir arada kullanarak yapılan transplantasyonlarla ilgili olarak en kapsamlı faz I/II klinik araştırmanın sonuçları Barker ve arkadaşları tarafından yayınlanmıştır (75). Bu çalışmada yaşları 13 ila 53 arasında olan toplam 23 yüksek risk hastaya myeloablatif hazırlama rejimi sonrasında doku tipi kısmen uygun olan 2 farklı ünite kordon kanı bir arada verilmiştir. Bu hastaların %25’inde kısa dönemde her iki kordon kanı hücreleri ile engraftman sağlanmış olmasına karşın tüm hastalarda +100. günde sadece bir kordon kanı hücrelerinin engraftmanının devam ettiği gösterilmiştir. Bu hastlarda GVHH oranı daha yüksek olmamakla birlikte engraftman oranının daha yüksek olduğu ve transplanta bağlı mortalitenin de daha düşük olduğu gösterilmiştir. Uzun süreli engraftman sağlayan kordon kanı ünitesindeki CD 34+ hücre sayısının verilen ve kalıcı engraftman sağlayamayan diğer kordon kanı ünitesine göre daha fazla olmasına dayanarak diğer ünitenin engraftmanının kısa süreli olmasının nedeninin GVH reaksiyonu olduğu düşünülmektedir. Şu an için özellikle erişkin hastalarda 2 farklı ünite kordon kanının bir arada kullanılması ile transplantasyonun başarısının daha da arttırılabileceğini söyleyebilmek için daha fazla klinik deneyime gereksinim vardır. Wagner ve ark tarafından yapılan bir araştırmada kordon kanından elde edilen HKH’ler yavaş ve hızlı bölünen fraksiyonlara ayrıldıktan sonra bu hücrelerin gen ekspresyon profilleri incelenmiş ve CD34+/CD38+ hücrelerle de karşılaştırılmış. Yavaş bölünen 43 hücrelerde artmış olan genlere bakıldığında CD133, ERG, Siklin G2, MDR1, osteopontin, CLQR1, IFI16, JAK3, FZD6, HOXA9 öne çıkmaktadır. Yavaş bölünen hücrelerde azalan gen ekspresyonları ise CD36, cadherin1 tip, hemoglobin gibi genlerdir. Hücrelerin CD34+/CD3- olanlarında CD34+/CD38+ lere göre ekspresyonu artmış olan genler ise endomucin, ras ilişkin protein, osteopontin, sperm ilişkin antijen 9, ankirin g gibi genlerdir. Buna karşılık azalmış olan genler ise CD38, IL-7R, CD24, Ki67, CD36, HGF, PCNA, Siklin B2, myeloperoksidaz, hyaluronan (rhamm) reseptör sayılabilir. Görüldüğü üzere bu sayılan genlerin azalması veya kazanılması yavaş bölünen ve ilkel hücrelerden hızlı bölünen ve farklılaşabilen hücrelere transformasyonu sağlamaktadır. Bölünme özellikleri ile immunfenotipik özellikler birlikte değerlendirildiğinde yavaş bölünen ve CD34+/CD38- hücrelerde artan genler osteopontin, MDR1, SH3 bağlayıcı protein,mn1 gibi 15 gendir. Buna karşılık farklılaşma gösteren ve CD34+/CD38+ hücrelerde artan genler ise CD36, HDC, Kell kan grup proteini ve GATA1 gibi 12 adet gendir. Yavaş bölünen hücreler ayrıca rhodamine tutulumu ve morfolojik özellikler açısından da farklılık göstermekte ve farklılaşma potansiyeli yüksek hücrelerden ayrılmaktadır. Benzer bir araştırma 2004 yılı Ekim ayında Baylor grubu tarafından farelerde 5-FU modelinde araştırılmış ve aşağıdaki şekilde resmedilen bir modelde HKH’lerin istirahatta ve proliferasyon öncesi hazırlık ve daha sonra proliferasyonda ortaya çıkan değişimler özetlenmiştir. Bu olağanüstü araştırmanın sonuçlarının insana uyarlanabilmesi için benzer deneylerin insan HKH’lerinde de gerçekleştirilmesi gereklidir. Zira fare ve insan HKH’lerinde bazı gen ekspresyon farklılıkları bilinmektedir (76). Sonuç olarak; kordon kanı insan hematopoetik kök hücre transplantasyonu için kemik iliğine alternatif bir kaynaktır. Kordon kanı kök hücresi in vitro ve in vivo koşullarda, genetik profillerine göre çeşitli doku ve organlara farklılaşabilme yeteneğine sahiptir. Günümüzde; kanser gibi pek çok hastalığın tedavisinde kordon kanı kök hücrelerinden yararlanılabilmektedir. Özellikle akut lösemili çocuklarda uygun kemik iliği bulunamadığı durumlarda, kordon kanının oldukça uygun bir kök hücre kaynağı oluşturacağı ifade edilmektedir. Her ne kadar günümüzdeki gelişmeler, kordon kanı kök hücresinin kullanımını yaygın hale getirmese de, ilerleyen zamanlarda kök hücre transplantasyonun önemi daha da artacaktır. 4. 1. KAYNAKLAR Urbano-Ispizua A, Schmitz N, de Witte T, et al. Allogeneic and autologous transplantation for haematological diseases, solid tumours and immune disorders: definitions and current practice in Europe. Bone Marrow Transplant 2002; 29: 639–646. 2. Çetin M, Ertem M. Çocukluk çağı hastalıklarında kemik iliği transplantasyonu endikasyonları. Katkı 2002; 23: 540–550. 3. Kök Hücreleri. Erişim: http://www.Ttb.org.tr./TD/TD125. Erişim Tarihi: 27.10.2006 4. Şahin F, Saydam G, Omay SB (2005). Kök Hücre Plastisitesi ve Klinik Pratikte Kök Hücre Tedavisi. The Turkish Journal of Hematology and Oncology. 15: 48–57. 5. Sağsöz ve Ark. Kök Hücreler Dicle Üniv Vet Fak Derg 2008: 1 (2): 29 – 33. 6. Kök Hücreleri. Erişim: hhtp://www.thehealthnews.org/tr. Erişim Tarihi: 27.10.2006 7. Embriyonik Kök Hücreler ve Potansiyel Uygulama Alanları. Erişim: http://www.tupbebekgenetik.com/kokhucre. Erişim Tarihi: 27.10.2006. 8. Stem Cell Basics. Erişim: http://www.eurekalert.org. Erişim Tarihi: 27.12.2008. 9. Kansu E (2005). Kök Hücre Biyolojisi ve Plastisitesinde Güncel Kavramlar. Hacettepe TıpDergisi. 36:191–197. 10. Kansu E. Stem hücre plastisitesi. XIII. TPOG Ulusal Pediatrik Kanser Kongresi. 18–22 Mayıs 2004. 11. Stem Cell. Erişim: http://www.stemcellresearchnews.com. Erişim Tarihi: 27.12.2008. 45 12. Aktaş Y, Aydoğdu S, Diker E (2003).Kardiyovasküler Tedavide Yeni Ufuklar: Hücresel Kardiyomiyoplasti ve Kök Hücre Transplantasyonu. Anadolu Kardiyol Derg. 3: 340–7. 13. Prockop DJ (1997). Marrow Stromal Cells As Stem Cells For Nonhematopoietic Tissues. Science. 276:71–4. 14. Pittenger MF, Mackay AM, Beck SC (1999).Multilineage Potential Of Adult Human Mesenchymal Stem Cells Science. 284:143–7. 15. Wang JS, Shum-Tim D, Galipeau J, Chedrawy E,Eliopoulos N, Chiu RC (2000). Marrow Stromal Cells For Cellular Cardiomyoplasty: Feasibility And Potential Clinical Advantages. J Thorac Cardiovasc Surg. 120:999–1006. 16. Florian P. Limbourg and Helmut Drexler. Bone Marrow Stem Cells for Myocardial Infarction: Effector or Mediator? Circ. Res. 2005;96;6-8. 17. Kök Hücre Teknolojisi. Erişim: hhtp://www.kokhucre.com. Erişim Tarihi: 27.10.2006 18. Vanderson R, Federico G, Irina I, Eliane G. Hematopoietic stem-cell transplantation using umbilical-cord blood cells. Revista de Investigacion Clinica 2005;57:314-23 19. Rogers I, Casper RF. Stem cells: you can’t tell a cell by its cover. Human Reprod Update 2003;9:25–33 20. Sirchia G, Rebulla P. Placental/umbilical cord blood transplantation. Haematologica 1999;84:738 47 21. Garban F, Ericson M, Roucard C. Detection of empyt HLA class II molecules on cord blood cells. Blood 1996;87: 3970–6 22. Gardiner CM, O’Meara A, Reen DJ. Differential cytotoxicity of cord blood and bone marrow derived natural killer cells. Blood 1998;91:207–13 23. Min Lee S, Suen Y, Chang L. Decreased interleukin 12 from activated cord versus adult peripheral blood mononuclear cells and upregulation of interferon g,natural killer, and lymphokine activated killer activity by IL–12 in cord blood mononuclear cells. Blood 1996;88:945–54 24. Satkiran S. Grewal, Juliet N. Barker, Stella M. Davies, and John E. Wagner. Unrelated donor hematopoietic cell transplantation: marrow or umbilical cord blood? Blood 2003;101:4233–44 25. Hows JM. Status of umbilical cord blood transplantation in the year 2001. J Clin Pathol 2001;54:428–34 46 26. Solves P, Moraga R, Saucedo E, Perales A, Soler MA, Larrea L et al. Cord blood stem cells. Comparison between two strategies for umbilical blood collection. Bone Marrow Transplant 2003;31:269–73 27. Bülbül Baytur Y, Sen C.Kordon Kanı Bankacılığı: Neden, Kime, Nasıl? Perinatoloji Derg. 2004;12:1-10 28. Wong A, Yuen PM, Li K, Yu AL, Tsoi WC. Cord blood collection before and after placental delivery: levels of nucleated cells, haematopoietic progenitor cells, leukocyte subpopulation and macroscobic clots. Bone Marrow Transplant 2001;27:133–8 29. American Academy of Pediatrics. Work Group on Cord Blood Banking. Cord Blood Banking for Potential Future Transplantation: Subject Review (RE9860). http//:www.aap.org/policy 30. Rubinstein D, Dabrila L, Rosenfield RE. Processing and cryopreservation of placental/ umbilical cord blood for unrelated bone marrow reconstitution. Proc Natl Acad Sci USA 1995;92:10119–22 31. Donaldson C, Buchanan R, Webster J, Laundy V, Horsley H, Barron C et al. Development of a district cord blood bank: a model for cord blood banking in the National Health Service. Bone Marrow Transplant 2000;25:899–905 32. Armitage S, Fehily D, Dickinson A, Chapman C, Navarrete C, Contreras M. Cord blood banking: volume reduction of cord blood units using a semi-automated closed system. Bone Marrow Transplant 1999;23:505–9 33. Lazzari L, Lucchi S, Montemurro T, Porretti L, Lopa R, Rebulla P et al. Evaluation of the effect of cryopreservation on ex vivo expansion of hematopoietic progenitors from cord blood. Bone Marrow Transplant 2001;28:693- 8 34. Laurenti L, Perrone MP, Bafti MS, Ferrai F, Screnci M, Pasqua I et al. HLA typing strategies in a cord blood bank. Haematologica 2002;87:851–4 35. Ertem M. Kök Hücre ve Kordon Kanı. 2006;1-8 36. Kök Hücre Biyolojisi ve Klinik Uygulamalar, Meral Beksaç, Ankara, 2006 s.32 37. Gluckman E. Current status of umbilical cord-blood hematopoietic stem cell transplantation. Experiment Hematol 2000; 28: 1197-1205. 38. Sanz GF, Saavedra S, Planelles D, et al. Standarized, unrelated donor cord blood transplantation in adults with hematological malignancies. Blood 2001; 98: 2332-38. 47 39. Rocha V, Wagner JE, Sebocinski KA, et al. Graft-versus-host disease in children who have received a cord-blood or bone marrow transplant from an HLA-identical sibling. N Eng J Med 2000; 342: 1846-54. 40. Gluckman E, Rocha V, Boyer Chammard A, et al. Outcome of cord-blood transplantation from related and unrelated donors. N Eng J Med 1997; 337: 373-9. 41. Rocha V, Cornish J, Sievers EL, et al. Comparison of outcomes of unrelated bone marrow and umbilical cord blood transplants in children with acute leukemia. Blood 2001; 97: 2962-71. 42. Barker JN, Davies SM, DeFor T, et al. Survival after transplantation of unrelated donor umbilical cord blood is comparable to that of human leukocyte antigen-matched unrelated donor bone marrow: result of a matched-pair analysis. Blood 2001; 97: 2957-61. 43. Denning-Kendall PA, Nicol A, Horsley H, et al. Is in vitro expansion of human cord blood cells clinically relevant? Bone Marrow Transplant 1998; 21: 225-32. 44. RW. Georgantas, V.Tanadve, M.Malehorn, S.Heimfeld ve ark. Microarray and serial analysis of gene expression analyses identify known and novel transcripts overexpressed in hematopoietic stem cells. Cancer Research 2004,64:4434–4441. 45. Attar E. Kök Hücreler ve Kordon Kanı Toplanmasında Güncel Durum. TJD Uzmanlık Sonrası Eğitim Derg. 2004;6:58-64 46. Grove JE, Bruscia E, Krause DS. Plasticity of bone marrow-derived stem cells. Stem Cells 2004; 22: 487-500. 47. Daley GQ, Goodell MA, Snyder EY. Realistic prospects for stem cell therapeutics. Hematol (ASH Educ Program) 2003: 398-418. 48. Petersen BE, Bowen WC, Patrene KD, et al. Bone marrow as a potential source of hepatic oval cells. Science 1999; 284: 1168-1170. 49. Ende N, Chen R, Reddi AS. Effect of human umbilical cord blood cells on glycemia and insulitis in type I diabetic mice. Biochem Biophys Res Comm 2004; 325: 665-669. 50. Ende N, Chen R. Parkinson’s disease mice and human umbilical cord blood. J Med 2002; 33: 173-80. 51. Vendrame M, Cassady J, Newcomb J, et al. Infusion of human umbilical cord blood cells in a rat model of stroke dose-dependently rescues behavioral deficits and reduces infarct volume. Stroke 2004; 35: 2390-2295. 48 52. Altunbasak A. Isparta Süleyman Demirel Üniversitesi Tıp Fakültesi Bünyesinde Kemoterapi Tedavisi Gören Lösemi Hastalarında G-Bantlama Metodu İle Sitogenetik Analizler. 2006;35:1-60 53. By Marshall A, Lichtman and Robert I. Peripheral Cytoplasmic Characteristics of Leukocytes in Monocytic Leukemia: Relationship To Clinical Manifestations. Blood 1972;40:52-61 54. Ali R. Akut Lösemiler Who Sınıflaması Ve Nadir Akut Lösemi Tipleri. 2006;1-5 55. İlhan O. Kronik Miyelositer Lösemi. 2004;1-13 56. Robert J, Guıet C, Pasquıer L. Lymphoid Tumors of Xenopus laevis with Different Capacities for Growth in Larvae and Adults. Developmental Immunology, 1994, 3:297307 57. Anak S. Çocukluk Çağı Lösemilerinde HKHT Endikasyonları. 2010;52-9 58. Locatelli F, Nöllke P, Zecca M, et al: Hematopoietic stem cell transplantation (HSCT) in children with juvenile myelomonocytic leukemia (JMML): Results of the EWOGMDS/EBMT trial. Blood 2005;105:410-419. 59. E Jabbour, JE Cortes, FJ Giles, S O'Brien. Current and Emerging Treatment Options in Chronic Myeloid Leukemia. Cancer 2007, 109:2171-81 60. Hansen JA, Gooley TA, Martin PJ ve ark. Bone marrow transplants from unrelated donor for patients with chronic myeloid leukemia. N Engl J Med 338:962, 1998 61. Barret J. Allogeneic stem cell transplantation for chronic myeloid leukemia. Seminar Hematol 2003, 40: 59-71 62. Gorkey S. Ve ark. Kök Hücre Araştırmalarının Etik ve Hukuk Boyutuna İlişkin Rapor. 2008;3-27 63. J.E.S. Hansen, Embryonic Stem Cell Production through Therapeutic Cloning has Fewer Ethical Problems than Stem Cell Harvest from Surplus IVF Embryos. J. Med. Ethics 2002:28:86-88. 64. J.R. Meyer: Human Embryonic Stem Cells and Respect for Life. J. Med. Ethics 2000:26:166-170. 65. K. Devolder: Creating and Sacrificing Embryos for Stem Cells. J. Med. Ethics 2005:31:366-370. 66. Boyd KM. Medical ethics: principles, persons, and perspectives: from controversy to conversation. J Med Ethics 2005;31:481–486. 49 67. Özel H.B, Ozan E, Dabak Ö. Embriyonik Kök Hücreler. Türkiye Klinikleri J Med Sci 2008;28:333-41 68. Brüstle O, Spiro AC, Karram K, Choudhary K, Okabe S, McKay RD. In vitro-generated neural precursors participate in mammalian brain development. Proc. Natl. Acad. Sci. USA 1997:94:14809-14. 69. Ende M., & Ende, N. Hematopoietic transplantation by means of fetal (cord) blood. A new method, Virginia Medical Monthly 99(3):276-80,1972. 70. Shono Y, Toubai T. et al. Abnormal expansion of naı ¨ve B lymphocytesafter unrelated cord blood transplantation – acase report. Clin. Lab. Haem. 2006;28:351-4 71. Michel G, Rocha V, Chevret S, Arcese W, Chan KW, et al. Unrelated cord blood transplantation for childhood acute myeloid leukemia: a Eurocord Group analysis. Blood, Dec 15;102(13):4290- , 2003. 72. Ooi J, Iseki T, Takahashi S, Tomonari A, Takasugi K,et al. Unrelated cord blood transplantation for adult patients with de novo acute myeloid leukemia. Blood, Jan 15;103(2):489-91, 2004. 73. Devine SM, Lazarus HM, Emerson SG. Clinical application of hematopoietik progenitor cell expansion: current status and future prospects. Bone Marrow Transplant 2003; 31: 241-52. 74. Ertem M. Kordon Kanı Transplantı, Nereye Gidiyoruz? 2008;127-133 75. Barker JN, Weisdorf DJ, DeFor TE, et al. Transplantation of 2 partially HLA-matched umbilical cord blood units to enhance engraftment in adults with hematological malignancy. Blood 2005; 105: 1343-1347. 76. W.Wagner, A.Ansorge, U.Wrkner, U.Wirkstein ve ark. Molecular evidence for stem cell function of the slow dividing fraction among human hematopoietic progenitor cells by genome-wide analysis. Blood 2004,104:675–682.Tunalı A. Kan hastalıkları. Editör: Prof. Dr. Öbek A. İç hastalıkları, 4. baskı, Bursa, 1990. ÖZGEÇMİŞ Şahin ARAL, 18 Nisan 1987 Kayseri doğumludur. İlköğrenimine Hacılar Muhittin Tatar İ.Ö.O.’da başlamış ve yine Hacılar’daki Yunus Çepken İ.Ö.O.’da ilkörenimini tamamlamıştır. Ortaöğrenimini Kayseri Lisesi’nde tamamladıktan sonra, 2005 yılında Erciyes Üniversitesi Eczacılık Fakültesi’ni kazanmış ve halen bu okulda öğrenimine devam etmektedir. Şahin ARAL Yeni M. Kayseri C. Çıkmaz S. No:2 Hacılar\KAYSERİ Tel: 0 506 518 52 14 e-mail : sahinaral@hotmail.com