http://mesutsahin.org
1/4
http://mesutsahin.org
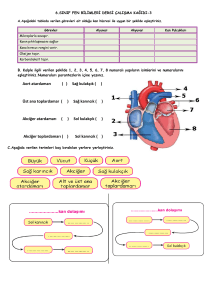
Venöz Kan Alımı
Kanı alınacak kişinin kendisini rahat hissedeceği bir pozisyona gelmesi sağlanır. Kan
alacak kişinin tek kullanımlık lateks eldiven giymesi çok önemlidir. Kanın alınacağı tüpler,
turnike, iğne, holder(vacutainer) ve %70’lik alkolle ıslatılmış pamuk hazırlanır. Dirseğin 1015 santimetre yukarısına turkine bağlanır ve dirsek içindeki d amarlardan biri seçilir, seçilen
damarın üzeri %70 alkolle ıslatılmış pamukla içten dışa ve aşağıdan yukarı doğru dairesel
hareketlerle silinip kuruması beklenir. Holder’a takılan iğnenin steril ucu açılır. Kesik u ç
yukarı bakacak şekilde dar açıyla damara girilir ve 1 santimetre kadar damarda ilerletilir. Bir
elle holder tutulurken diğer elle de tüpler takılır, gerekirse değiştirilir. Damara g irildikten
hemen sonra t urnike açılabilir fakat kan alma işlemi bittikten sonra iğne damardan
çıkarılmadan önce mutlaka açılmalıdır aksi takdirde venden kan akabilir. İğnenin çıkarıldığı
yere kuru bir pamukla 5 dakika kadar bastırılır. Bu esnada kolun kıvrılması veya iğne yerinin
ovalanması hem kanın durma süresini uzatabilir hem de bölgesel morarmaya yol açabilir.
Kapiller Kan Alımı
Kapiller kan alımı genellikle parmak ucundan gerçekleştirilir. Kullanılmayan elin orta
veya yüzük parmağı (genellikle yüzük parmağı) %70’lik alkolle ıslatılmış pamuk ile s ilinip
kuruması beklenir. Parmağın iç kısmından tırnaktan yaklaşık 1 s antimetre uzaktan tek
kullanımlık s teril lansetle 3 -4 mm kadar delinir. İlk gelen kan damlası kuru bi r pa mukla
silinip atılır, sonraki damlalar analizler için kullanılabilir.
Kanama Zamanı Tayini
Duke yönteminde kapiller kan alımı başlığında anlatıldığı gibi parmak ucu delinip ilk
damla s ilindikten s onra, temiz bir kurutma kağıdı her 30 s aniyede b ir de linen böl geye
değdirilir. Kağıda kanın bulaşmadığı süre kanama zamanı olarak kaydedilir. Kan veren kişinin
hareketsiz durması ve parmağa baskı uygulanmaması gerekir.
Pıhtılaşma Zamanı Tayini
Lam yönteminde, uygun biçimde alınan kapiller kandan iki damla temizlenmiş bir lam
üzerine alınır. Damlalardan biri her 30 saniyede bir kan alınan lansetle kontrol edilerek fibrin
iplikçiği oluşup oluşmadığına bakılır. İlk damlada fibrin gözlemlendikten sonra ikinci
damlaya g eçilir (ilk damla 30 saniyede bir karıştırıldığı için daha erken pıhtılaşır) ve o
damladaki fibrin oluşumu her 30 saniyede bir kontrol edilir. İkinci damlada fibrin
oluşumunun görüldüğü süre pıhtılaşma zamanı olarak kaydedilir.
Hipertonik(Çok Yoğun), İzotonik(Eş yoğun) ve Hipotonik (Az Yoğun) Çözeltilerin
Alyuvar Morfolojisine Etkisi
Hücreler seçici geçirgen zar yapısına sahip oldukları için iç ortamlarından daha yoğun bir
ortama konduklarında yapılarından su kaybederek büzüşür, az yoğun ortama konduklarında
ise su alarak şişerler. Hayvan hücrelerinde bu şişme bir noktadan sonra hücrelerin patlamasına
yol açar(sitoliz). Bu deneyde lam üzerine damlatılmış %10luk(hipertonik), %0,9luk(izotonik)
NaCl çözeltileri ve saf su(hipotonik) içine pıhtılaşması önlenmiş kan eklenerek mikroskop
http://mesutsahin.org
1/4
http://mesutsahin.org
http://mesutsahin.org
2/4
http://mesutsahin.org
altında alyuvarların morfolojilerine bakılır. Hipertonik ortamda alyuvarların büzüştüğü,
hipotonik ortamda şişerek patladıkları, izotonik ortamda ise tipik tavla pulu görünümlerini
korudukları gözlenir
Santrifüj Edilen Pıhtılaşması Engellenmiş Periferik Tam Kandaki Yapıların Yaklaşık
Yüzdeleri
Lökositlerin Genel Şekillleri
http://mesutsahin.org
2/4
http://mesutsahin.org
http://mesutsahin.org
HÜCRE TİPİ
Eritrosit
Lökosit
3/4
http://mesutsahin.org
KAN HÜCRELERİNİN ÜRÜN VE GÖREVLERİ
TEMEL ÜRÜN
TEMEL GÖREV
Hemoglobin
O2 ve CO2 Taşınması
Spesifik granüller ve
modifiye lizozomlar
(azürofilik granüller)
Bakteri Fagozitozu
Spesifik granüller ve
farmakolojik aktif
bileşenler
Oparazitik Helmintlere karşı savunma ve
inflamasyon düzenlenmesi
Bazofil
Histamin ve heparin
içeren spesifik granüller
Histamin ve diğer inflamasyon
düzenleyicilerinin salınması
Lenfosit (B, T,
NK)
Immunoglobulinler,
hücre öldüren ve diğer
lökositlerin aktivitesini
düzenleyen yapılar
Virüsle enfekte hücrelerin veya tümör
hücrelerinin öldürülmesi, antikor üretimi
Nötrofil
Eozinofil (Asidofil)
Monosit
Lizozomal enzimler
içeren granüller
Kan Pulcuğu
Pıhtılaşma faktörleri
Doku fagositlerine dönüşerek parazitik
protozoonların, virüsle enfekte hücrelerin
ve yaşlı hücrelerin öldürülmesi
Pıhtılaşma ve yara oluşumu
Alyuvar Osmotik Direncinin Belirlenmesi
Alyuvarlar düşük
yoğunlukta tuz çözeltilerine konulduğunda şişerek
patlarlar(deplazmoliz, sitoliz) ve alyuvar içeriği dışarı çıkar(hemoliz). Geriye kalan alyuvar
zarına ‘alyuvar hayaleti’ denir. Bu yöntemde 10 adet deney tüpüne %1’den başlayıp, %0,1’lik
oranlarla az alan yoğunlukta (%1; %0,9; %0,8 …) NaCl çözeltisi konulur ve bu deney
tüplerine 1-2 damla hasta kanı damlatılır. Tüpler 1-2 defa ters çevrilerek kanın çözelti içinde
dağılması sağlanır. 10 dakika kadar beklendikten sonra alyuvarların parçalanıp
parçalanmadıkları tüplerin arkasında tutulan bir kitaptaki yazıların okunup okunmamasına,
yüksek konsantrasyondan düşük konsantrasyona doğru bakılarak kontrol edilir. Yazıların ilk
defa okunmaya başladıkları konsantrasyon minimal osmotik direnç, net olarak okundukları
konsantrasyon ise maksimal osmotik direnç noktası olarak işaretlenir. Dolaşımdaki
alyuvarların şekli ve içerikleri ile ilgili fikir veren, klinikte önemli bir yöntemdir.
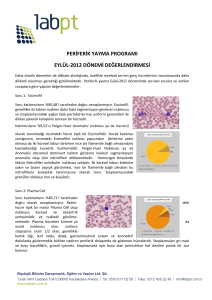
Kan Hücrelerinin Boyanması
Kan hücreleri genellikle bir damla kanın lam üzerine ince bir tabaka oluşturacak
şekilde yayılmasıyla elde edilen yaymalarla çalışılır. Kan lam üzerinde homojen bir tabaka
oluşturacak şekilde yayılmalı ve hızla havada kuruması sağlanmalıdır. Bu şekilde hazırlanmış
yayma preparatlarda kan hücreleri kolayca tanınıp birbirinden ayırt edilebilir. Böylece
sitoplazmaları yayılarak çekirdeğin ve sitoplazmik organizasyonlarının görüntülenmesini
kolaylaştırır.
Kan yaymaları rutin olarak kırmızı(asidik) ve mavi(bazik) boyaların özel
karışımlarıyla boyanır. Bu karışımlar ayrıca azürofilik olarak bilinen bazı kan yapılarının
http://mesutsahin.org
3/4
http://mesutsahin.org
http://mesutsahin.org
4/4
http://mesutsahin.org
boyanmalarında kullanışlı azür(açık mavi) bileşenler de içerir. Bu özel karışımların çoğu
orjinal karışımdan kendi modifikasyonlarını yapmış araştırıcıların adlarıyla anılır(Giemsa,
Wright, L eisshman g ibi). Giemsa boyamadan önce kısa süreli bir kimyasal fiksasyon
(metanol) basamağı vardır. Boyanın uygulama süresi yaklaşık 30 dakikadır.
KAN YAPILARININ SAYI VE YÜZDELERİ (Kan Sayımı)
µL'DEKİ YAKLAŞIK
YAPI TİPİ
YAKLAŞIK YÜZDE
SAYI
Kadın: 3,9-5,5 X 106
Eritrosit
Erkek: 4,1-6 X 106
Toplam eritrosit sayısının yaklaşık %1'i
Retikülosit
6000-10.000
Lökosit
Nötrofil
5.000
%60-70
Eozinofil
150
%2-4
Bazofil
30
%0,5
Lenfosit
2.400
%28
Monosit
350
%5
Kan
300.000
Pulcuğu
Formül Lökosit (Lökosit Formülü, Froti)
ETİKET
Yayma kan preparatlarında, lökositlerin tiplerine göre ayrılmasıyla elde edilen
yüzdelerdir. Klinik öne me s ahiptir, her ne kadar günümüzde otomatik makineler tarafından
yapılabiliyor olsa da hala manuel yapılmasına ihtiyaç duyulduğu durumlar ortaya
çıkabilmektedir. İmmersiyon objektifi ile farklı sahalardan toplam 100 veya 100’ün katı
lökosit sayılır ve tiplerine göre ayrılarak yüzde oranlar elde edilir. Kullanımdan sonra
immersiyon objektifi alkol-eter (1:1) karışımıyla silinir.
Lamda lökosit formülü (Froti) belirlenirken saha seçiminde izlenecek yol.
http://mesutsahin.org
4/4
http://mesutsahin.org